查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
细胞功能实验是生物医学科研人的必备技能之一,旨在通过对细胞进行处理或操作,来研究细胞功能和相关生物学进程。细胞功能实验可以揭示细胞在特定条件下的功能和表型变化,主要体现在细胞增殖、凋亡、迁移、侵袭、成管和黏附等过程。此外,还可借助细胞功能实验评估细胞对外界环境的应答和适应能力,以及研究疾病的发病机制、筛选药物靶点、评估药物毒性等,是探讨核心科学问题的重要手段。

近期系列干货将对细胞功能性实验进行逐一和全面的介绍,本期先分享两个基础的功能性实验指标——细胞增殖和细胞凋亡,将从细胞增殖与凋亡的定义、细胞增殖与凋亡的检测以及细胞增殖与凋亡实验常见问题的解析三大主要方面拓展介绍。
一、细胞增殖与凋亡的定义
1. 什么是细胞增殖?
细胞增殖(Cell Proliferation)是指细胞通过有丝分裂或减数分裂产生新细胞的过程,其中有丝分裂是最常见的增殖方式,包括DNA复制和细胞质分裂,最终产生两个基因组完全相同的子细胞。细胞增殖对于多细胞生物生长、发育、修复和再生至关重要,是维持生命活动的核心过程。
2. 什么是细胞凋亡?
细胞凋亡(Apoptosis)是指机体在生理或病理条件下,为了维持自身内环境稳态,通过基因调控而产生的主动、有序的细胞死亡。其主要形态特征是形成凋亡小体。细胞凋亡在生物体的发育、组织稳态以及疾病的发生中起着至关重要的作用。
3. 细胞增殖和细胞凋亡之间有什么联系?
细胞增殖与细胞凋亡之间的平衡对维持多细胞生物体的健康至关重要。正常的细胞增殖确保了新细胞的产生,而细胞凋亡则有助于去除受损或不再需要的细胞。当这个平衡失调时,可能导致肿瘤形成或其他疾病的发生。例如,在癌症中,细胞失去控制地增殖,同时抵抗凋亡信号。因此,细胞增殖和凋亡水平成为评估细胞活性、药物毒性、疾病诊断和治疗反应的关键指标。
二、细胞增殖与凋亡的检测
1. 细胞增殖检测指标及方法
1.1 细胞数量
细胞计数是检测增殖最直接的方法,通过显微镜下人工计数或使用自动化细胞计数仪(如台盼蓝染色排斥法,或流式细胞术),计算单位体积或面积内的细胞数量。其特点是直观且简便,适用于各种细胞类型,通常情况下不需要特定的仪器和试剂;但是人工计数比较耗时,易受人为统计误差的影响,不适合大规模样本的计数。
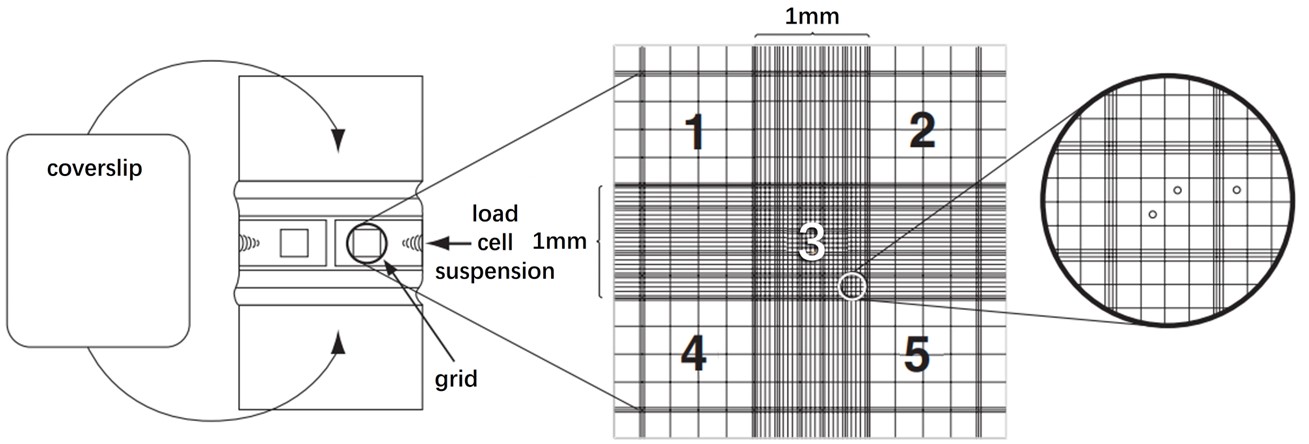
图1. 细胞计数板示意图[1]
1.2 细胞代谢活性
活细胞的线粒体代谢能力较强,可以将一些还原染料(如MTT、CCK-8、XTT、MTS及SRB)代谢为有色物质,其显色深度(或吸光度)与活细胞数量呈正比。通过分光光度计或酶标仪测量吸光值,可反映细胞增殖和代谢活性。这里主要介绍MTT法和CCK-8法。

图2. MTT反应呈蓝紫色(左),CCK-8反应呈橙黄色(右)(图片源于网络,仅供参考学习)
1.2.1 MTT法
MTT是一种黄色水溶性四唑盐,在代谢正常的活细胞中被还原生成蓝紫色甲臜结晶。检测时需先吸弃培养基,加入DMSO溶解甲臜,在490 nm波长下检测OD值。虽然MTT法简单快捷,但DMSO对细胞有一定的毒性,可能影响实验结果的准确性。另外,MTT法不适用于悬浮细胞,检测前吸出培养基可能导致细胞丢失(甲臜流失),造成实验结果偏差。
1.2.2 CCK-8法
相比于MTT法,CCK-8法在操作简便性、灵敏度、兼容性和细胞毒性等方面有所改进。CCK-8试剂盒含水溶性的四唑盐WST-8,可在活细胞中被还原为水溶性橙黄色甲臜产物,无需额外的溶解步骤,用酶标仪在450 nm波长处检测其OD值即可。但这种水溶性甲臜在光照下不稳定,因此需尽快检测,或加1% w/v SDS后可在24 h内检测。
1.3 DNA合成
细胞增殖期间会伴随DNA的合成,利用胸苷类似物(如EdU或BrdU)替代胸苷(T)被DNA复制活跃的细胞摄取并整合入新合成的DNA链中。通过特异性抗体或荧光染料检测这些标记物,即可识别并量化正在增殖的细胞。

图3. EdU(左)和BrdU(右)标记DNA示意图
1.3.1 EdU染色
EdU(5-乙炔脱氧尿嘧啶)是一种T类似物,掺入复制中的DNA后用含有叠氮基团的荧光染料(如Azide标记的硫蒽红、Apollo®荧光染料等)进行特异性标记,随后通过荧光显微镜或流式细胞仪观察分析。该方法特异性强、灵敏度高、对细胞影响较低,实验流程简单且可以兼容多色荧光标记。如图4结果所示[2],与野生肺泡Ⅱ型上皮(AT2)细胞相比,Prkg2缺失的AT2细胞中EdU染色减少,表明Prkg2可促进AT2细胞增殖。
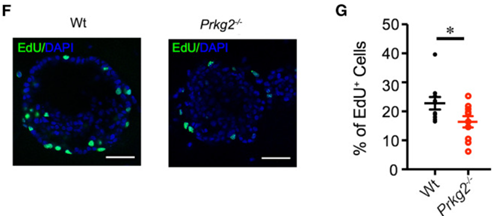
图4. EdU染色检测细胞增殖[2]
1.3.2 BrdU染色
BrdU(5-溴脱氧尿嘧啶核苷)也是T类似物,它的结构中包含一个溴原子取代了T的甲基基团。BrdU与细胞共孵育一段时间后,将DNA固定并变性,使用BrdU特异性一抗和荧光标记二抗进行反应后观察荧光比例。BrdU染色操作流程相对复杂,可能对细胞造成损伤及非特异性结合,成本也相对较高。如下图显示[3],在神经胶质瘤细胞(U87MG,U251MG)和神经胶质瘤干细胞(GSC-3#)中敲低TRIM44基因,BrdU染色比例均显著少于对照组,表明细胞增殖被抑制。
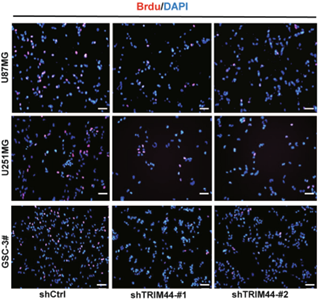
图5. BrdU检测U87MG、U251MG和GSC-3#敲低TRIM44基因后对细胞增殖的影响[3]
1.4 细胞增殖相关标志物
细胞增殖标志物通常是仅在细胞分裂期表达而G0期不表达的蛋白,目前最常用的标志物有Ki-67、PCNA和MCM-2,均可通过qPCR、Western Blot或免疫荧光等方法检测。如下图6显示[4],与野生型小鼠相比,IL-33转基因小鼠中接种的MC38细胞(小鼠结直肠癌细胞系)增殖标志物Ki67、PCNA表达显著上调,且CCK-8结果显示细胞活力明显增加,表明IL-33可促进肿瘤细胞增殖。
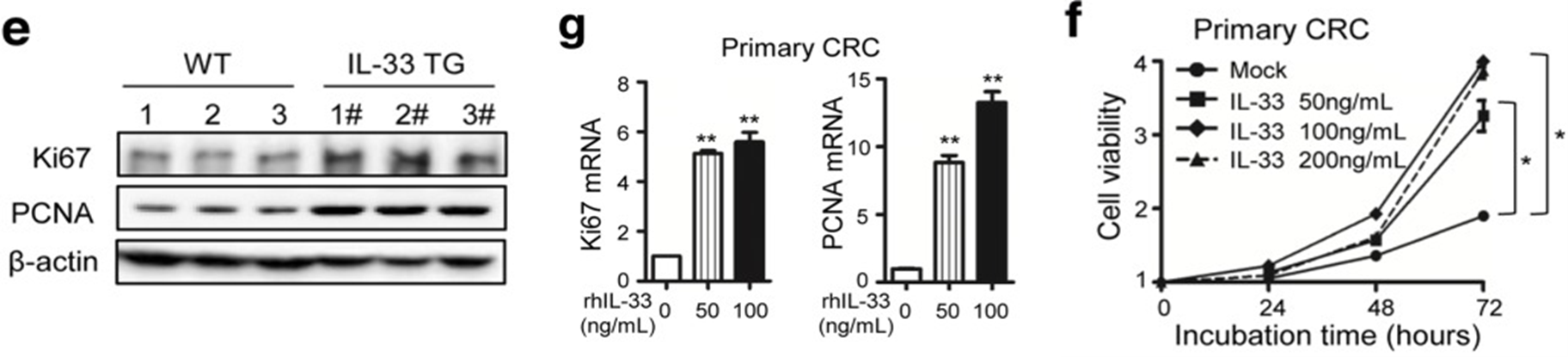
图6. IL-33促进肿瘤细胞增殖[4]
2. 细胞凋亡检测指标及方法
2.1 细胞形态
透射电镜(TEM)是目前观察细胞凋亡最直接、经典且可靠的方法,被认为是金标准。TEM可以观察到凋亡细胞的主要形态学特征:细胞体积缩小、细胞连接消失、染色质固缩、细胞膜起泡、晚期可见形成的凋亡小体。但TEM观察操作复杂,成本较高,且观察区域有限,不适合大量样本的观察。此外,光学显微镜也可以观察到形态学的变化,但分辨率不足,仅适用于初步的观察。
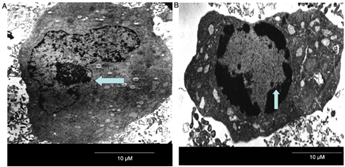
图7. TEM观察细胞凋亡(图A为正常细胞形态;图B为凋亡细胞,可观察到核仁固缩且分散于核膜周围,并出现凋亡小体)[5]
2.2 细胞结构功能
2.2.1 细胞膜通透性
Annexin V/PI双染法是检测细胞凋亡最常用的方法之一,可采用流式细胞仪检测或用荧光显微镜观察分析。Annexin V是一种Ca2+依赖性的磷脂结合蛋白,对磷脂酰丝氨酸(PS)具有很高的亲和力,能与细胞膜外翻的PS结合,用于识别早期凋亡细胞。碘化丙啶(PI)是一种不能透过活细胞膜的核酸染料,仅在凋亡晚期细胞膜通透性增加后入核,嵌入DNA后可激发出红色荧光。以图8流式结果展示说明[6],落在Q4区(Annexin V-/PI-)的属于正常细胞,落在Q3区(Annexin V+/PI-)的细胞处于凋亡早期,而位于Q2区(Annexin V+/PI+)的则是凋亡晚期的细胞,落在Q1区(Annexin V-/PI+)表示坏死细胞,研究凋亡时该区域细胞比例越高,则实验结果越不可信。
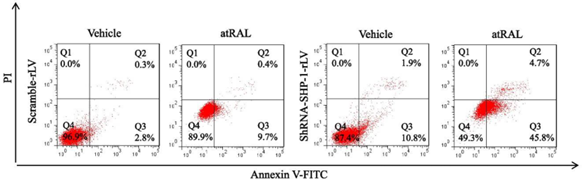
图8. Annexin V/PI双染的细胞凋亡流式结果[6]
2.2.2 线粒体膜电位(MMP)
MMP下降甚至消失是细胞凋亡发生的最早期事件,在细胞形态学变化出现之前。可使用亲脂性阳离子染料如JC-1或TMRM等检测MMP的变化,JC-1在MMP较高的时会形成聚合体,并发出红色荧光;在低MMP时保持单体状态,呈绿色荧光;而TMRM的荧光强度与MMP呈正比。图9结果中[6],作者使用全反式视黄醛(atRAL)诱导视网膜色素上皮细胞(RPE)凋亡,发现RPE中绿色荧光(JC-1单体)增加、红色荧光(JC-1聚合体)减少,同时敲低SHP-1基因后绿色荧光更明显且比例显著增加,提示RPE细胞凋亡期间MMP下降。
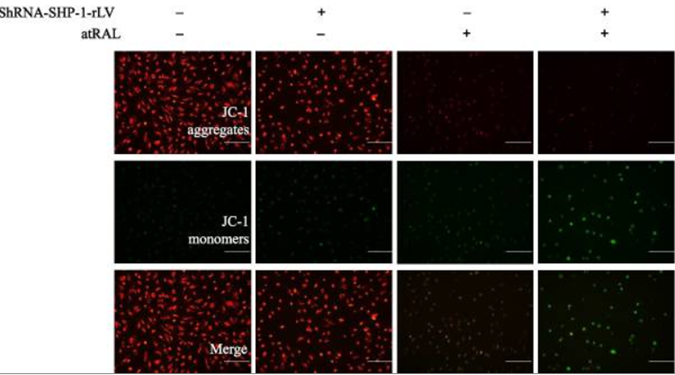
图9. JC-1检测凋亡细胞中的MMP[6]
2.3 生化分子检测
2.3.1 DNA片段化
(1)凝胶电泳:细胞凋亡期间,染色质DNA在核小体单位之间的连接处断裂,形成规律的180-200bp或其整倍数的DNA片段,在凝胶电泳上表现为梯状带电泳图谱。
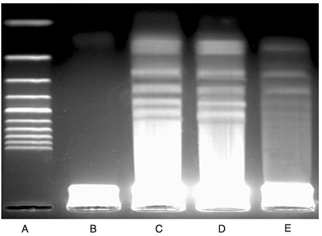
图10. 凋亡细胞的DNA电泳结果图(A为marker,B为正常细胞,C-E为凋亡细胞)[5]
(2)原位末端缺口标记法(TUNEL法):断裂的DNA会产生大量的粘性3’-OH末端。TUNEL法的原理是通过用重组末端脱氧核苷酸转移酶(rTdT酶)在断裂DNA的3’-OH末端催化掺入带有荧光素标记的dUTP,可采用荧光显微镜或流式细胞仪进行定量分析。如图11是采用ART(青蒿琥酯)和5-Fu(5-氟尿嘧啶)分别诱导HCT116细胞凋亡[7],与对照组相比,经药物处理的HCT116细胞的TUNEL染色显著增加。
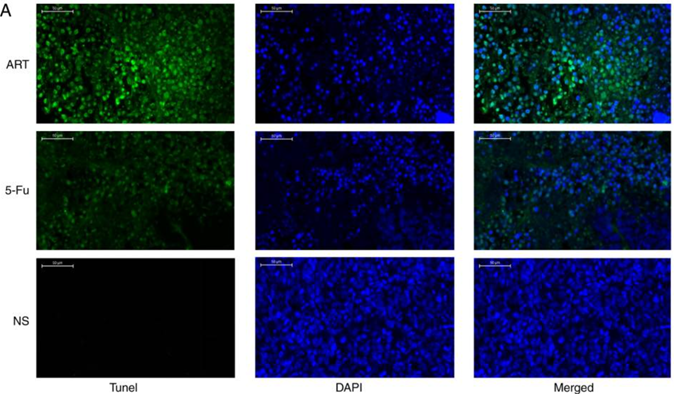
图11. TUNEL染色检测细胞凋亡[7]
2.3.2 细胞凋亡标志物
Caspase-3是经典的细胞凋亡标志物,线粒体功能障碍会促进细胞色素C(Cyt C)释放到胞浆,与凋亡酶激活因子Apaf-1结合以激活Caspase-9,进而活化Caspase-3。Caspase-3正常以32kd的酶原形式存在,在凋亡早期被切割形成Cleaved Caspase-3(大亚基17kd,小亚基12kd)而被激活,以执行最后的凋亡程序。另外,Bcl-2蛋白家族也与细胞凋亡密切相关。例如细胞凋亡期间,抗凋亡蛋白Bcl-2下调,促凋亡蛋白Bax表达上调。这些标志物均可通过qPCR、Western blot或免疫荧光等方法检测。图12的结果[7]与图11对应,ART和5-Fu分别处理HCT116细胞后,凋亡标志物Cleaved Caspase-3、Bax表达上调,抗凋亡标志物Bcl-2表达下调。
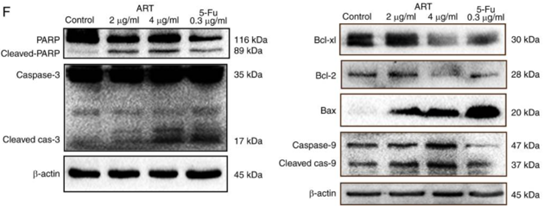
图12. WB检测细胞凋亡相关标志蛋白的表达[7]
三、细胞增殖与凋亡实验常见问题的解析
Q1:CCK-8的实验数据为什么重复性差?
A:可以考虑以下原因:① 样本孔内有气泡,干扰酶标仪读数;② CCK-8试剂沾壁,混合不均匀;③ 最外圈样本孔的溶液易挥发,导致检测不准确,可在样本孔的最外圈仅加培养基,有效维持样本孔的溶液体积。④ 细胞过多或过少,建议预实验摸索合适的细胞数量。
Q2:CCK-8检测细胞增殖前,细胞需要用药物处理,是否会影响检测结果?
A:CCK-8的检测原理本身是一种还原反应,因此处理细胞的药物如果是具有还原性或药物本身会吸收光,则建议加CCK-8之前更换培养基,以去掉药物的影响。
Q3:为什么整个细胞都有EdU信号,或是背景信号很强?
A:通常可能是染色后洗涤不充分,导致出现大量的非特异性染色,染色后注意充分洗涤细胞即可,能有效减少背景信号的干扰。
Q4:Annexin V/PI双染检测细胞凋亡时对照组出现假阳性/假阴性的原因?
A:对照组出现假阳性通常可能是以下原因:① 细胞密度过高且培养基不足,导致细胞本身状态下降并引起凋亡,应使用状态最佳的细胞进行实验;② 细胞消化过度,导致细胞膜损伤;③ 诱导凋亡的药物可被激发荧光,或细胞本身带有其他荧光标记,干扰实验结果,应注意避开相近激发/发射波长荧光的干扰;④ 细胞样本放置过久、药物处理时间过长、补偿调节不当等原因都有可能导致假阳性。此外,还需要注意避免使用含EDTA的胰酶消化液,EDTA会与Ca2+结合进而干扰Annexin V与PS的结合,出现假阴性结果。
Q5:除细胞实验外,JC-1能否检测组织样本的细胞凋亡?另外石蜡切片和冰冻切片可以用JC-1 检测吗?
A:JC-1可以检测组织样本的细胞凋亡,但不能用于检测石蜡切片和冰冻切片,JC-1实验样本必须是活细胞。检测组织样本时需注意先制备成单细胞悬液,且预先优化制备方案,以防止消化过程引起线粒体膜电位变化而导致假阳性。
Q6:细胞凋亡和坏死都会使DNA断裂,凝胶电泳能否进行区分?
A:细胞凋亡产生的DNA片段是有规律的180-200bp或它的整数倍,琼脂糖凝胶电泳时可见以180-200bp为基数的梯状带纹;而细胞坏死产生的DNA片段大小不一,没有规律,因此不能形成梯状带纹,而是呈弥散状。
Q7:诱导细胞凋亡后,用TUNEL染色发现荧光信号弱甚至没有荧光,或者背景荧光强,一般是什么原因?
A:TUNEL染色荧光信号弱或没有荧光可能是固定液使用不当、操作时样本未注意避光导致,建议使用4%多聚甲醛或福尔马林或戊二醛固定液进行固定,检测前需注意避光。如果是使用紫外线诱导细胞凋亡,DNA不发生断裂,TUNEL染色则不适用。另外,背景荧光强可能与染色时间过长、染色后洗涤不充分、曝光时间过长有关,需调整实验条件即可。
以上便是本期干货的主要内容,本期主要整理总结了检测细胞增殖和细胞凋亡较为常见的指标、实验方法及实验常见问题的解析,希望能够帮助大家了解相关的实验。下期将继续为大家介绍细胞迁移、侵袭和克隆形成实验,感兴趣的小伙伴欢迎持续关注!
参考文献
[1] Phelan MC, Lawler G. Cell counting. Curr Protoc Cytom. 2001;Appendix 3.
[2] Zhang M, Ali G, Komatsu S, Zhao R, Ji HL. Prkg2 regulates alveolar type 2-mediated re-alveolarization. Stem Cell Res Ther. 2022 Mar 21;13(1):111.
[3] Zhou X, Yang Y, Ma P, Wang N, Yang D, Tu Q, Sun B, Xiang T, Zhao X, Hou Z, Fang X. TRIM44 is indispensable for glioma cell proliferation and cell cycle progression through AKT/p21/p27 signaling pathway. J Neurooncol. 2019 Nov;145(2):211-222.
[4] Li Y, Shi J, Qi S, et al. ,. J Exp Clin Cancer Res. 2018;37(1):196.
[5] Shu JC, He YJ, Lv X, Zhao JR, Zhao J, Shen Y, Ye GR, Wang LX. Effect of curcumin on the proliferation and apoptosis of hepatic stellate cells. Braz J Med Biol Res. 2009 Dec;42(12):1173-8.
[6] Zhuang X, Ma J, Xu G, Sun Z. SHP-1 knockdown suppresses mitochondrial biogenesis and aggravates mitochondria-dependent apoptosis induced by all trans retinal through the STING/AMPK pathways. Mol Med. 2022 Oct 22;28(1):125.
[7] Jiang F, Zhou JY, Zhang D, Liu MH, Chen YG. Artesunate induces apoptosis and autophagy in HCT116 colon cancer cells, and autophagy inhibition enhances the artesunate‑induced apoptosis. Int J Mol Med. 2018 Sep;42(3):1295-1304.

查看更多

查看更多

查看更多

联系我们

返回顶部