查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
荧光素酶作为一种理想的报告基因,被广泛应用于转录因子结合位点与启动子活性分析、RNA降解、信号转导、药物筛选、动物活体成像等领域。前两期为大家介绍了荧光素酶的发展和原理以及在miRNA与靶基因结合方面的应用。本期就来详细聊聊双荧光素酶在转录因子与启动子互作验证方面的应用。

真核生物基因表达是一个十分复杂而有序的过程,是众多的反式因子和顺式作用元件之间相互作用的结果。基因的表达在各个层次上都受到精密的调控(包括染色体结构、转录、转录后、翻译和翻译后加工等水平的调控)。转录水平的调控发生在基因表达的初期阶段,是很多基因表达调控的主要方式之一,该过程是指一类称为转录因子的蛋白质特异地结合到靶基因调控区的顺式作用元件上,或调节基因表达的强度,或控制靶基因的时空特异性表达,或应答外界刺激和环境胁迫,最终呈现生物体不同的表征,对生命的正常发育和进化至关重要。
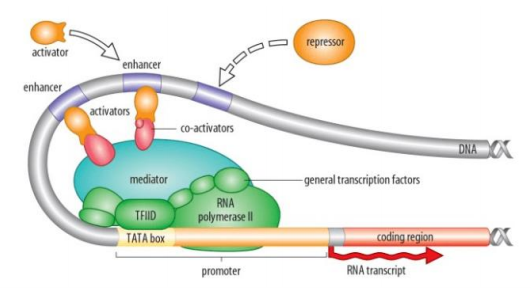
图1. 基因转录机制示意图
作为基因表达调控的开关,启动子是一段控制基因表达的DNA序列,由许多元件组成,能够与转录因子结合并在调控基因表达中起着关键作用。最重要的元件是TATA盒(一段6-8碱基序列),它是转录因子结合的关键信号点。此外,还有CAAT盒、GC盒和增强子等元件,它们也具有重要的调控功能。这些元件的排列组合和序列多样性导致基因启动子在不同类型细胞中具有不同的调控特征。
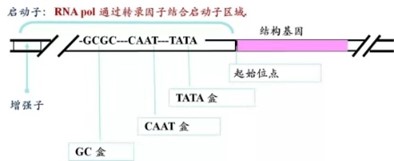
图2. 启动子关键元件
了解启动子、增强子及转录因子等转录调控元件对目标基因表达的影响在研究基因功能、信号通路相关调控网络、调控机制等方面都有着非凡意义,而双荧光素酶在这方面的应用已经十分成熟。下面为大家详解一下利用双荧光素酶报告系统进行转录调控元件活性及结合位点预测等实验设计思路与细节。
在线网站UCSC(http://www.genome.ucsc.edu/)或NCBI(https://www.ncbi.nlm.nih.gov/)均可获取指定基因的启动子序列;结合位点可通过在线网站JASPAR (https://jaspar.genereg.net/)进行预测。详细方法可关注“小恒学术”视频号,观看往期相关视频。常用增强子查询数据库:EnhancerAtlas(http://www.enhanceratlas.org/)、dbSUPER(https://asntech.org/dbsuper/)等。
汉恒出品用于启动子活性及与转录因子结合验证的双荧光素酶报告系统:pGL3-Basic,将待分析启动子元件序列构建到F-Luciferase上游;pcDNA3.1,用于过表达待测转录因子。用于增强子/抑制子研究的双荧光素酶报告系统包括:pGL3-Promoter,将待分析增强子/抑制子序列构建到启动子上游。两个系统均需要共转pRL-TK,用于表达RLuc的内参质粒。
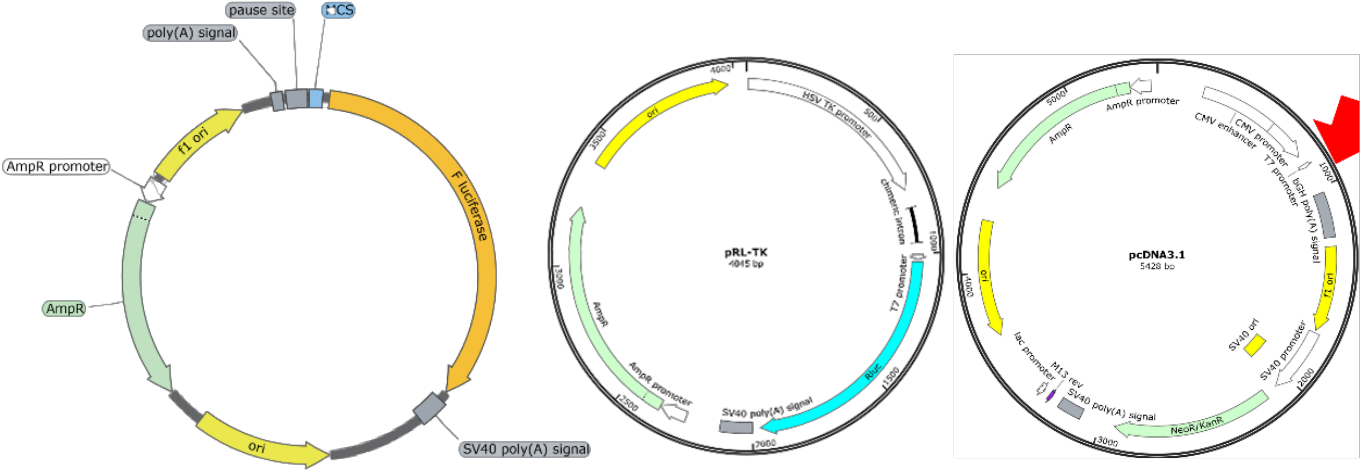
图3. 启动子和转录因子互作双荧光素酶质粒系统
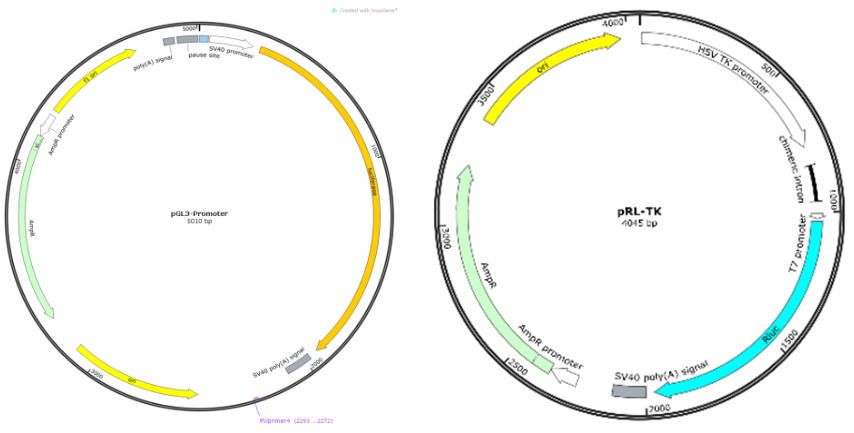
图4. 增强子/抑制子双荧光素酶质粒系统
利用荧光素酶与底物结合发生化学发光反应的特性,把待研究的基因转录调控元件克隆在萤火虫荧光素酶基因的上/下游,构建成荧光素酶报告质粒,然后转染细胞,经适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶活性高低判断刺激前后或不同刺激对感兴趣的调控元件的影响。同时可转染表达R-Luciferase的内参载体pRL-TK质粒以校正不同样品之间的转染效率。

图5. 双荧光素酶系统反应过程
(1)潜在启动子/启动子核心区活性检测
方法:截断式检测,逐步缺失远端序列(因为核心启动子位于靠近TSS端,缺失该处会丧失基本转录活性);适用于确定启动子核心区域或转录因子与启动子预测结合位点较多且评分相近,需要进一步缩小范围的情况。(携带目的启动子的报告载体promoter、不携带目的启动子的报告载体promoter-空载),一般选取目的基因上游总长为2000bp碱基作为目标基因的启动子序列。

图6. 启动子截断示意图
表1. 启动子活性验证双荧光素酶实验分组

1/2组去背景值后通过荧光素酶活性对比可验证待测启动子活性;2/3/4/5去背景值后可通过荧光素酶活性验证待测启动子核心区域。
(2)潜在增强子/抑制子等调控子活性检测
将增强子/抑制子的调控元件构建至pGL3-Promoter报告载体(携带目的基因启动子或广谱启动子启动报告基因),并检测双荧光素酶活性。(增强子Enhancer举例)
表2. 增强子活性验证双荧光素酶实验分组
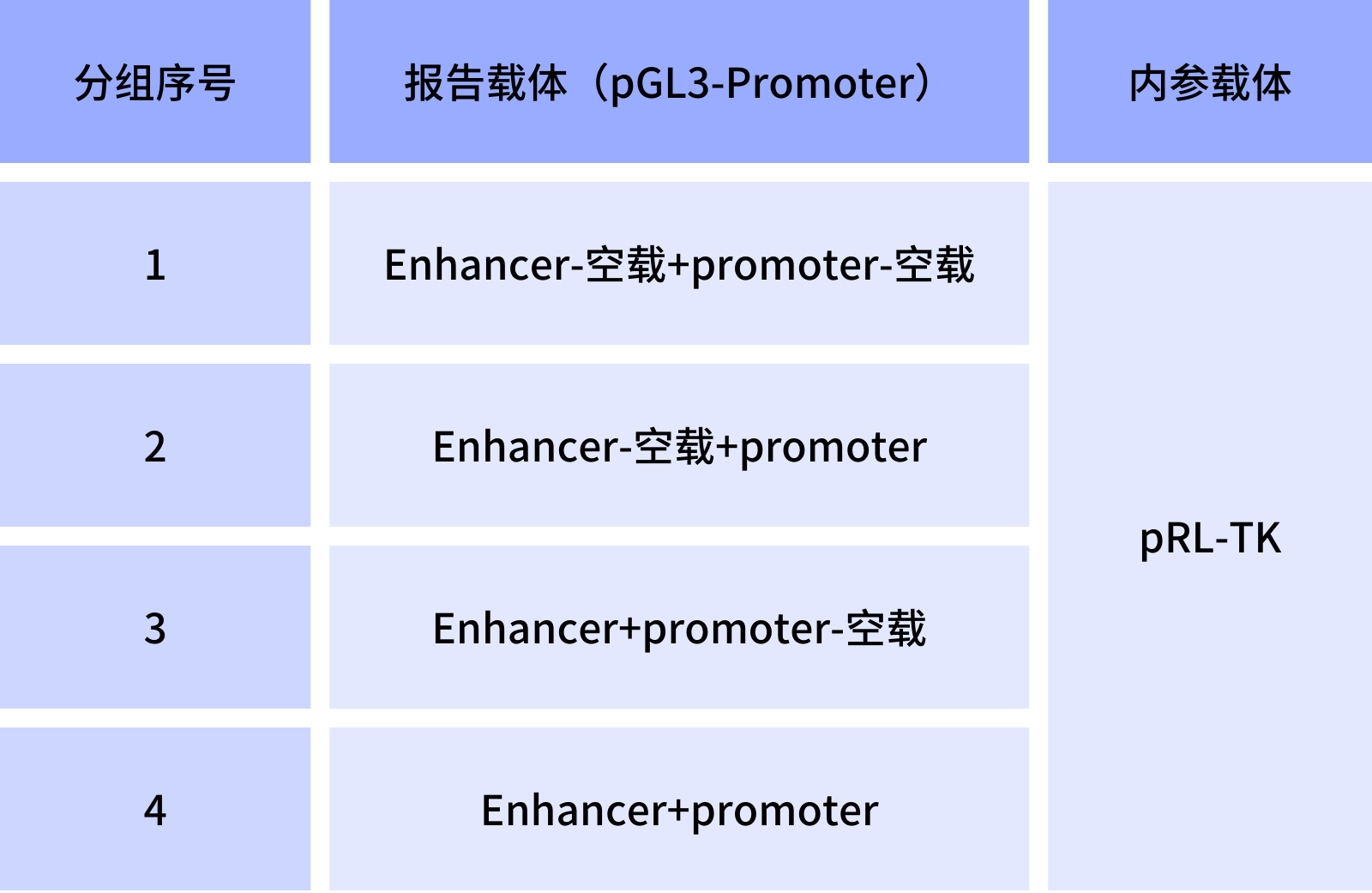
1/2组荧光素酶活性对比表示目的启动子的启动活性;1/3组荧光素酶活性对比表示增强子是否具备启动转录活性;2/4组荧光素酶活性对比表示增强子对下游基因启动转录增强的效果。
(3)启动子和转录因子互作验证
转录因子结合至启动子区域,并改变其启动子功能的强弱,便可引起下游报告基因Fluc转录水平发生变化,进而影响其蛋白翻译,最终底物与荧光素酶反应发生变化,荧光强弱发生改变,最终达成互作功能验证。
①验证转录因子与启动子是否有互作(转录因子过表达载体TF、过表达空载TF-空载)
表3. 启动子和转录因子结合验证双荧光素酶实验分组

②在四组的基础上加上各个待验证结合位点突变启动子载体,以验证转录因子与启动子的具体结合位点(结合位点1突变启动子promoter-mut1、结合位点2突变启动子promoter-mut2、结合位点3突变启动子promoter-mut3,多一个待验证结合位点,则加一组对应启动子突变体+TF和启动子突变体+TF-空载)
表4. 启动子和转录因子结合位点验证双荧光素酶实验分组
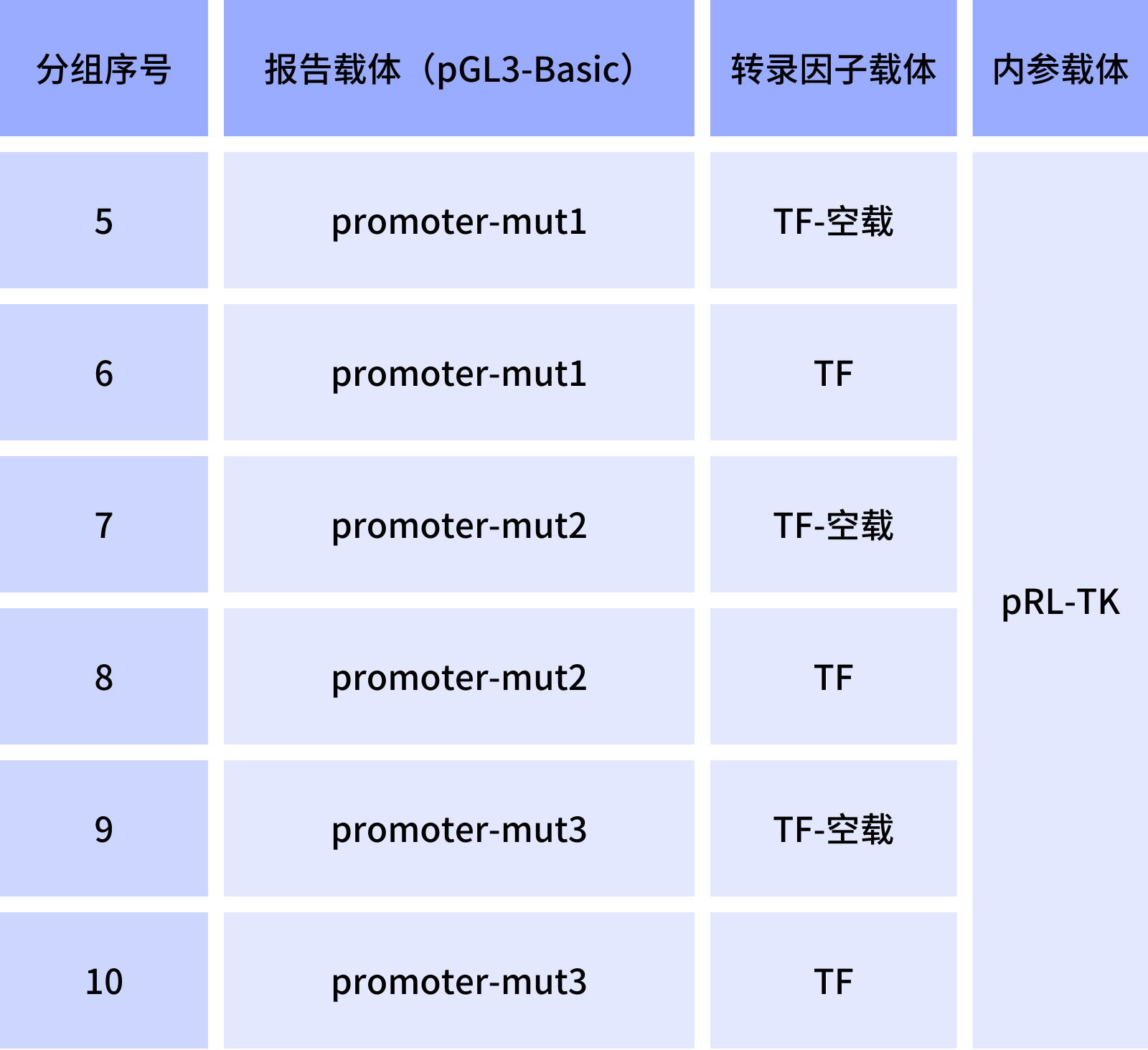
各组设置的意义:实验组1,空载对照组;实验组2,转录因子在无启动子的情况下对Fluc表达的影响;实验组3,检测在无转录因子的作用下,启动子对Fluc基因的转录作用强度;实验组4,检测在待验转录因子的作用下,启动子的转录活性是否会发生改变,用以判断待验的转录因子与启动子是否存在互作关系;实验组6-10:确定具体结合位点。
安徽医科大学李维祖教授在研究颅内动脉瘤时发现NOX4在TNF-α诱导的A7R5细胞中被激活,抑制TRPC6-NFATC1信号通路可显著下调NOX4的表达。为验证NFATC1与 NOX4的结合机制,作者通过人转录因子数据库(HumanTFDB)预测到NFATC1在人NOX4启动子区域可能结合的3个位点。利用pGL3-basic构建了这3个可能结合位点(TFBSs)及相应位点突变的报告载体。结果显示NFATC1可以直接结合NOX4启动子,参与NOX4转录,并确定了NFATC1可以结合到NOX4启动子的TFBS2和TFBS3上,调控NOX4的转录。这些发现为了解颅内动脉瘤的发病机制和延迟颅内动脉瘤的必要策略提供了依据。
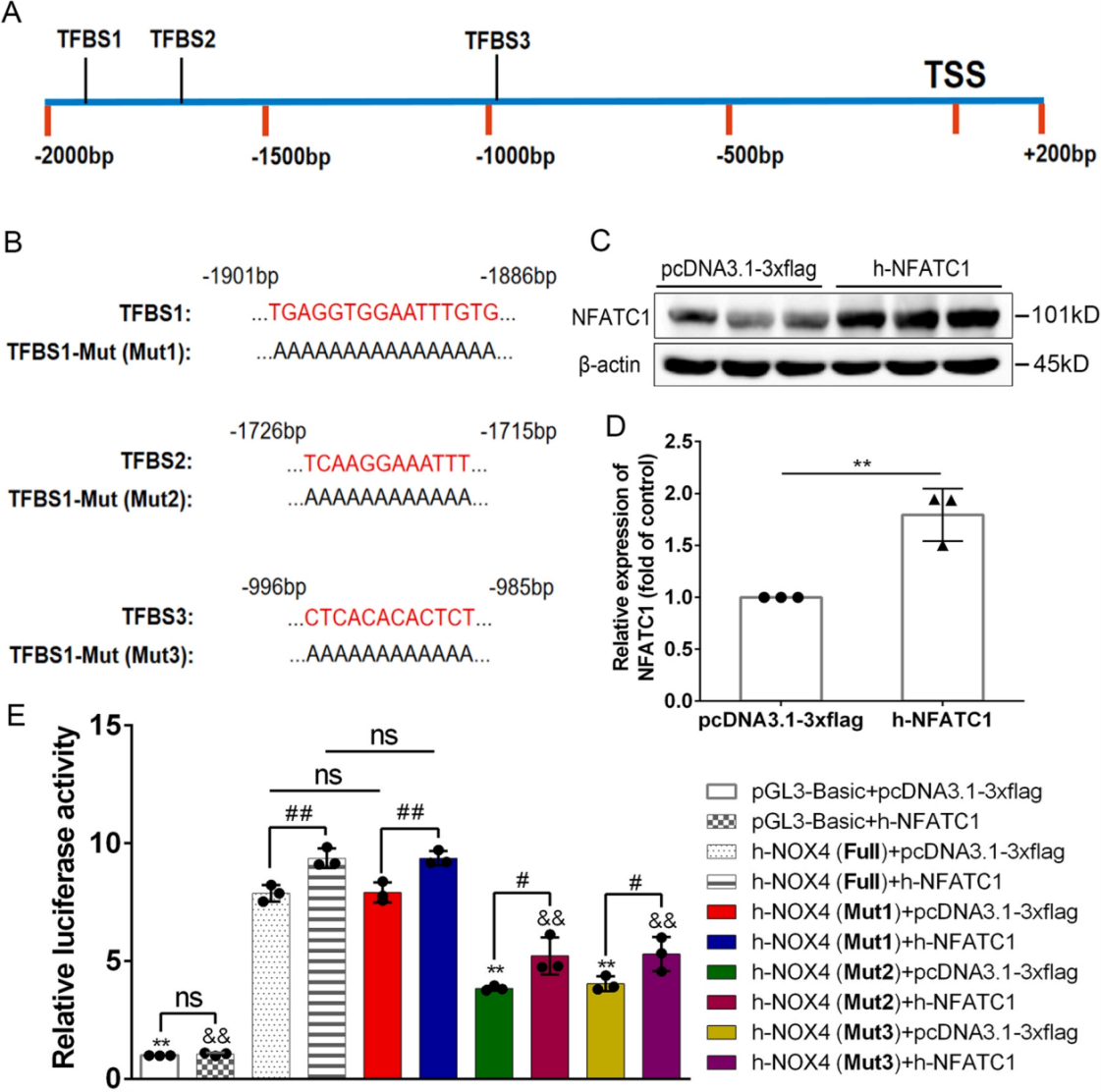
图7. NFATC1与 NOX4启动子的双荧光素酶验证
天津环湖医院李庆国发现在胶质瘤中KB-1460A1.5表现为低表达情况,为了解析这一机制,作者对KB-1460A1.5上游区域进行了分析。首先通过PROMO网站筛选了可能与KB-1460A1.5结合的转录因子,并通过这些因子在胶质瘤中的表达与KB-1460A1.5的相关性分析发现YY1极有可能参与调控KB-1460A1.5的表达。通过构建YY1过表达载体及KB-1460A1.5启动的pGL3载体进行双荧光素酶报告基因检测验证。结果显示,YY1可能与KB-1460A1.5启动子结合,且YY1降低了KB-1460A1.5启动子的荧光素酶活性,即YY1可能以负调控的方式调控KB-1460A1.5的转录表达。作者进而提出了KB-1460A1.5在胶质瘤中的作用机制,KB-1460A1.5可能是胶质瘤的治疗靶点。
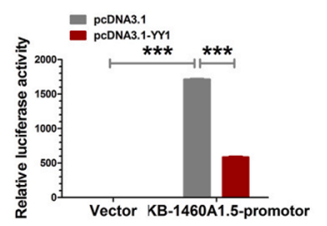
图8. YY1与KB-1460A1.5启动子双荧光素酶验证
本期干货内容主要为大家介绍了双荧光素酶报告系统在转录因子与启动子互作、启动子活性,增强子/抑制子活性的应用,包括原理及应用思路,并附上了两篇案例文献,希望对正在做这方面实验的小伙伴有所帮助。下期我们将介绍双荧光素酶报告系统的拓展应用,感兴趣的小伙伴可以持续关注留意一下哦~~~
参考文献
[1] Sun ZH, Liu F, Kong LL, Ji PM, Huang L, Zhou HM, Sun R, Luo J, Li WZ. Interruption of TRPC6-NFATC1 signaling inhibits NADPH oxidase 4 and VSMCs phenotypic switch in intracranial aneurysm. Biomed Pharmacother. 2023 May;161:114480.
[2] Xu L, Wu Q, Yan H, Shu C, Fan W, Tong X, Li Q. Long noncoding RNA KB-1460A1.5 inhibits glioma tumorigenesis via miR-130a-3p/TSC1/mTOR/YY1 feedback loop. Cancer Lett. 2022 Jan 28;525:33-45.

查看更多

查看更多

查看更多

联系我们

返回顶部