查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一个主题中,我们从管形成机制,以及血管形成实验应用、实验流程、结果解读、常见问题几个方面详细介绍了血管形成实验,本期我们继续为大家带来细胞粘附实验的指南和常见问题解析。

一、细胞粘附
细胞粘附(Cell Adhesion)指细胞通过直接或间接作用,与相邻细胞发生接触和相互作用,其作用方式包括通过细胞表面接触的直接作用和通过细胞外基质的间接作用。机体大部分细胞(如上皮细胞)粘附固定在某处发挥功能,而另一部分细胞(如白细胞)则需要依赖细胞粘附能力的变化进行活跃运动[1]。细胞粘附参与调节细胞分化、细胞周期、细胞迁移和细胞存活的刺激信号,其变化可能是多种疾病的重要因素,包括关节炎、骨质疏松症和动脉粥样硬化等[2,3]。此外,细胞粘附性的改变在肿瘤转移过程中也发挥着重要作用,这使得恶性肿瘤具有从原发瘤分离及在体内扩散的能力。
细胞通过称为细胞粘附分子(CAM)的细胞表面蛋白相互粘附或粘附于细胞外基质(ECM)上,细胞粘附分子是一类膜表面糖蛋白,以“配体-受体”特异性结合的方式发挥作用,可介导细胞与细胞间、细胞与ECM间的粘附性,参与细胞识别、细胞活化、信号转导等多种活动,在胚胎发育和分化、炎症反应、免疫应答、凝血和血栓形成、创伤修复、肿瘤浸润与转移等一系列生理和病理过程中发挥着重要的生物学作用。其中,ECM按照组成可分为结构蛋白(如胶原、弹性蛋白)、粘着蛋白(如纤粘连蛋白、层粘连蛋白)、氨基聚糖与蛋白聚糖[4]。组织中的每个细胞表达特定种类(和表达量)的、由多种不同的粘附系统组成细胞表面粘附分子,使其能够以自身特有的方式与其他细胞及细胞外基质结合。在研究CAMs、ECM时通常需要进行细胞粘附实验,以确定相关功能与机制。
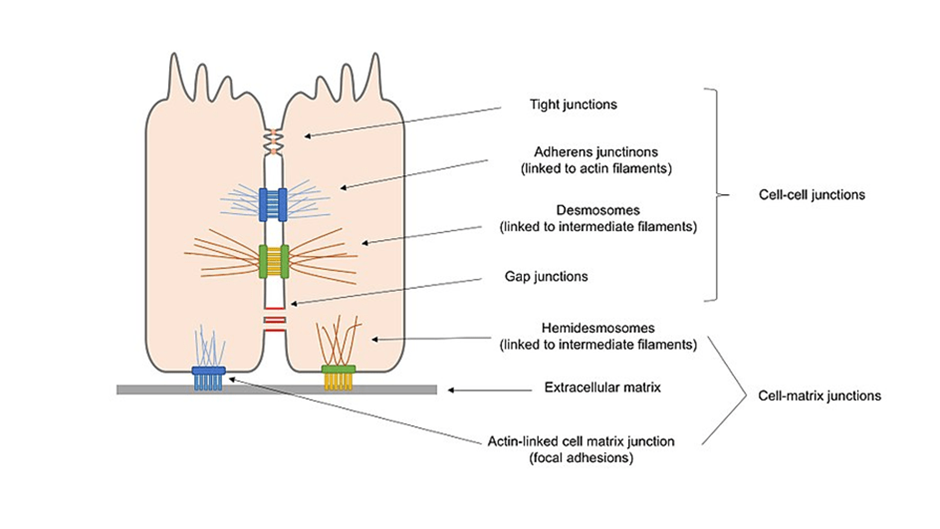
图1 上皮细胞中存在的不同类型的细胞连接概述图(维基百科)
二、细胞粘附实验
细胞粘附实验(cell-adhesion assay)可用于检测不同处理条件(生长因子、药物、基因操控)对细胞粘附能力的影响。基于细胞处理状态的不同可将粘附实验分为静态细胞粘附实验和流动细胞粘附实验,静态细胞粘附实验广泛用于评估多种类型的细胞(例如,上皮细胞和成纤维细胞)与细胞外基质的粘附;流动细胞粘附实验适用于分析血细胞相互作用,包括白细胞与内皮细胞的粘附、血细胞之间的相互作用以及与细胞外基质蛋白的粘附[5]。更为常见的分类则是基于粘附类型的两个类别——即细胞与细胞粘附和细胞与基质粘附[6]。
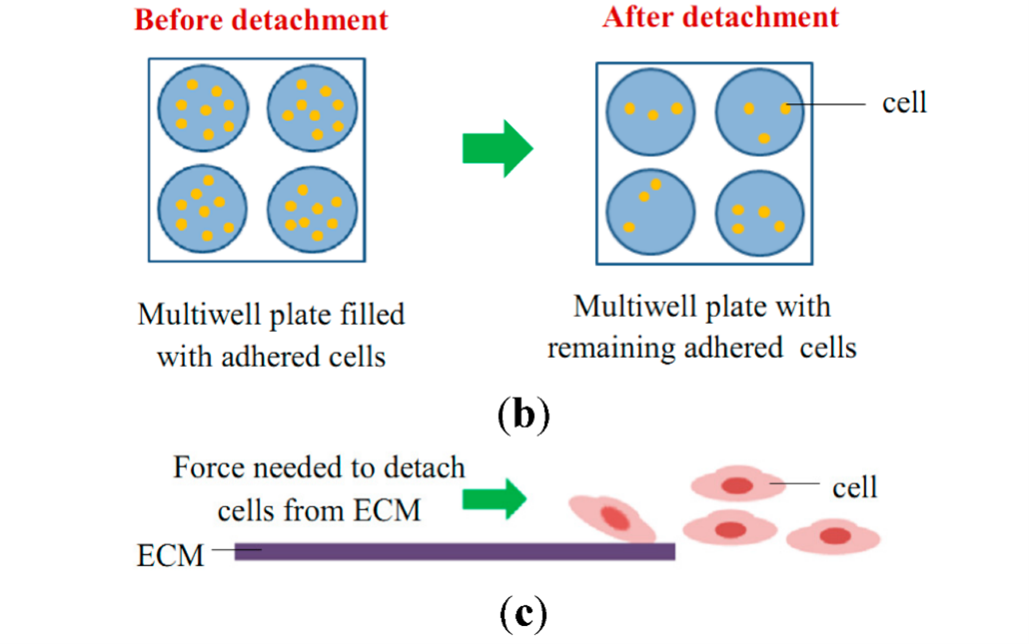
图2 静态细胞粘附实验和流动细胞粘附实验示意图
细胞-细胞粘附实验主要用于评估细胞间的相互作用能力,检测在经过各种药物处理、基因转染、敲除或培养条件改变后,细胞间的粘附程度的生物学变化。典型的基于荧光的细胞-细胞粘附实验将未标记的细胞单层平铺于多孔板中,并与荧光标记的细胞一起孵育,之后通过洗涤来分离粘附和非粘附的细胞群体,细胞粘附程度可以通过将保留的荧光强度与细胞数量相关联来简单确定。
细胞-基质粘附检测主要用于判定细胞在不同处理下,目的细胞与细胞外基质的粘附能力改变情况。通常使用细胞外基质的组分(模拟细胞外基质,如层连蛋白LN和纤连蛋白FN)包被培养板,接种并培养细胞至特定时间后去除未粘附细胞,检测粘附于模拟基质表面的残留活细胞数目变化。
本实验观察方法通常可分为两种,第一类为显微镜观察法,即通过荧光蛋白或活细胞荧光探针标记粘附的阳性细胞数量,使用显微镜来观察细胞的粘附能力变化。另一类则为比色法,通过活细胞染料(如钙黄绿素-AM)、CCK-8或MTT等试剂盒对细胞进行染色后,使用酶标仪(荧光或非荧光)在相应波长下检测吸光度。
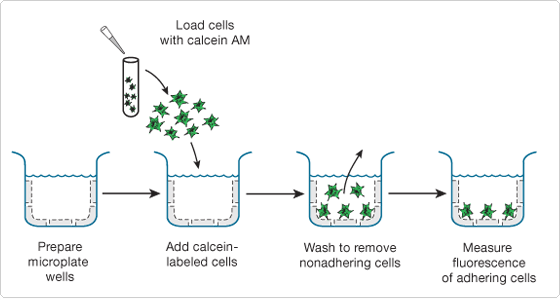
图3 钙黄绿素-AM粘附实验流程(ThermoFisher)
三、实验步骤
我们以常见的细胞与基质的粘附实验为例,介绍实验步骤[7]。
3.1 实验准备
(1)包被培养板:使用10 µg/250 μL的人工基底膜胶预铺96孔板(也可根据实验需求选择其他合适的培养板),50 µL/孔,4℃过夜后,PBS洗3遍。
(2)BSA封闭:用1% BSA于37℃封闭1 h,PBS润洗3遍,以封闭未被包被的区域。
3.2 细胞铺板和培养
(1)细胞重悬:使用胰酶消化细胞,用含血清的培养基终止消化,再用无血清培养基洗涤细胞并重悬。对于一些使用活细胞染料的粘附实验,根据试剂说明书在该步骤或其他步骤中加入相应染料。
(2)细胞铺板:取目的细胞以适当接种密度*(如293T的常用密度为1-4×10^4个/孔)接种于预铺基质胶的96孔板中,每组设3个复孔。
*可进行预实验,根据镜下观察细胞状态、密度等来确定最适密度。
(3)细胞培养:37℃孵育至设定检测时间点,若进行时间梯度检测,则可分别培养20 min、40 min、1 h(粘附的最佳孵育时间可能根据细胞类型和其他实验参数而异)后,使用PBS轻轻润洗3次,去除未粘附的细胞。
3.2 结果观察
(1)以结晶紫染色检测为例:结晶紫常用于组织或细胞染色,可与细胞或组织中的DNA、RNA、蛋白质等成分结合,其中,与DNA的结合是结晶紫染色的主要机理之一。结晶紫溶解后被细胞摄入,阳离子与DNA磷酸基团发生静电作用,从而使得DNA分子呈现出紫色。进行结果观察时,首先使用4%多聚甲醛室温固定15min,PBS洗3遍;使用0.1%的结晶紫染色,室温染色0.5 h,PBS洗3 遍,加入50 μL/孔0.5% Triton X-100(用PBS稀释),室温下将粘附的细胞静置过夜,或在室温下使用2% SDS处理30 min。在分光光度计上读取550 nm (SDS)或595 nm (Triton X-100)的吸光度,用以表示粘附细胞的多少。
(2)以钙黄绿素-AM荧光检测为例:钙黄绿素 AM是一种可对活细胞进行荧光标记的染料,经过活细胞中的酯酶水解乙酰氧甲酯之后,非荧光的钙黄绿素 AM转化为钙黄绿素,发出强绿色荧光。进行结果观察时,首先使用PBS或培养基重复洗涤,每孔加入200 μl PBS,使用荧光显微镜或带有荧光素滤光片组的酶标仪测量荧光(钙黄素的最大吸光度为494 nm,最大发射光度为517 nm)。通过贴壁细胞荧光值(或数量)/添加到孔板上的细胞总荧光(或数量)的比值来确定粘附细胞的多少[8]。
四、实例结果解读
如图4所示,作者将乳腺癌MDA-MB 231(BC,灰色)、纤维肉瘤HT-1080(FS,黑色)和胚胎HEK-293肾脏(EK,白色)细胞在48孔板上以4×10^5个细胞/mL的密度附着于不同的ECM蛋白包被或未包被(对照,No coating)上30分钟,进行结晶紫染色后,使用酶标仪检测吸光度。根据颜色深浅或吸光度数值可判断Vitronectin对细胞的粘附抑制效果最弱,而Laminin 1显示出最强的粘附抑制能力[9]。
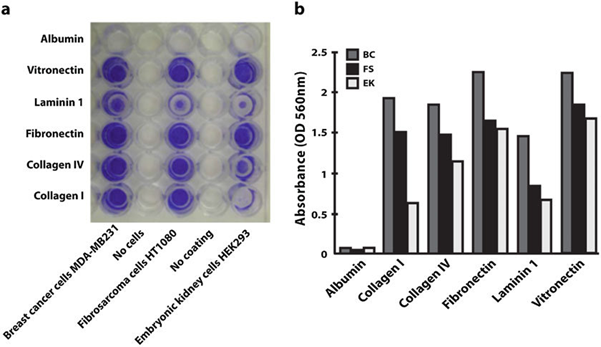
图4 通过结晶紫检测不同的分离蛇毒整合素拮抗蛋白对细胞-基质粘附能力的影响
图5所示,作者利用目标蛋白在293T细胞表面的高表达的特性,研究特定细胞类型与目标蛋白质之间的相互作用。将mSiglec1和对照质粒转染至293T工具细胞并培养为单层细胞后,加入表达GFP的B16F10细胞共培养,使用Alexa Fluor 647偶联的mSiglec1抗体染色标记293T,荧光显微镜或共聚焦显微镜采集图像并进行B16F10细胞计数,以测定mSiglec1对细胞-细胞粘附能力的作用。结果显示相对于对照组,过表达mSiglec1组的B16F10细胞数量显著增加[10]。
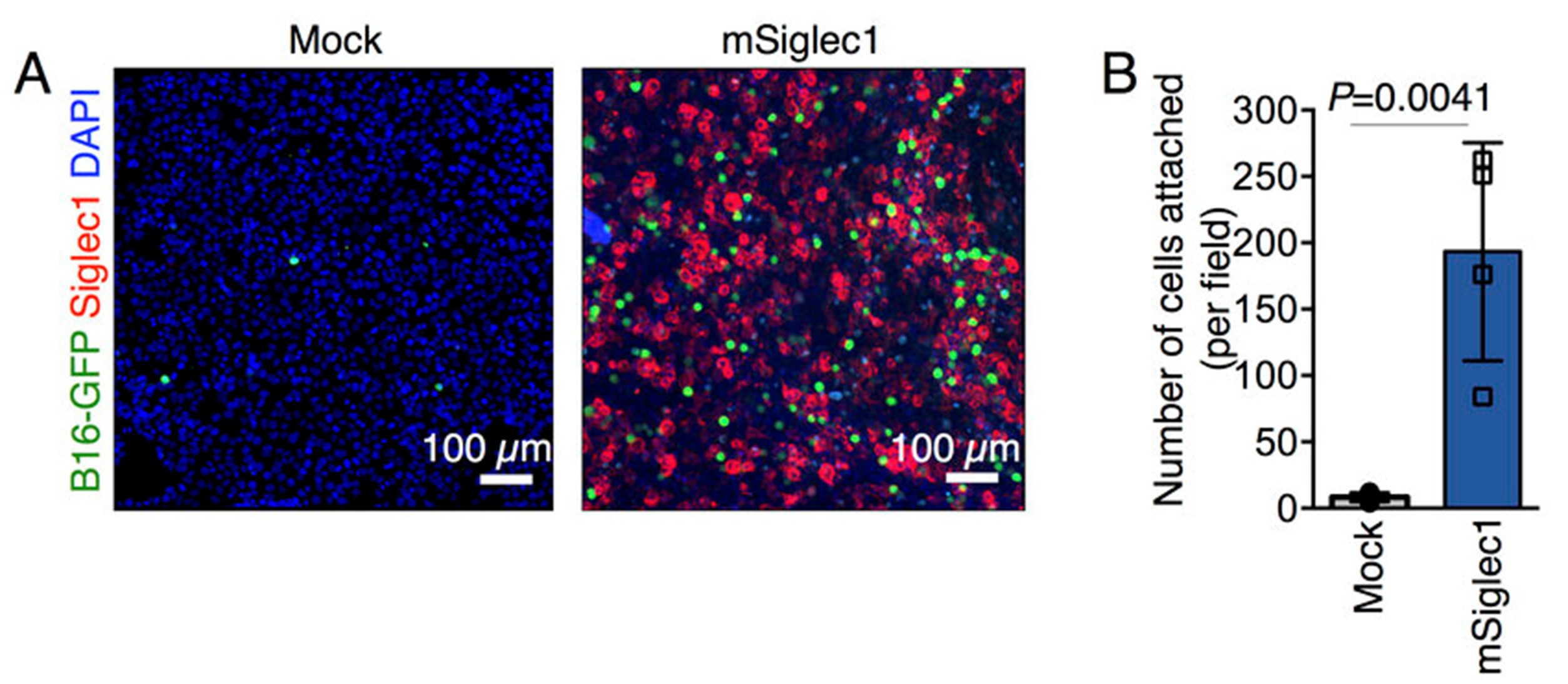
图5 通过荧光蛋白检测mSiglec-1的表达对细胞粘附能力的影响
图6所示,作者将人腹膜间皮细胞(HPMCs)培养为单层细胞并使用TGF-β1(5,10, 20 ng/mL)处理72 h,将癌细胞HGC-27和HSC-39进行RGD处理用钙黄绿素-AM染色30 min后加入至HPMCs孵育3 h,记录485 nm激发和535 nm发射波长下记录每个孔中的总荧光。结果显示与对照组相比,TGF-β1可以剂量依赖性方式促进胃癌细胞HGC-27(B)和HSC-39(C)对HPMCs的粘附,RGD减少了在TGF-β1刺激下粘附在间皮细胞上的癌细胞总荧光强度。相对于未处理组(D, a),使用TGF-β1处理HPMCs(D, b)显著增加粘附细胞数,而对HGC-27细胞进行RGD 预处理再加入至TGF-β1处理HPMCs(D, c)将显著减少细胞粘附[11]。
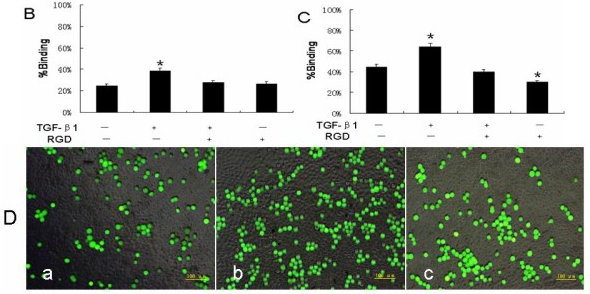
图6 通过钙黄绿素-AM检测TGF-β1和RGD对胃癌-间皮细胞粘附的影响
五、常见问题
1. 如何准备细胞粘附实验的基底?
细胞粘附实验基底可以是培养板、盖玻片、生物材料等,一般来说需要对基底进行包被预处理,材料包括Matrigel基质胶、fibronectin(纤连蛋白)或collagen(胶原)等等,以增强细胞的粘附能力。处理后的基底需在使用前进行灭菌处理。
2. 阳性对照组细胞不粘附如何处理?
我们可以从一下几个方面查找原因,并进行相应优化:①基底处理:确保基底表面处理均匀,选择合适的涂层材料。②细胞状态:应使用生长状态良好的细胞,避免使用老化或受损的细胞。③培养条件:确保培养基和培养条件适合细胞生长,操作需细致谨慎,以减少对细胞的损伤。离心时应使用尽可能低的离心力,同时避免损害细胞。在重新悬浮细胞时,动作要温和,切勿用力过猛或反复剧烈吹打
3. 细胞粘附实验中如何设置对照组?
在初次实验时,需设置阳性对照、阴性对照和空白对照组。阴性对照为无包被的基底或不添加细胞的基底;阳性对照为已知具有高粘附能力的细胞系或处理条件;空白对照为仅添加培养基而不进行细胞铺板的组别,用于评估背景干扰。
4. 如何确定细胞粘附实验的最佳时间点?
实验时长与细胞种类、细胞状态、粘附因子表达情况和细胞外基质成分相关。可通过预实验确定细胞粘附的动态过程,一般会设置多个时间点(如0.5、1、2、4 h等),以观察细胞粘附随时间的变化。
5. 如何排除细胞死亡对粘附实验结果的影响?
死亡细胞可能会错误地影响粘附效率的评估,我们应选择状态正常的细胞,在实验前通过离心和重悬步骤,去除培养中的死细胞,也可使用细胞过滤器(如40 μm滤网)来进一步去除较大的细胞团块和碎片。在实验中,可通过活细胞染料染色来排除死亡细胞(如Calcein-AM、SYTOX Green),并在实验中设置适当的对照组来确保结果的准确性。
相信大家对细胞粘附实验有了一个初步了解,在基础研究中我们通常会进行基因表达调控来探究某一基因对细胞的相应表型,例如增殖、凋亡、迁移、粘附等表型,掌握基因表达调控方式和细胞表型检测实验对于实验成功至关重要。汉恒生物提供多种基因表达载体和细胞实验服务,欢迎各位老师同学咨询。
六、参考文献
[1] Chaffey, Nigel. "Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K. and Walter, P. Molecular biology of the cell. 4th edn." (2003): 401-401.
[2] Kashef, Jubin, and Clemens M. Franz. "Quantitative methods for analyzing cell–cell adhesion in development." Developmental biology 401.1 (2015): 165-174.
[3] Qiu, Shanhu, et al. "Association between circulating cell adhesion molecules and risk of type 2 diabetes: A meta-analysis." Atherosclerosis 287 (2019): 147-154.
[4] Honig, Barry, and Lawrence Shapiro. "Adhesion protein structure, molecular affinities, and principles of cell-cell recognition." Cell 181.3 (2020): 520-535.
[5] Ahmad Khalili, Amelia, and Mohd Ridzuan Ahmad. "A review of cell adhesion studies for biomedical and biological applications." International journal of molecular sciences 16.8 (2015): 18149-18184.
[6] Löster, K., and R. Horstkorte. "Enzymatic quantification of cell–matrix and cell–cell adhesion." Micron 31.1 (2000): 41-53.
[7] Lazarovici, Philip, Cezary Marcinkiewicz, and Peter I. Lelkes. "Cell-based adhesion assays for isolation of snake venom’s integrin antagonists." Snake and Spider Toxins: Methods and Protocols (2020): 205-223.
[8] Liu, Peixi, et al. "Inflammatory smooth muscle cells induce endothelial cell alterations to influence cerebral aneurysm progression via regulation of integrin and VEGF expression." Cell Transplantation 28.6 (2019): 713-722.
[9] Lazarovici, Philip, Cezary Marcinkiewicz, and Peter I. Lelkes. "Cell-based adhesion assays for isolation of snake venom’s integrin antagonists." Snake and Spider Toxins: Methods and Protocols (2020): 205-223.
[10] Singh, Rohit, and Beom K. Choi. "A transient transfection-based cell adhesion assay with 293T cells." Bio-protocol 11.1 (2021): e3878-e3878.
[11] Lv, Zhi-Dong, et al. "Induction of gastric cancer cell adhesion through transforming growth factor-beta1-mediated peritoneal fibrosis." Journal of Experimental & Clinical Cancer Research 29 (2010): 1-10.

查看更多

查看更多

查看更多

联系我们

返回顶部