查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

在前面的文章中我们介绍了与细胞运动有关的细胞迁移和侵袭实验,本期我们将目光聚焦于细胞的克隆形成方面,主要介绍细胞的克隆形成实验。克隆形成实验(Colony Formation Assay),也称为集落形成实验,是一种体外细胞生存能力的测定方法,关键在于检测单个细胞能否生长成包含至少50个细胞的克隆,以测试细胞群中每一个细胞无限分裂的潜能。此方法最初由Puck和Marcus于1956年提出,描述了一种评估单个哺乳动物细胞在培养皿中形成克隆或集落能力的细胞培养技术。克隆形成实验不仅是确定细胞对电离辐射生殖死亡的标准方法,也可用于评估其他细胞毒性剂的有效性。
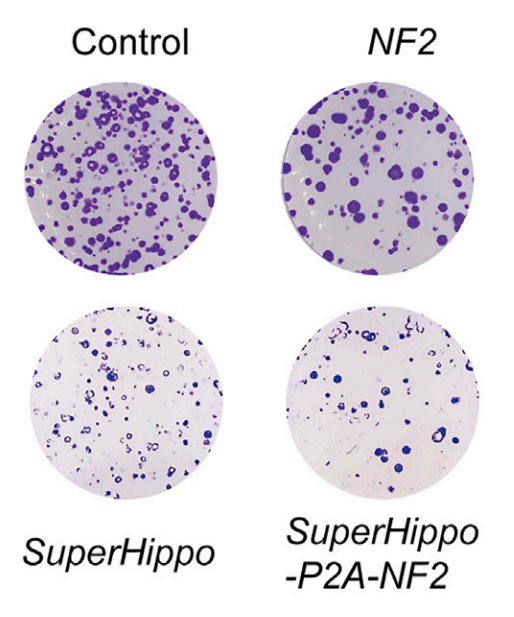
图1.克隆形成实验结果(doi:10.1016/j.xcrm.2024.101763)
一、实验原理
克隆形成实验基于细胞的增殖和分化能力。实验过程中,细胞在处理前或处理后被稀释接种,处理因素可以是基因调控(过表达、敲低、敲除等)、电离辐射或药物等。随后于1-3周内形成集落,集落经固定和染色,利用显微镜或肉眼可见计数克隆数量,以计算克隆形成率。实验关键在于准确的细胞计数和稀释,以确保正确接种数量及准确的计算克隆形成率。
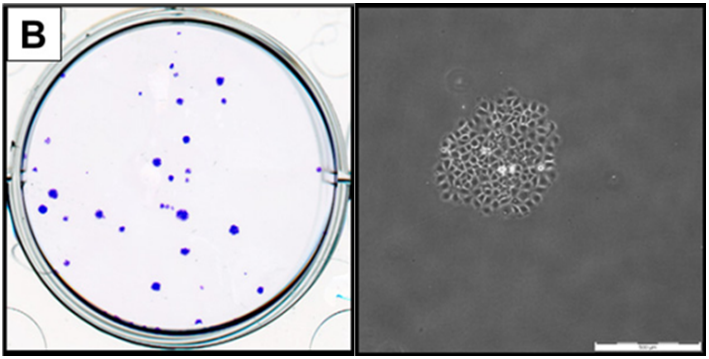
图2.细胞克隆形成图(源于网络)
二、实验目的
1. 评估细胞增殖能力:可测定细胞在一定时间内的增殖速率。
2. 检测细胞克隆形成能力:了解细胞在单细胞水平上的克隆形成能力。
3. 研究细胞遗传特性:可筛选出具有特定遗传特性的细胞克隆。
4. 药物筛选和毒性测试:在药物开发过程中,克隆形成实验可以用来评估药物对细胞增殖和克隆形成的影响。
5. 细胞系建立:克隆形成实验也是筛选和鉴定单克隆细胞的重要手段。
三、克隆平板分类
根据细胞生长方式的不同,克隆形成的培养介质分为两类,即平板克隆形成实验和软琼脂克隆形成实验。
1. 平板克隆形成实验:适用于贴壁生长的细胞,操作相对简单,细胞间可自由接触,利于形成克隆。
2. 软琼脂克隆形成实验:适用于悬浮生长的细胞,将细胞悬液与软琼脂混合,利用软琼脂为培养介质,形成克隆。
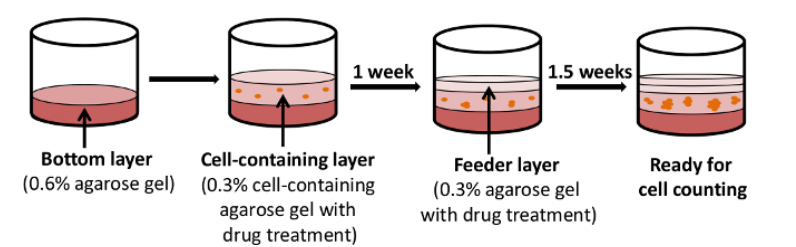
图3. 软琼脂克隆形成制备过程(DOI: 10.3791/52727)
四、实验步骤
1. 平板克隆形成实验[1]
(1)所需材料
基础培养基,胎牛血清,胰蛋白酶,PBS,6孔板(或培养皿),4%多聚甲醛固定液,结晶紫染液,无菌移液枪和枪头、细胞计数板等细胞培养耗材。
(2)操作步骤
① 细胞准备:将细胞或预处理好的细胞用胰蛋白酶正常消化后收集,用完全培养基重悬为单细胞悬液,并计数;
② 细胞接种:将细胞悬液浓度调整为1000个细胞/mL,6孔板中每孔接种1000个细胞(不同细胞适宜接种细胞数不同,依实际情况进行);
③ 附加步骤:根据实验设计进行处理,需在细胞开始增殖前进行。如接种后进行辐射处理或药物处理等。
④ 细胞克隆培养:继续置于细胞培养箱中培养,大约1-3周,期间每隔3天进行换液并观察细胞状态;
⑤ 固定和染色:培养完成后,用PBS洗涤细胞,每孔加入1mL 4%多聚甲醛固定细胞30-60min,再次洗涤后,每孔加入1mL结晶紫染液染色10-20min;
⑥ 计数:在显微镜下计数克隆形成的数量,或对整个6孔板及每个孔进行拍照;
⑦ 数据分析:可运用Image J软件进行细胞图像处理,得到不同分组中的克隆形成数量,即可计算出处理组细胞存活或增殖相比于对照组的变化。或是计算各组的克隆形成率:克隆形成率 =(克隆数/接种细胞数)×100%
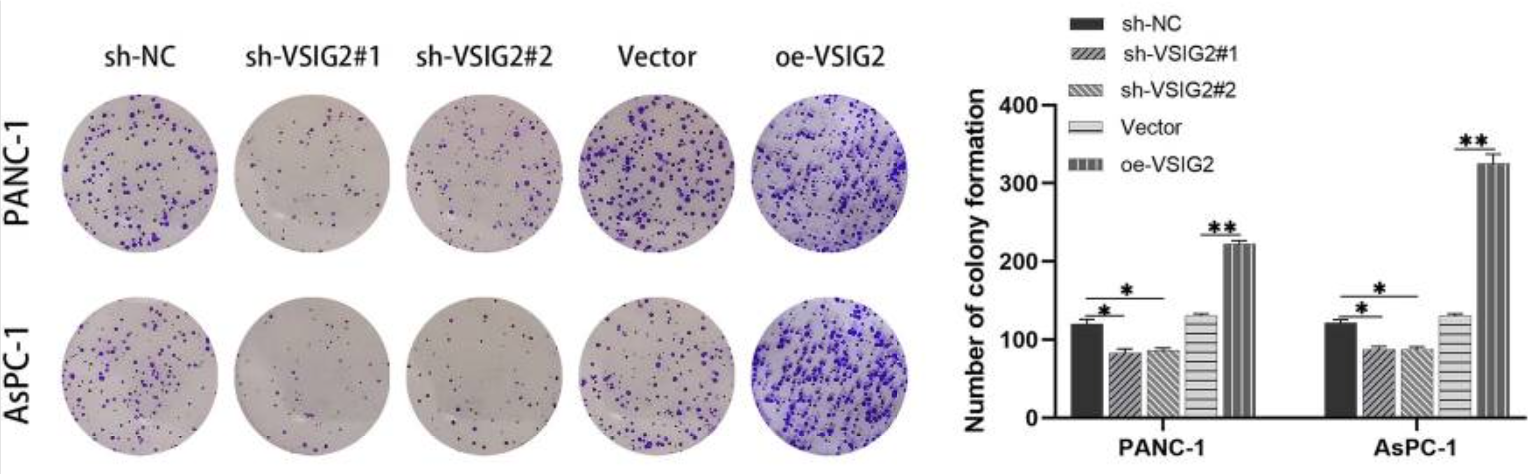
图4. 克隆形成实验结果(DOI: 10.1186/s12964-023-01209-x)
2. 软琼脂克隆形成实验[2]
(1)所需材料
琼脂,恒温水浴锅,NBT染液,基础培养基,胎牛血清,6孔板(或培养皿),无菌移液枪和枪头、细胞计数板等。
(2)操作步骤
① 准备琼脂:制备3%的琼脂,高压灭菌,在42℃恒温水浴锅中维持液态;
② 制备底层琼脂:将3%琼脂用培养基混合稀释成0.6%的琼脂(不包含细胞)后铺于6孔板中,总体积1.5mL,37℃孵育30min使其凝固;
③ 制备上层细胞悬液:按1:1的比例将0.6%的琼脂与2×完全培养基混匀后,加入0.2mL的单细胞悬液,充分混匀,再加入6孔板中作为上层胶,每孔1.5mL,5000个细胞(可根据需要调整)。待凝固后在最上层加入0.3%浓度琼脂的培养基作为饲养层;
④ 细胞克隆培养:继续培养1-3周,每周添加0.3%浓度琼脂的培养基作为饲养层,直到观察到有克隆形成,观察细胞状态及克隆大小;
⑤ 拍照计数:当每个克隆大于50个细胞时,可进行NBT染色,随后拍照计数;
⑥ 数据分析:Image J软件进行图像处理,计算克隆形成率等。
图5.软琼脂克隆形成实验结果(DOI: 10.3791/52727)
五、注意事项
1.细胞培养操作注意事项:
操作过程保持无菌环境,防止污染;保持恒定的培养条件,避免温度、pH或CO2浓度的变化。
2.细胞铺板均匀的重要性:
细胞悬液的均一性和合适的接种细胞密度是实验成功的关键。确保细胞悬液的均一性,避免细胞聚集成团,细胞尽可能在悬液中均匀分布;若铺板不均匀,细胞稀的地方形成的克隆少,而密的地方克隆多,一方面影响统计结果,并且拍出的图片不美观。
3. 细胞密度为多少合适?
控制细胞接种密度,不同细胞的接种密度可能会有差异,过高或过低都会影响结果;若细胞太多,形成克隆数目太多,很难拍到单独的克隆团;而细胞太少,可能无法形成克隆,从而影响对该细胞增殖能力的判断。一般来说,正常增殖速度为1:5-1:10传代,3天长满细胞,可以接种500个细胞,其余增殖缓慢细胞,可以接种800-1000个细胞。
4.细胞接种后培养的时间,如何确定?
通常情况下,单个细胞在体外增殖6代以上所组成的细胞群称为一个阳性克隆,时间约为一周;但具体时间因细胞增殖能力而已异,因此应密切关注细胞生长情况,隔天在显微镜下观察克隆情况,若单个克隆细胞数到达50个左右(肉眼可见)即可固定细胞。
5. 软琼脂克隆形成实验每一层培养基的作用?
软琼脂形成实验中,底层琼脂提供细胞支撑,防止贴壁;上层琼脂促进细胞分散;顶层的培养基作为饲养层可防止琼脂干燥并提供营养,培养基中也可加入药物处理。
6. 软琼脂克隆形成实验中琼脂的浓度如何确定?
7. 琼脂是否需要恒温?
琼脂恒温水浴时要保持在42℃左右,确保琼脂层均匀,避免温度过低凝固,或过高损伤细胞。
8. 软琼脂克隆形成实验细胞生长于两层琼脂胶之间的原因?
如果明显可见细胞生长于两层琼脂胶之间,可能是上层胶浓度过低,导致细胞掉落到下层胶上,这就偏离了软琼脂克隆形成实验的初衷;建议重新摸索合适的上层胶浓度。
9.细胞未形成克隆的原因?
并非每种细胞都可以形成克隆,克隆形成率与细胞本身增殖能力有关。还与接种细胞密度,加入培养液的体积、血清浓度有关。建议可以给细胞多加培养基,如每孔4ml,或者勤换培养基或者琼脂糖凝胶,以供给细胞充足的营养。
10.两种不同的克隆形成实验,具体该怎么选择呢?
可以根据实验对象和目的来选择,平板克隆检测贴壁肿瘤细胞的增殖能力和致瘤性,软琼脂克隆形成实验除了检测贴壁细胞,还能检测悬浮肿瘤细胞和转化细胞系,具有平板克隆不可取代的优势。若只是简单评价贴壁细胞的增殖能力和群体依赖性,则选择平板克隆即可。
综上,本期主要介绍了克隆形成实验,包括实验原理,实验目的、实验分类,实验步骤和注意事项等。平板克隆实验和软琼脂克隆作为测定体外细胞生存能力的两个重要实验,为我们研究细胞功能提供了更多有力的证据,在下一期我们将继续介绍细胞功能实验相关的成管实验,欢迎大家持续关注~
参考文献:
[1] Franken NA, Rodermond HM, Stap J, Haveman J, van Bree C. Clonogenic assay of cells in vitro. Nat Protoc. 2006;1(5):2315-9. doi: 10.1038/nprot.2006.339.
[2] Horibata, S., Vo, T.V., Subramanian, V., Thompson, P.R., Coonrod, S.A. Utilization of the Soft Agar Colony Formation Assay to Identify Inhibitors of Tumorigenicity in Breast Cancer Cells. J. Vis. Exp. (99), e52727, doi:10.3791/52727 (2015).

查看更多

查看更多

查看更多

联系我们

返回顶部