查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
转染,顾名思义,是指将某种物质转移到细胞内。在生物医学研究中,这个“物质”通常指的是DNA或RNA。通过转染,我们可以向细胞引入新的基因,或者沉默/敲低细胞内的某个基因,从而研究该基因对细胞生命活动的影响。

转染的方式有很多种,例如脂质体转染法、磷酸钙转染法、病毒转染、电穿孔、显微注射等。电穿孔与显微注射,是通过物理方式,使用相应设备仪器将质粒DNA或者RNA片段注入细胞;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞。
病毒与质粒不同,质粒转染需要借助外力进入细胞,而病毒转染是主动侵染的过程,所以通常用病毒感染来表达这一过程。
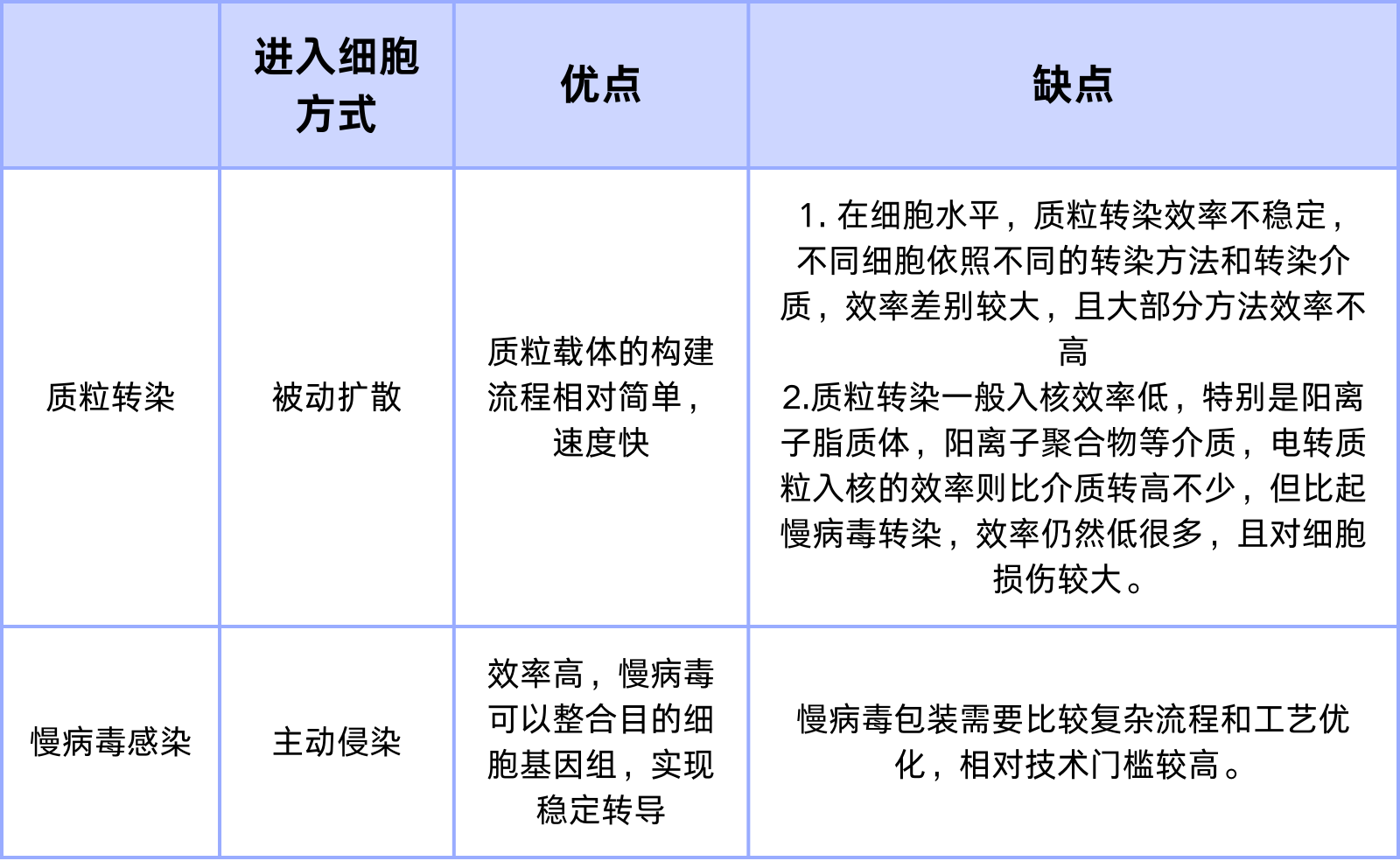
总而言之,无论是质粒转染,还是病毒转染,均是真核细胞主动或被动导入外源DNA片段而获得新的表型的过程。以慢病毒为例,我们可以通过下表来比较两者的区别:
表1:质粒转染与慢病毒感染的比较
质粒转染和病毒转染如何选择?
在选择转染方式时,我们需要考虑的问题有:
·实验的时间和成本
·转染的目的细胞是什么,适合用哪种方式?
·实验所需要的目的基因表达周期,是否需要稳定表达?
·目的基因片段大小(过表达情况下)
质粒的构建成本较低、周期较短,最常见且成本较低的质粒转染方式是使用脂质体转染试剂,但其转染效率有限,对于很多细胞的转染能力较低。
在这种情况下则推荐使用病毒感染的方式。通常慢病毒和腺病毒用于细胞感染,腺相关病毒(AAV)用于动物水平的基因递送。
慢病毒可以整合目的细胞基因组,从而实现稳定转染,虽然质粒也有一定的整合概率,但效率太低一般不考虑用质粒做稳转。腺病毒的感染效率高,适用于一些感染难度较大的细胞,例如悬浮细胞、原代细胞。
但我们也需要考虑到质粒与病毒载体的维持表达时间、载体的容量等因素。质粒瞬转情况下,在细胞内可维持3-7的目的基因表达,腺病毒1周左右,慢病毒则是稳定表达。如果所需要过表达的目的基因片段过长(例如超过4k),那么慢病毒可能难以包装,此时可使用腺病毒或者质粒转染。
最后,通过示意质粒转染和慢病毒包装及感染的流程,更直观地对比这两种方式。
质粒转染流程:
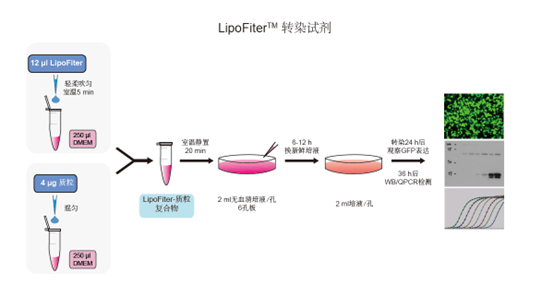
构建好质粒后,就可以使用转染试剂进行细胞转染了,通常是将质粒与转染试剂按照说明书要求的量混合后,加入到细胞中,经过换液培养后,进行荧光观察(如果载体带有荧光标记)和效率验证(WB、QPCR)。以汉恒生物的LipoFiter转染试剂为例,转染示意图如下:
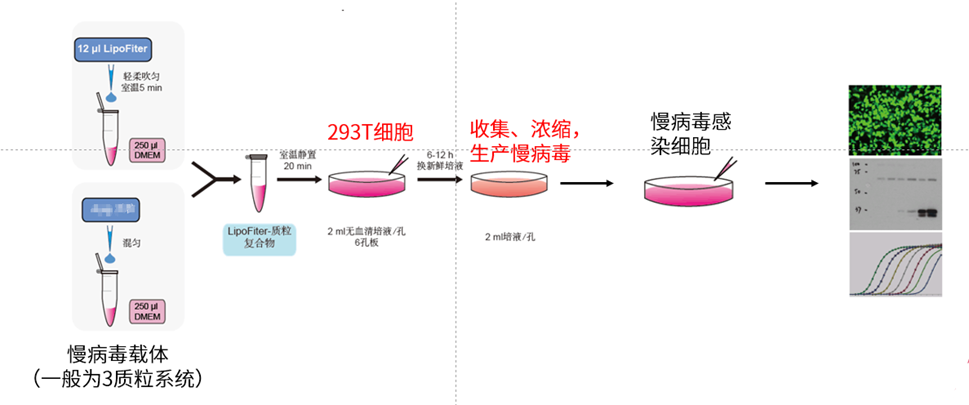
慢病毒包装转染步骤(以贴壁细胞为例):
慢病毒可使用3质粒系统(例如汉恒生物psPAX2质粒,pMD2.G质粒,pHBLVTM 系列质粒)包装,将目的基因片段或shRNA干扰片段构建至慢病毒穿梭载体,再将3质粒系统共转染293T细胞进行慢病毒的包装,病毒搜集和浓缩后再进行目的细胞的感染,大致流程如下:

查看更多

查看更多

查看更多

联系我们

返回顶部