查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

重组腺病毒载体是基于人腺病毒5型(Ad5),其基因组是 36kb 长的线性双链 DNA,是一种复制缺陷型腺病毒载体系统。具有以下几个显著优点:感染范围广,几乎可以感染所有的细胞系、原代细胞和部分组织;感染效率可高达 100%;对外源基因容载能力大(可以高达 8Kb);不整合基因组;滴度高,操作方便。因此,重组腺病毒是一种最具有潜力的基因递送工具。
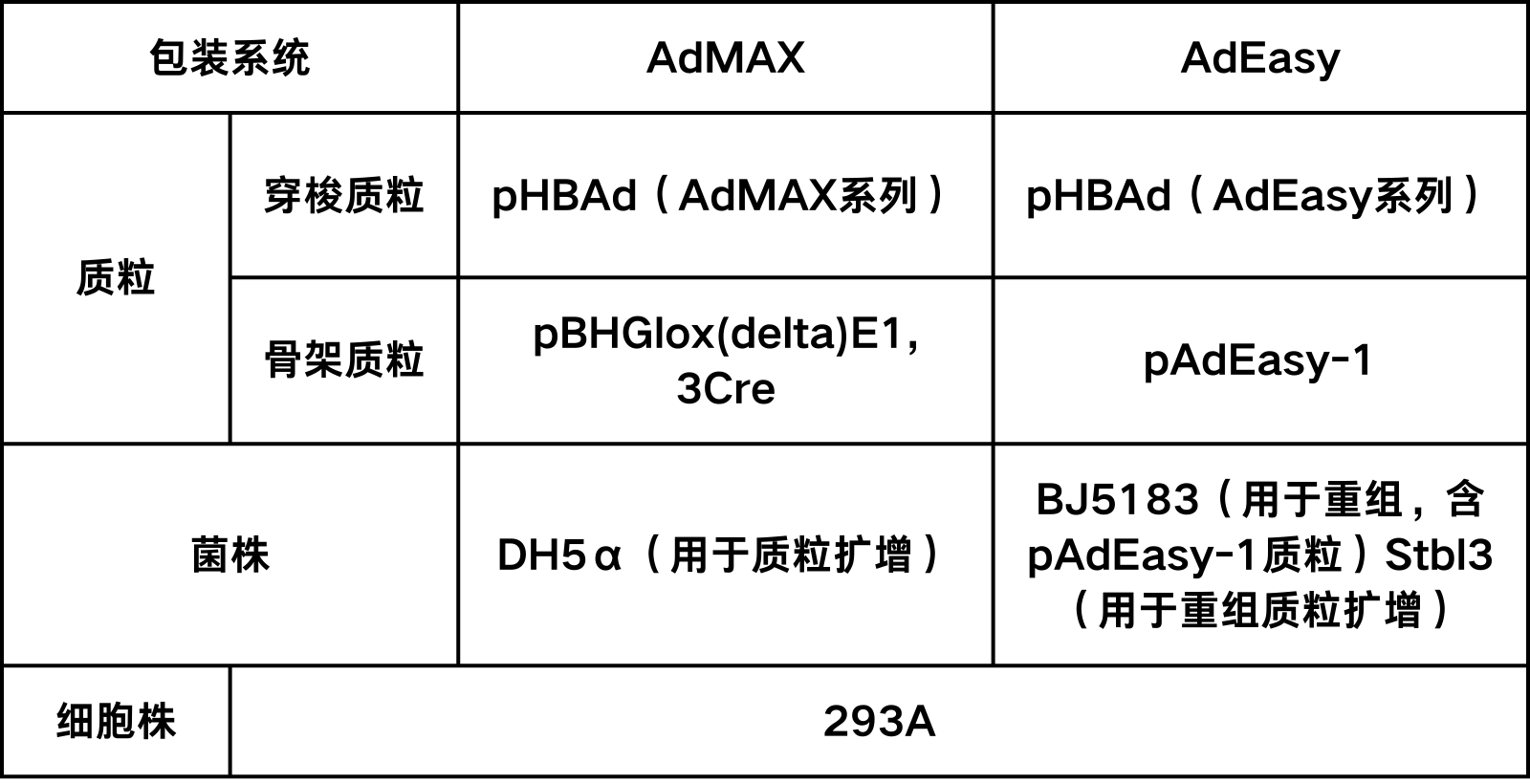
最常用的腺病毒包装体系有 AdEasy 和 AdMAX 两种,其共同特点是目的基因首先克隆到穿梭载体,再重组到腺病毒的大骨架上。以上两个系统均具有腺病毒早期转录复制基因 E1 和 E3 的缺陷(ΔE1,ΔE3),其中 E3 基因对病毒的产生并非必需。因此,腺病毒包装必需依赖表达 E1 的细胞系,例如 HEK-293,HEK-293A等
一、腺病毒包装流程:

二、材料与仪器
三、腺病毒包装和纯化
1.质粒构建和扩增
AdMAX系统:构建连接目的基因的pHBAdMAX质粒和pBHGlox(delta)E1, 3Cre质粒并大量抽提,用于转染293A细胞。
AdEasy系统:构建连接目的基因的pHBAdEasy质粒并进行酶切线性化;线性化后转入BJ5183感受态(含pAdEasy-1骨架质粒)进行重组,涂板培养单克隆并扩增,抽提质粒进行PacI酶切验证;验证正确的重组质粒转化Stbl3感受态,得到高纯度的重组质粒并进行PacI酶切线性化,用于转染293A细胞。
2.腺病毒包装

这里是以6cm培养皿为例的质粒参考用量。待293A细胞汇合度达到50%-70%时,备好病毒质粒、37℃预热好的DMEM、室温的转染试剂,按操作步骤进行转染。转染6h后更换新鲜培养基。
3.腺病毒收集
挑取 3-6 个空斑不等,放入1 ml新鲜培养基中过夜,然后比较滴度,使用滴度最高的一个空斑进行后续实验。(注:病毒收集前要观察病毒空斑是否形成。为了限制病毒的扩散而让空斑更好地形成,可在培养液中加入低熔点琼脂糖,一般在转染后第10 ~ 21天可以在显微镜下看到小的空斑。)
4.腺病毒扩增
将培养基中的病毒加入新鲜293A细胞培养液中进行病毒少量扩增,至再次出现空斑,收集细胞及上清,反复冻融三次收集病毒(P1代),感染293A细胞,连续进行三代感染,至P4代进行腺病毒的大量扩增并收集病毒。
5.腺病毒纯化
将病毒从-80℃冰箱取出,室温水浴融化。7000×g 4℃离心10min,弃细胞碎片,收集上清,0.22μm过滤除菌即可用于细胞实验。若用于对腺病毒滴度和纯度要求高的动物实验,则需要采用PEG8000沉淀-CsCl密度梯度离心-透析联用法进行纯化(方法如下)。
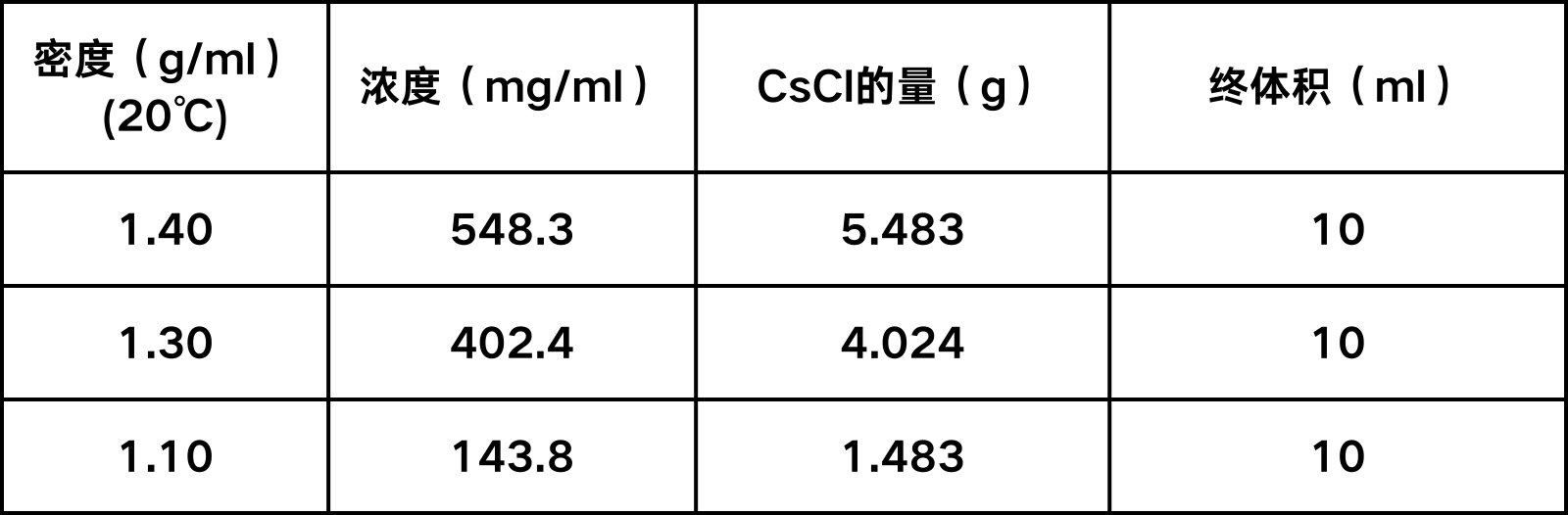
①PEG8000沉淀:每100 ml上清加入50 ml PEG8000(20% PEG8000,2.5 M NaCl),冰上放置1h使病毒沉淀(可适当延长时间)。7000×g 4℃离心上述混合物 20 min,弃上清,将沉淀物悬浮在10 ml密度为1.10 g/ml的CsCl溶液中(溶剂为20 mM Tris-HCl,PH8.0),病毒液应呈粉红色。
②CsCl梯度离心:加入2 ml密度为1.40 g/ml的CsCl溶液,然后再缓慢加入3 ml密度为1.30 g/ml的CsCl溶液,再加入5 ml的病毒悬浮液。使用Beckman SW28转子,26,000 rpm,4℃离心2小时。
三种不同密度CsCl溶液的配制:
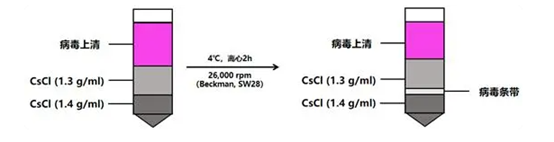
CsCl梯度离心示意图
③收集病毒:用注射器收集密度在1.30 g/ml和1.40 g/ml之间的病毒条带至透析袋中。(注:透析袋使用前用10 mM EDTA-Na2煮沸10 min,降至室温使用)
④透析:在透析缓冲液(50 g 蔗糖,10 ml 1M Tris-HCl,PH8.0,2 ml 1M MgCl2,定容至1L)中,4℃搅拌过夜,中间需更换一次透析液。收集病毒,测定病毒滴度。
6.病毒重悬和保存
弃上清,500 μl重悬液重悬病毒沉淀,一周内使用则置于4 ℃保存,如需长时间存放需置于-80 ℃或液氮罐保存。
注意事项:
1. 腺病毒相关实验请在生物安全柜(BL-2 级别)内操作。
2. 操作病毒时请穿实验服,佩戴口罩和手套,尽量不要裸露双手及手臂的皮肤。
3. 操作病毒时特别小心病毒溅出。如果操作时超净工作台有病毒污染,请立即用70%乙醇加1%的SDS溶液擦拭干净。接触过病毒的枪头、离心管、培养板、培养液请用84消毒液浸泡后统一处理。
4. 如需要离心,应使用密封性好的离心管,如有必要请用封口膜封口后离心。
5. 动物注射操作请在生物安全柜内(BL-2 级别)完成。
6. 病毒相关的废弃物需要特殊收集,统一经高温灭菌处理。
7. 实验完毕用洗手液清洗双手。

查看更多

查看更多

查看更多

联系我们

返回顶部