查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
研究基因调控少不了动物实验的验证,腺病毒和腺相关病毒是动物实验常用的工具病毒, 但腺相关病毒由于载体容量小,且初始表达量较低,当遇到目的基因较大或造模周期较短的情况时,腺病毒就成了首选。提到这个,你是不是有疑问,动物用的腺病毒和细胞用的腺病毒纯化程度是否不同呢?需要哪些特殊处理呢?本期小恒将从重组腺病毒发展历史的角度来解答这些疑问。

腺病毒载体最初是如何诞生的呢?这就不得不提到上世纪60年前后世界上出现的大规模疫情了,在此期间,科学家在手术切除的儿童扁桃体中发现了一种病毒,该疫情“元凶”后被国际病毒命名委员会命名为腺病毒,这是一种没有包膜的直径为70~100 nm的颗粒,由252个壳粒呈20面体排列构成,其基因组以线性的双链DNA形式存在。
将病原体改造为用于研究的安全载体,最主要的就是解析病毒特性以及基因组不同区域的功能。科学家发现病毒的复制周期可分为两个阶段,在早期阶段,基因组的多个不连续区域被表达,包括ElA、E1B、E2、E3和E4。其中,ElA编码的蛋白功能主要涉及控制病毒基因转录, E1B产物在病毒DNA复制、病毒和细胞mRNA代谢和蛋白质合成中发挥作用,E3虽然不是病毒复制所必需的,但其可能在调节宿主对病毒感染的免疫反应中起作用。因此,科学家们删去了E1和E3区域获得了重组腺病毒(下文简称为腺病毒),使其可以安全有效地将目的基因传递至细胞或者动物体内[1]。
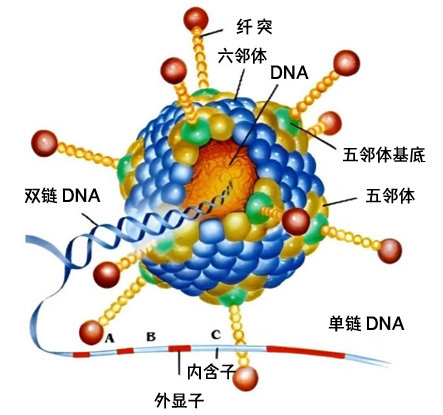
图1 腺病毒结构示意图
腺病毒诞生前,科学家们大多使用逆转录病毒和慢病毒进行疾病研究,然而这两种病毒在动物体内感染效果不够理想且会引起动物免疫反应,极大地阻碍了疾病研究进展。常规制备的腺病毒滴度高于逆转录病毒和慢病毒,同样的注射量可以传递更多的病毒颗粒进入体内,科学家门认为这样也许能够改善感染效果,因此自然而然将目光投向了腺病毒。
20世纪90年代,科学家们在啮齿类动物体内使用腺病毒治疗囊性纤维化,发表了大量相关研究论文,他们发现在实验动物体内注射腺病毒后,虽然疾病症状有所减轻,但事实上腺病毒载体将基因传递至靶器官的效率不够理想。除此之外,在基因转移部位会以剂量依赖的方式发生炎症[2]。
这些结果类似于动物对病毒感染的免疫反应,研究人员认为腺病毒或治疗性基因产物本身会诱导细胞毒性T细胞,破坏被腺病毒感染的细胞,导致治疗性基因的表达缺失和炎症(图3)。基于此,科学家进一步确认腺病毒会引起宿主的体液和细胞免疫反应,影响治疗效果。
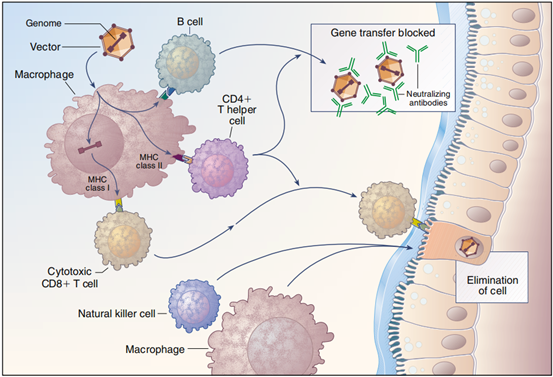
图2 腺病毒引起的免疫反应[2]
于是,科学家从实验各个节点排查腺病毒免疫原性的可能原因。他们发现,制备的腺病毒中通常含有人细胞蛋白、培养基中的牛血清蛋白和细胞碎片等杂质,这些杂质随腺病毒一起进入动物体内会引起免疫反应;同时包毒过程中产生的缺损颗粒也会影响最终的感染效果。所以科学家开始尝试多种方法去除杂质和缺损颗粒,以达到减轻腺病毒引起的免疫反应并提高基因表达效率的目的。
1994年,Yumi KANEGAE[3]等人发明了CsCl梯度纯化方法,可将重组病毒、缺损颗粒和杂质有效分离,最终得到的病毒滴度得到了近10倍的提升,这意味着避免杂质引起的免疫反应的同时,相同的注射量可以传递更多的病毒颗粒至宿主体内,以提高病毒感染效率和基因表达效率。
之后科学家发现CsCl梯度纯化方法最后增加透析步骤去除病毒中的CsCl后获得的病毒更适用于动物实验,但这一方法仅适用于小规模生产,而将腺病毒应用于临床必然需要大规模标准化生产,为此科学家研发了层析纯化方法并不断改善,进一步提高了病毒的纯度,可用于临床试验(图4)。
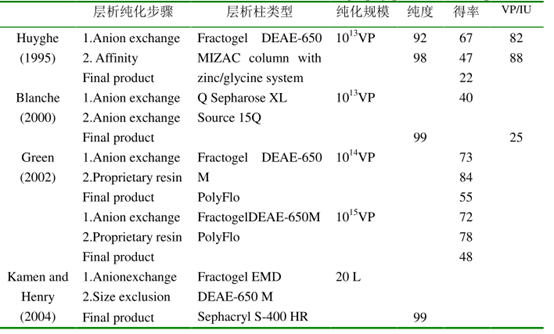
图3 腺病毒层析纯化方法[4]
除了显著降低宿主的不良影响外,纯化后的腺病毒自身诱导的免疫系统的激活产生的免疫细胞数量大幅减少,进而被清除的病毒颗粒减少,最终进入靶器官或组织的病毒量增加,即使多次注射依然有较高的基因表达效率。
汉恒生物致力病毒包装十余年,提供的纯化腺病毒已助力多位老师发表高分文章,在这里分享两篇案例。
南京医科大学第二附属医院的戴春笋研究团队使用汉恒生物提供的纯化腺病毒(Ad-DHHC9-HA)来研究蛋白棕榈酰化对肾纤维化的影响。作者通过肾实质注射将50 μL Ad-DHHC9-HA递送至肾脏中,一段时间后取样观察发现过表达DHHC9可抑制疾病模型小鼠肾纤维化。
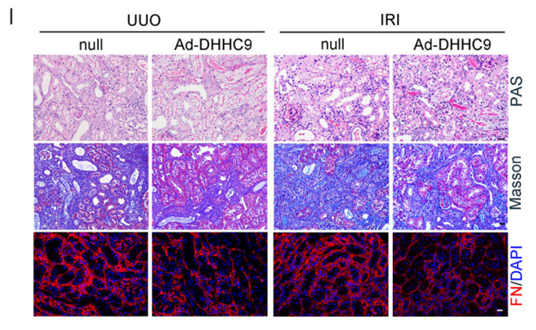
图4 利用纯化腺病毒在肾脏中过表达DHHC9[5]
华东师范大学的逢秀凤团队在《Journal of Clinical Investigation》期刊上发表了题为“BCL6 is regulated by the MAPK/ELK1 axis and promotes KRAS-driven lung cancer”的研究论文,其中使用了汉恒生物提供的纯化腺病毒(Ad-Cre)构建基因敲除小鼠来研究肺癌。作者将LSL-KrasG12D和Bcl6flox/flox小鼠杂交,获得LSL-KrasG12D/+&Bcl6+/+、LSL-KrasG12D/+&Bcl6+/flox和LSL-KrasG12D/+&Bcl6flox/flox小鼠,分别在三种小鼠中鼻内注射Ad-Cre,来观察KrasG12D表达的条件下Bcl6不同的表达水平对肺部肿瘤的影响,发现敲除Bcl6后Kras诱导的肿瘤发展受到显著抑制。
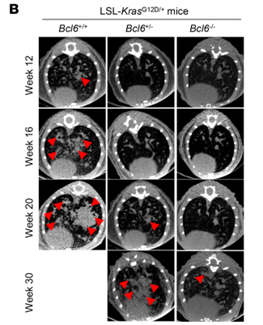
图5 Ad-Cre注射基因小鼠后肿瘤代表性图像[6]
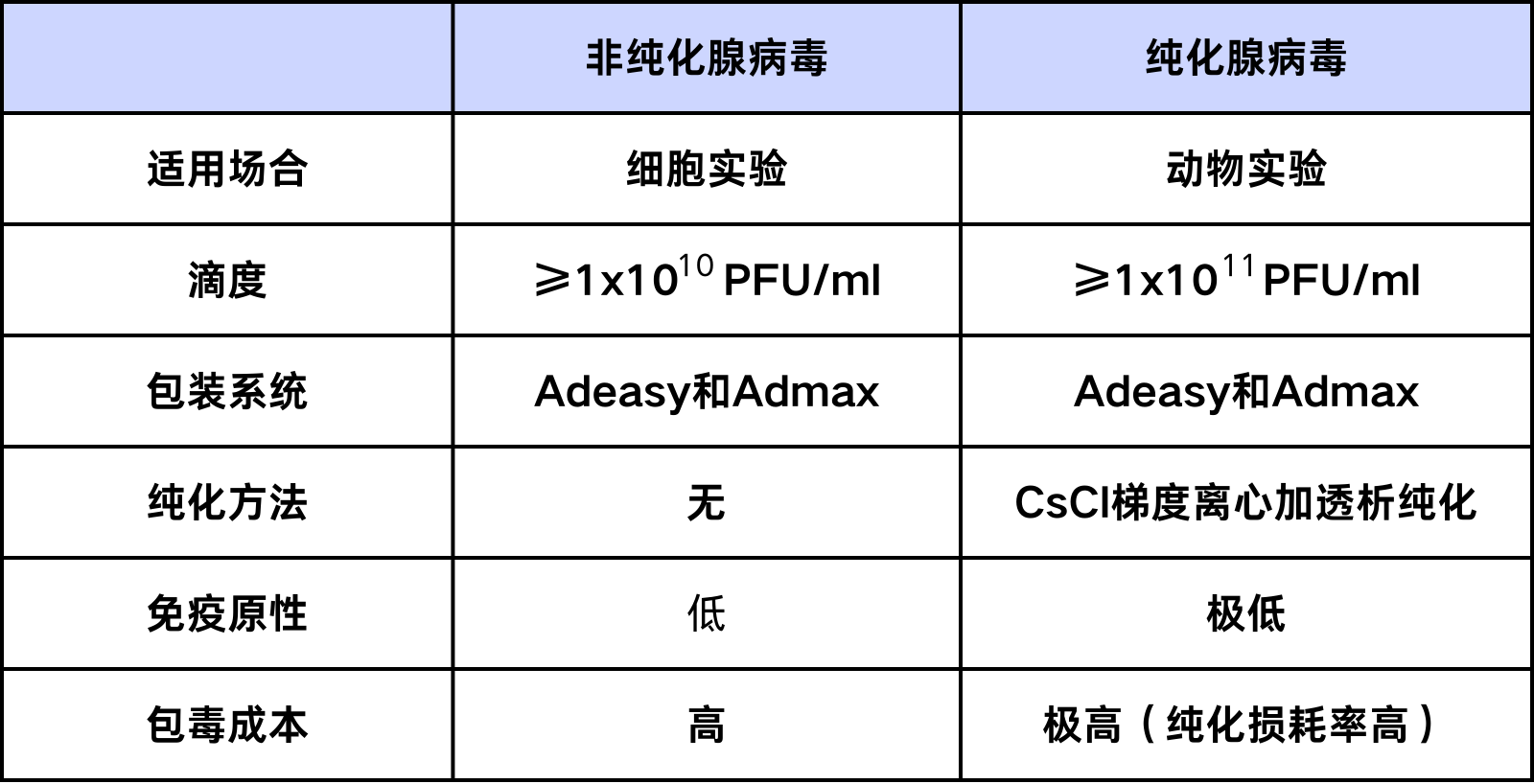
综上,使用纯化腺病毒用于动物实验可以减轻宿主免疫反应,同时减少因免疫反应引起的病毒颗粒损耗,有助于提高基因表达效率,相比非纯化的腺病毒更加安全有效,两者的区别详见表1。
表1 普通腺病毒和纯化腺病毒的特点
到这里相信各位关于动物用腺病毒是否需要纯化已经有了答案,汉恒生物专业做腺病毒十多年,拥有严苛的细胞培养环境(全程使用高品质Gibco血清、精选10代以内高活力293细胞、确保支原体检测100%阴性)和严格的质控管理体系(病毒包装全程严密监视、标准的滴度检测流程,达标率不低于98%、CsCl梯度离心加透析纯化),同时拥有Adeasy和Admax双包装系统备选,确保项目高成功率。病毒滴度从1×10^10PFU/ml到1×10^11PFU/ml多规格可选,相比普通腺病毒,纯化腺病毒滴度至少增加10倍,包装过程中病毒损耗量达60%-70%,成本增加近30倍,价格仅增加不到一倍。细胞实验和动物实验适用的腺病毒汉恒生物均可提供,欢迎各位老师咨询~
参考文献:
[1]Graham F L, Prevec L. Adenovirus-based expression vectors and recombinant vaccines. Biotechnology (Reading, Mass.), 1992, 20:363-90.
[2]Wilson J M. Adenoviruses as gene-delivery vehicles. The New England journal of medicine, 1996, 334(18):1185-7.
[3]Kanegae Y, Makimura M, Saito I. A simple and efficient method for purification of infectious recombinant adenovirus. Japanese journal of medical science & biology, 1994, 47(3):157-66.
[4] 齐延新.重组腺病毒纯化,质量控制及安全性评价初步研究[D].吉林大学,2013.
[5]Ritter Thomas, Lehmann Manfred, Volk Hans-Dieter. Improvements in gene therapy: averting the immune response to adenoviral vectors. BioDrugs: clinical immunotherapeutics, biopharmaceuticals and gene therapy, 2002, 16(1).
[6]Gu M, Jiang H, Tan M, et al. Palmitoyltransferase DHHC9 and acyl protein thioesterase APT1 modulate renal fibrosis through regulating β-catenin palmitoylation. Nat Commun. 2023;14(1):6682.
[7]Li K, Liu Y, Ding Y, et al. BCL6 is regulated by the MAPK/ELK1 axis and promotes KRAS-driven lung cancer. J Clin Invest. 2022;132(22):e161308.

查看更多

查看更多

查看更多

联系我们

返回顶部