查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期干货为大家介绍了外周神经特异性基因调控策略,本期将继续带大家了解骨骼组织特异性基因调控策略,主要从骨骼组织特性及组成、骨骼嗜性AAV血清型、骨骼特异性启动子和病毒递送到骨骼的方法等方面展开分享。

一、骨骼组织特性及组成
骨骼(bone,skeleton)是人或动物体内或体表坚硬的组织,分内骨骼和外骨骼,人和高等动物的骨骼在体内,由许多块骨头组成,称为内骨骼;软体动物体外的硬壳以及某些脊椎动物(如鱼、龟等)体表的鳞、甲等叫外骨骼。通常说的骨骼指内骨骼,具有运动、支持和保护身体、制造红血球和白血球、储藏矿物质等功能。
骨组织由大量钙化的细胞间质及数种骨组织细胞组成。钙化的细胞间质称为骨基质。细胞有骨细胞、骨原细胞、成骨细胞及破骨细胞4种。骨细胞最多,位于骨基质内,其余3种细胞位于骨组织的边缘。
(一)骨基质
骨基质即骨的细胞间质,由有机成分和无机成分构成,含水极少。有机成分由成骨细胞分泌形成,包括大量胶原纤维(占有机成分的95%)及少量无定形基质。无定形基质为凝胶,内含中性或弱碱性糖胺多糖,有粘着胶原原纤维的作用。无机成分又称骨盐(bone mineral),主要为羟磷灰石结晶(hydroxyapatite crystal),属不溶性中性盐,呈细针状,长10~20nm,沿胶原原纤维长轴规则排列并与之结合。有机成分与无机成分的紧密结合使骨十分坚硬。骨基质结构呈板层状,称为骨板(bone lamella),成层排列的骨板犹如多层木质胶合板。同一骨板内的纤维相互平行,相邻骨板的纤维则相互垂直,这种结构形式有效地增强了骨的支持力。
(二)骨组织的细胞
1、骨细胞(osteocyte):单个分散于骨板内或骨板间。骨细胞是有许多细长突起的细胞,其所在空隙称骨陷窝(bone lacuna),突起所在的空隙称骨小管(bone canaliculi)。相邻骨细胞的突起以缝隙连接相连,骨小管则彼此连通。骨陷窝和骨小管内含组织液,可营养骨细胞和输送代谢产物。骨陷窝周围的薄层骨基质钙化程度较低,并可不断更新,在机体需要时,骨细胞的溶骨作用可溶解此层骨基质,使Ca2+释放入骨陷窝的组织液中,继而进入血液,对维持血钙的恒态水平有一定作用。
2、骨原细胞(osteogenic cell):是骨组织中的干细胞,位于骨外膜及骨内膜贴近骨处。在骨髓腔,特别是骨中毛细血管中也有许多骨原细胞。当骨组织生长或改建时,骨原细胞能分裂、分化为成骨细胞,在一定刺激下也可向破骨细胞分化。
3、成骨细胞(osteoblast):分布于骨外膜的内层及骨的内表面,即位于骨小梁或骨髓腔表面,靠近骨内膜。成骨细胞参与合成胶原纤维和无定形基质,其过程与成纤维细胞的情形相似。成骨时,成骨细胞分泌骨基质的有机成分,称为类骨质。当成骨细胞被类骨质包埋后,便成为骨细胞。
4、破骨细胞(osteoclast):破骨细胞主要分布在骨组织表面及骨内膜附近,数目较少。破骨细胞对骨的吸收相当活跃,可以从一个部位游走到另一部位,继续其破骨活动。一个破骨细胞可以溶解吸收100个成骨细胞形成的物质。破骨细胞的形成和活性受体内甲状旁腺素和降钙素水平的影响和制约,前者可以促其形成和活性增强,后者则使之生成和活性受到抑制。在正常生理情况下,成年人血液中这两种激素处于平衡状态,所以破骨和成骨也处于平衡状态。
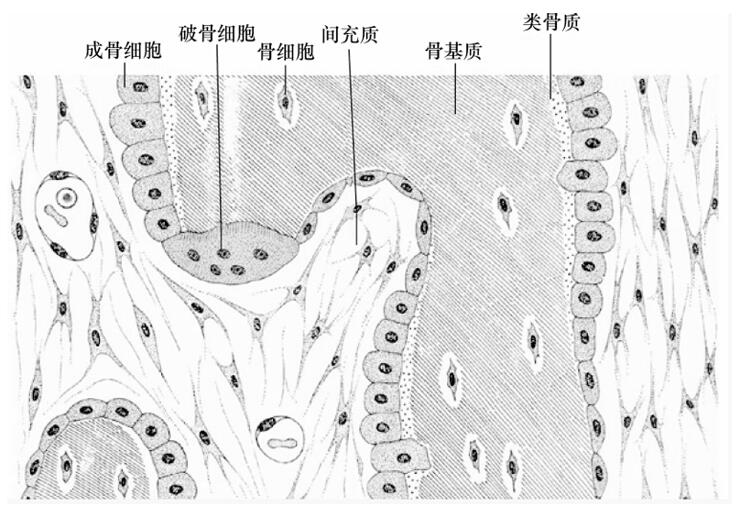
图1 骨骼组织的结构
二、骨骼嗜性AAV血清型
目前有10多种不同血清型的AAV可用于构建病毒载体,但是不同血清型AAV载体对不同组织和不同细胞的转染效率差异较大,因此只有选对合适的血清型才能让感兴趣基因特异性表达在目标组织和细胞中。在“Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis”这篇文献[1]中, 作者在体外检测了不同血清型AAV对成骨细胞(COB)、骨髓间充质来源的成骨前体细胞(BM-OCP)和软骨前体细胞系(ATDC5)的感染效率,发现AAV1, 4, 5, 6, 7, 9, rh10和rh39等8种血清型的AAV在体外成功感染成骨细胞。然而,体外的成功感染并不能代表体内的效率,因为生物体内存在着多种生理屏障,如血清因子、体循环内的中和抗体及细胞外基质屏障等等。因此,作者通过关节腔内注射来检测上述血清型AAV的体内感染效率。而上述8种AAV中,只有AAV9可以成功感染松质骨和皮质骨处的骨骼细胞,包括成骨细胞、骨细胞和破骨细胞等。
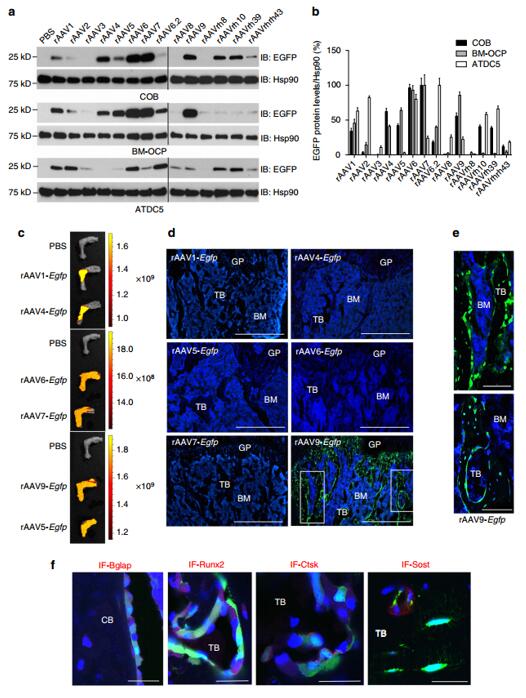
图2 不同血清型AAV在骨骼组织中的表达效率[1]
接着作者开发了一种骨特异性的rAAV9.DSS-Nter血清型,采用尾静脉注射感染方式时,与普通的AAV9相比,其几乎不感染心脏,肝脏的感染效率减少55%,下肢骨骼肌的感染效率减少75%,更为重要的是,其感染成骨细胞的效率显著增强。
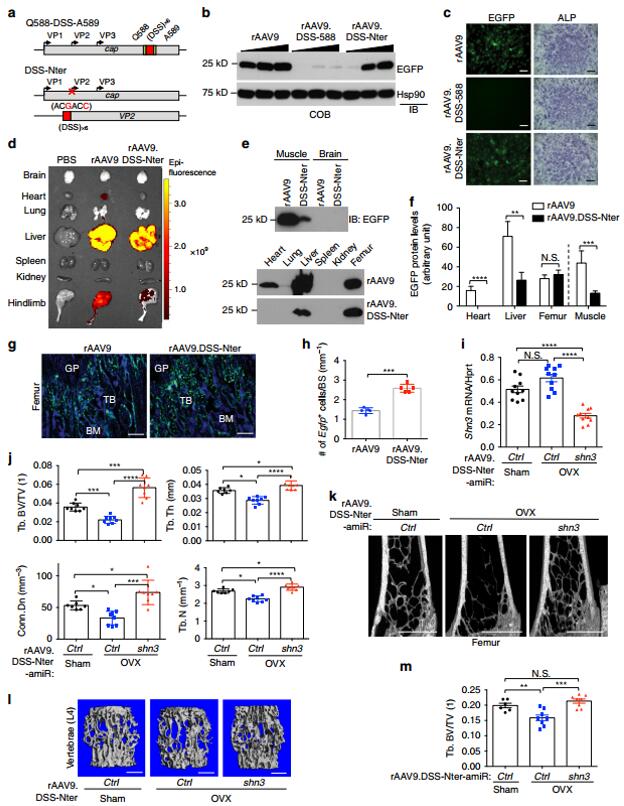
图3 AAV9.DSS-Nter的改造及在各组织中的感染效率[1]
三、骨骼特异性启动子
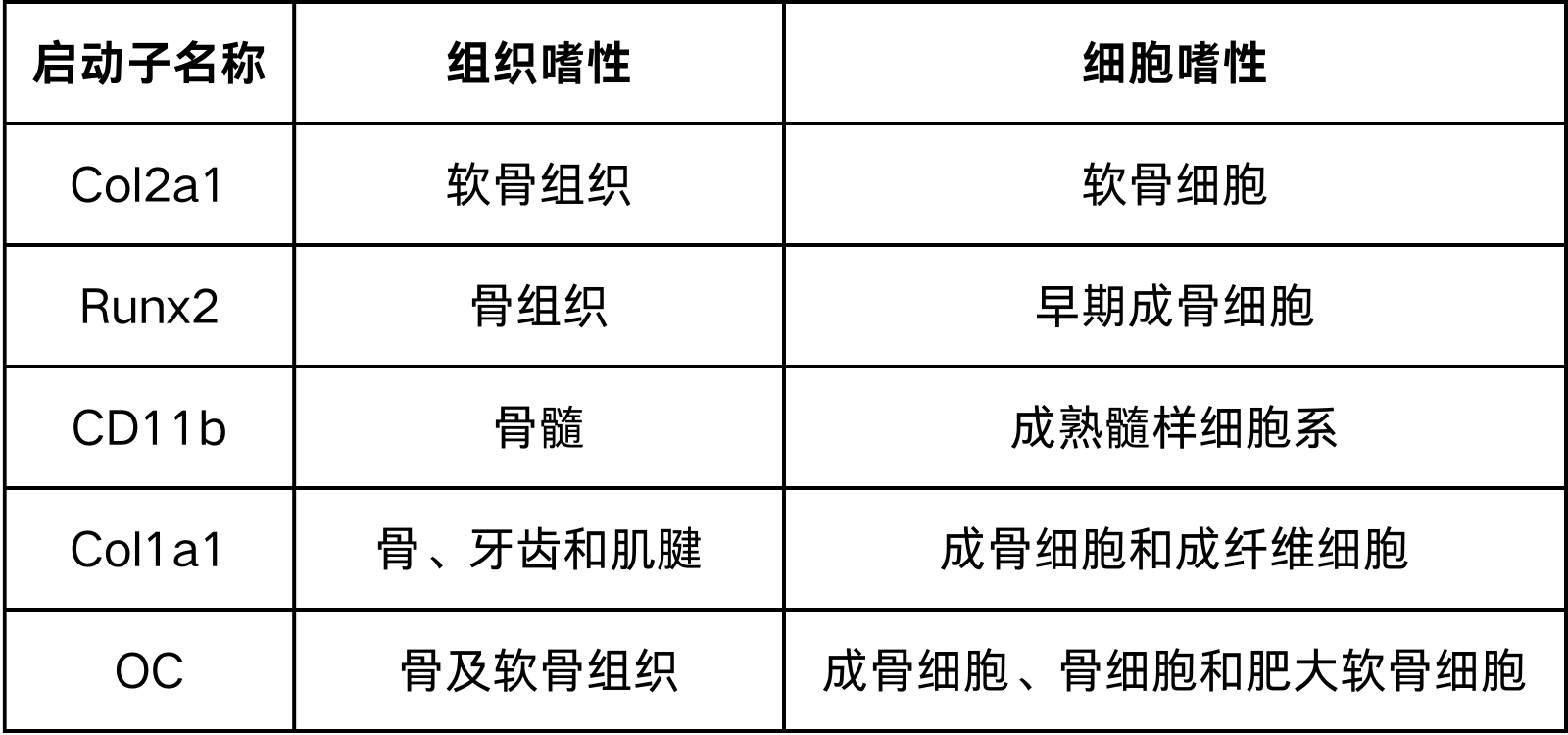
载体工具的选择,除了组织/器官靶向性的血清型外,不同类型骨骼组织细胞也可以通过载体携带相应的特异性启动子来实现靶基因特异性启动表达的效果。骨骼组织研究中,启动子通常选择广谱型启动子CMV、EF1α、CAG、U6等;当然,如果是要增强对骨骼组织中某类细胞的特异性,可以选择Col2a1、Runx2、CD11b、Col1a1、OC等特异性启动子。
Col2a1基因编码 II型胶原蛋白的 alpha-1 链,II型胶原蛋白是一种存在于软骨和眼睛玻璃体液中的纤维状胶原蛋白,基于Col2a1的基因表达特异性,Col2a1启动子载体被设计并成功驱动外源基因在小鼠软骨细胞的特异性表达。Ruan在骨关节炎(OA)研究中在关节内注射AAV-Col2a1-Prg4,有效防止创伤后 OA 的发生[2]。
Runx2是成骨细胞特异性转录因子2(runt-related transcription factor2, Runx2),属于转录因子 Runxx 家族成员,主要在早期成骨细胞中表达,可通过多种信号转导途径参与骨代谢异常、牙齿发育障碍、肿瘤以及器官纤维化等疾病的发生,Runx2启动子可作为早期成骨细胞特异性启动子。Roberta等人在研究常染色体隐性成骨不全症(OI)时,利用Runx2 启动子表达 Cre 重组酶成功移除 Tmem38b 基因的第 3 外显子,生产出了Tmem38b 成骨细胞特异性条件性基因敲除小鼠((Runx2Cre;Tmem38bfl/fl)[3]。
CD11b基因编码的蛋白是整合素alpha M(ITGAM),是全髓系细胞的标志物,成熟髓样细胞系来源于骨髓中常见的髓系祖细胞 (CMP),包括单核细胞、巨噬细胞和粒细胞等,因此CD11B启动子可以作为成熟髓样细胞特异性启动子。Cucchiarini等在AAV介导的脑小胶质细胞选择性基因表达研究中验证了CD11b启动子在小胶质细胞、单核细胞、巨噬细胞中具有启动活性[4]。
Col1A1基因编码 I 型胶原的alpha-1 链, I 型胶原是一种形成纤维的胶原蛋白,存在于大多数结缔组织中,在骨骼、角膜、真皮和肌腱中含量丰富。Col1A1启动子已被证实在前成骨细胞祖细胞及其成骨细胞和后代细胞中有活性,Xin等人用 Col2.3(由Col1A1转录起始位点上游约 2.3 kb DNA 组成)启动GFP的表达成功标记了成骨细胞系[5]。
OC即骨钙素,又被称为骨γ-羧基谷氨酸包含蛋白(BGLAP),是BGLAP编码的,由成骨细胞、成牙质细胞、增生的软骨细胞合成的骨组织中含量最丰富的维生素K依赖的非胶原蛋白,在调节骨钙代谢中起重要作用。OC启动子可作为成骨细胞、骨细胞和肥大软骨细胞特异性启动子。Koons等在探索骨组织工程基因疗法的研究中,使用了人骨钙素/荧光素酶(hOC/Luc)转基因小鼠模型,其中荧光素酶基因受OC特异性启动子的控制[6]。
表1 骨特异性启动子信息
四、病毒递送到骨骼的方法
感染骨骼系统常见的注射方式有尾静脉注射、骨关节腔注射、骨内注射等。其中尾静脉注射是系统性给药,特异性相对较差,但因其操作简单、损伤性小,所以在文献中比较常见。而骨关节腔注射和针对骨髓的骨内注射这两种注射方式的感染效果较好但操作相对比较繁琐。
静脉注射:
发表在《Front Mol Biosci》杂志上的文章“ZEB1 Mediates Bone Marrow Mesenchymal Stem Cell Osteogenic Differentiation Partly via Wnt/β-Catenin Signaling”中,作者使用了汉恒生物提供的AAV-shZEB1,采用尾静脉注射的方式向4周龄的卵巢摘除模型小鼠注射了200ul病毒液,造模后12周,取股骨进行骨组织形态学测定,结果显示,ZEB1的敲低抑制了卵巢切除小鼠的快速骨质流失,或可作为治疗和预防绝经后骨质疏松症(PMOP)的潜在合成代谢策略[7]。尾静脉注射易于操作,但是特异性相对较差,由于大多数病毒对肝脏具有高亲和性,会增加肝毒性的风险。此外,尾静脉注射通常需要较高的病毒滴度且病毒用量较大,会导致实验成本过高。
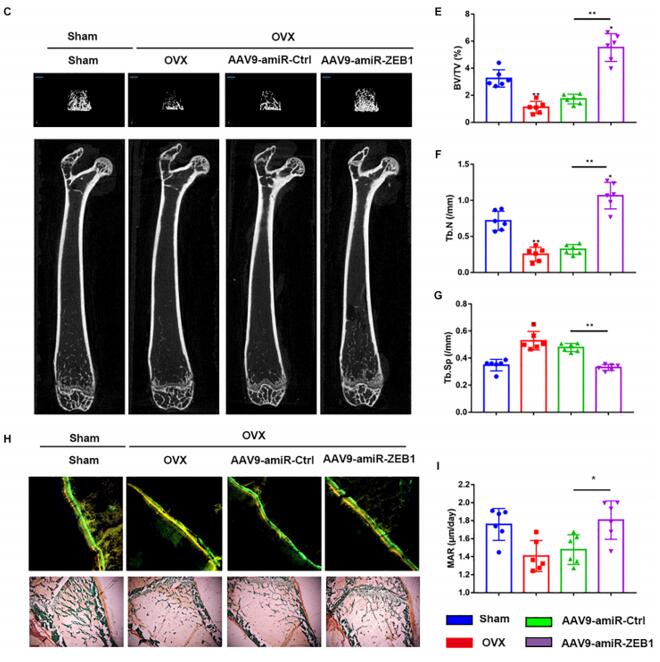
图4 ZEB1的下调可减轻卵巢切除术引起的骨质流失[7]
骨关节腔内注射:
发表在《nature communication》杂志上的文章“CircRREB1 mediates lipid metabolism related senescent phenotypes in chondrocytes through FASN post translational modifications”中,作者使用了汉恒生物提供的AAV-CircRREB1,采用膝关节注射的方式向8周龄的CircRreb1 cKO雄性小鼠膝关节注射了10ul病毒液(滴度1×1012vg/ml)。逆转了CircRreb1缺乏对小鼠的保护作用,将CircRREB1确定为与年龄相关的骨关节炎的潜在预后和治疗靶点[8]。
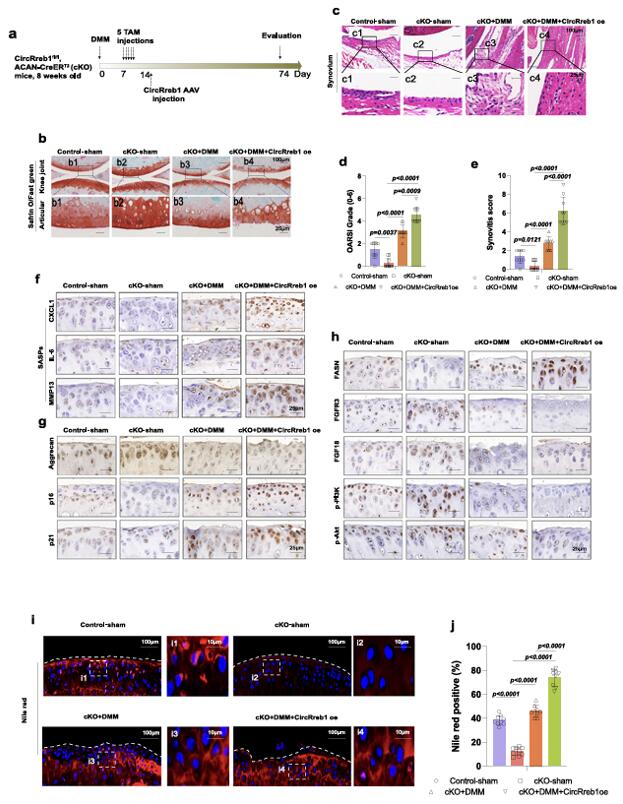
图5 体内注射AAV-CircRREB1可逆转CircRreb1基因敲除对CircRreb1cKO小鼠的保护作用[8]
对于骨关节腔内注射的具体的操作步骤如下:
1、麻醉小鼠后备皮消毒,取膝关节正中纵向皮肤切口,长约2 mm。
2、牵拉皮肤寻找膝关节髌韧带,应用微量注射器以髌韧带内缘中点为进针点,斜向后上方约1.5 mm深度注射生理盐水或病毒液入关节腔。
3、拔针后稍用力加压针眼处,最后缝合皮肤切口。
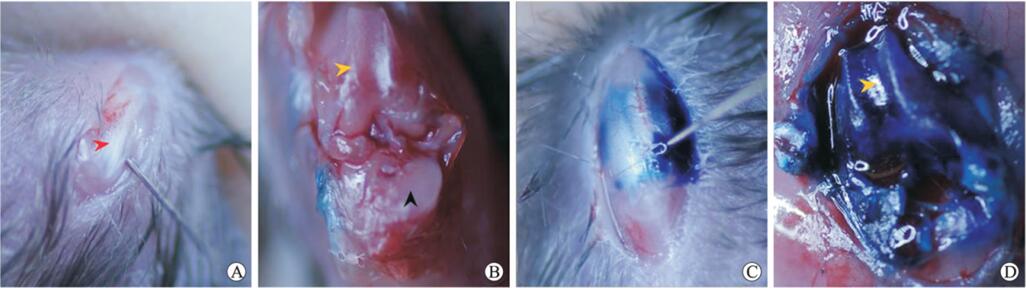
图6 小鼠关节腔微量注射技术概述[9]
A、C:斜后上方进针,注射生理盐水/甲苯胺蓝后压迫2 mm,针眼无液体渗出;B、D:处死小鼠后切断前后交叉韧带,充分暴露关节面。红色箭头示髌韧带,黑色箭头示胫骨上段,橙色箭头示股骨髁。
骨内注射:
发表在《HAEMATOLOGICA》杂志上的文章“Glycolytic enzyme PFKFB3 determines bone marrow endothelial progenitor cell damage post chemotherapy and irradiation”中,作者使用了汉恒生物提供的AAV-tie-PFKFB3,采用骨内注射的方式向8-10周龄的雌性小鼠股骨内注射了30ul病毒液(滴度1×1013vg/mL),成功实现了骨髓内皮细胞PFKFB3特异性过表达。揭示了PFKFB3在触发骨髓内皮祖细胞损伤中的关键作用,并表明内皮中的PFKFB3可能是骨髓抑制性损伤的潜在治疗靶点[10]。
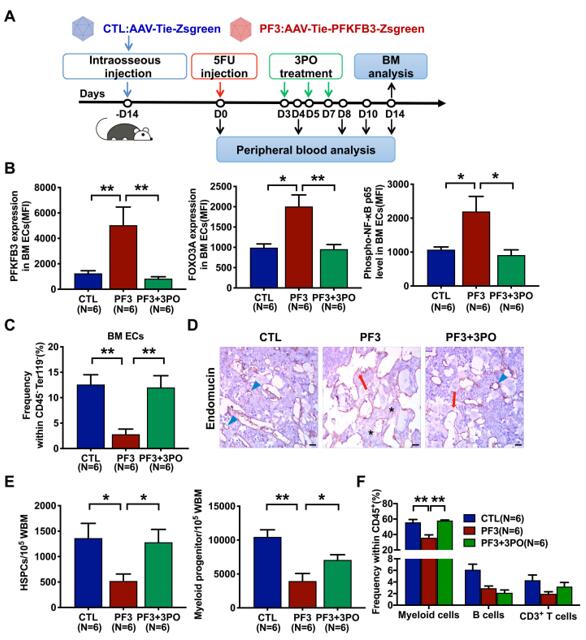
图7 PFKFB3在触发骨髓内皮祖细胞损伤中的关键作用[10]
对于骨内注射的具体的操作步骤如下:
1、用异氟烷对小鼠进行麻醉,双膝屈曲,膝后各有一个支撑物。剃除关节周围的毛发,用70% 的酒精和碘酒清洁关节区域。
2、用1毫升注射器,将25号针头插入股骨内间隙,在胫骨和股骨关节之间的股骨顶部髁之间轻轻扭转并施压,将25号的针头和针帽留在原处,轻轻取出1毫升注射器。
3、将带有32G针头的汉密尔顿注射器插入塑料盖开口。32G骨髓针在距针尖3.5厘米处做标记,以指示穿刺长度。
4、将病毒缓慢注入股骨柄。然后慢慢取出以限制回流。轻轻拔出针头,观察小鼠让其恢复。
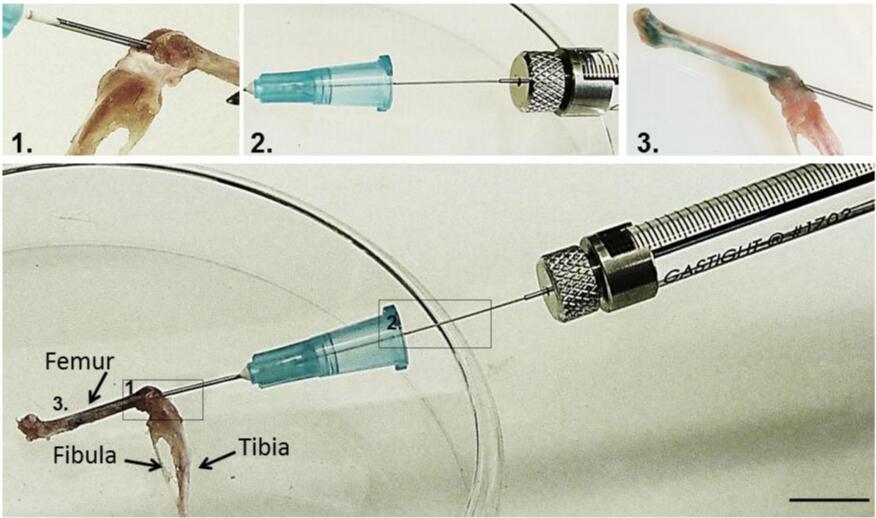
图8 骨内注射技术概述[11]
本期干货内容主要为大家介绍了使用AAV感染骨骼组织时,血清型/启动子的选择、病毒的使用方法和案例介绍等内容,希望能对正在做骨骼组织方面实验的老师提供一些参考。汉恒生物还研发了靶向神经、肌肉、肾脏、肝脏、视网膜等组织器官的AAV特异性启动子和特异性血清型,欢迎各位老师同学来电咨询,热线:400 092 0065。
本期内容到这里就结束了,下期我们将会继续分享载体构建相关干货内容,敬请关注!
参考文献:
[1] Yang YS, Xie J, Wang D, et al. Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis. Nat Commun. 2019 Jul 4;10(1):2958.
[2] Ruan MZ, Erez A, Guse K, et al. Proteoglycan 4 expression protects against the development of osteoarthritis. Sci Transl Med. 2013 Mar 13;5(176):176ra34.
[3] IMPERFECTA, ON OSTEOGENESIS. "OI2022." (2022).
[4] Cucchiarini M, Ren XL, Perides G, et al. Selective gene expression in brain microglia mediated via adeno-associated virus type 2 and type 5 vectors. Gene Ther. 2003 Apr;10(8):657-67.
[5] Xin X, Jiang X, Wang L, et al. A Site-Specific Integrated Col2.3GFP Reporter Identifies Osteoblasts Within Mineralized Tissue Formed In Vivo by Human Embryonic Stem Cells. Stem Cells Transl Med. 2014 Oct;3(10):1125-37.
[6] Koons G L , Diba M , Mikos A G . Materials design for bone-tissue engineering. Nature Reviews Materials, 2020, 5(Suppl. 2).
[7] Xu C, Shi H, Jiang X, et al. ZEB1 Mediates Bone Marrow Mesenchymal Stem Cell Osteogenic Differentiation Partly via Wnt/β-Catenin Signaling. Front Mol Biosci. 2021 May 24;8:682728.
[8] Gong Z, Zhu J, Chen J, et al. CircRREB1 mediates lipid metabolism related senescent phenotypes in chondrocytes through FASN post-translational modifications. Nat Commun. 2023 Aug 28;14(1):5242.
[9] 冯萌, 钱庄, 李萌,等. 内侧半月板失稳诱发C57BL/6小鼠骨关节炎模型中关节腔微量注射方法的建立[J]. 西安交通大学学报:医学版, 2018, 39(3):5.
[10] Lyu ZS, Tang SQ, Xing T, et al. The glycolytic enzyme PFKFB3 determines bone marrow endothelial progenitor cell damage after chemotherapy and irradiation. Haematologica. 2022 Oct 1;107(10):2365-2380.
[11] Selenica ML, Reid P, Pena G, et al. Adeno associated viral-mediated intraosseous labeling of bone marrow derived cells for CNS tracking. J Immunol Methods. 2016 May;432:51-6.

查看更多

查看更多

查看更多

联系我们

返回顶部