查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
前几期特异性基因调控干货文章分别介绍了靶向内耳、肠道、胚胎与子宫以及肺脏等组织/器官的特异性基因调控策略,本期将继续带大家了解泌尿系统的特异性基因调控策略,主要从泌尿系统组织特性及组成、泌尿系统嗜性AAV血清型、泌尿系统特异性启动子和病毒递送到泌尿系统组织/器官的方法等四个方面展开分享。
人体的泌尿系统主要由肾脏、输尿管、膀胱、尿道以及男性泌尿系统的前列腺组成。泌尿系统的核心功能是生成和排泄尿液,同时还调节机体酸碱平衡和水盐平衡,对维持机体的正常生命活动具有至关重要的作用。在往期内容中我们详细介绍了肾脏AAV靶向递送的策略《肾脏组织丨AAV在肾脏组织研究中的靶向策略》,本期内容主要分享泌尿系统中另外两个主要器官——前列腺和膀胱的靶向基因调控策略。
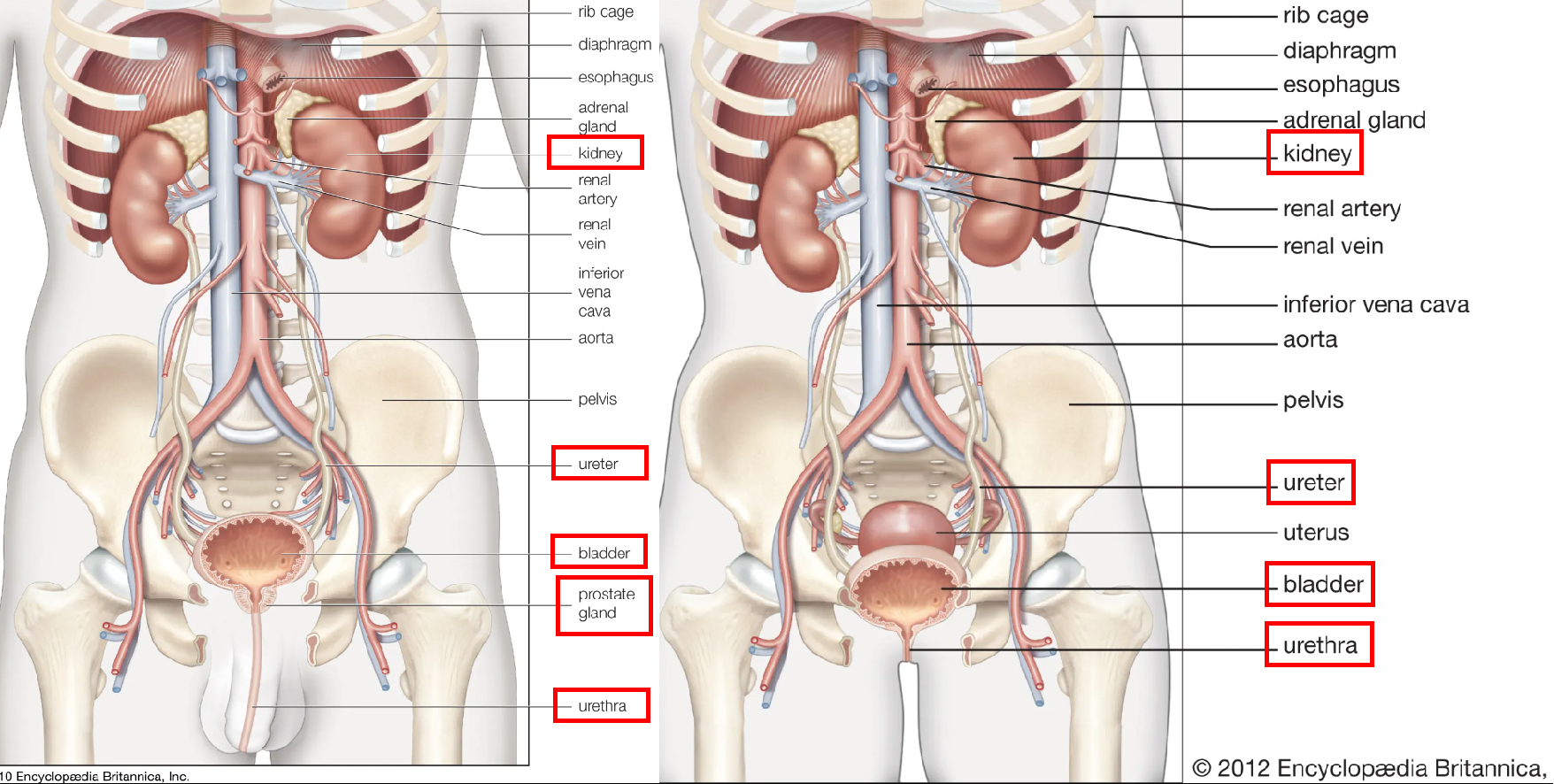
图1. 人体泌尿系统分布图:左图为男性,右图为女性
膀胱是储存尿液的肌性囊状器官,其形状、大小、位置和壁的厚度随尿液充盈程度而异。膀胱壁由四层组织组成,从内向外分别是黏膜层(尿道上皮)、黏膜下层、逼尿肌肌肉层和外膜。发生于膀胱的常见疾病包括膀胱肿瘤、炎症性病变、膀胱结石、膀胱神经源性病变等。其中膀胱肿瘤是泌尿系统最常见的肿瘤,最常见的病理类型是尿路上皮癌,少见的是腺癌、鳞状细胞癌,主要症状是无痛性、间歇性的肉眼血尿。男性患膀胱癌的可能性大约是女性的三到四倍,但女性被确诊时通常已发展为更晚期的癌症,预后更差。在世界范围内,膀胱癌是第九位最常见的癌症,也是第十三位最致命的癌症。目前对癌症基因组学、风险因素和免疫疗法的研究可能是对抗这种恶性疾病取得进展的关键[1]。
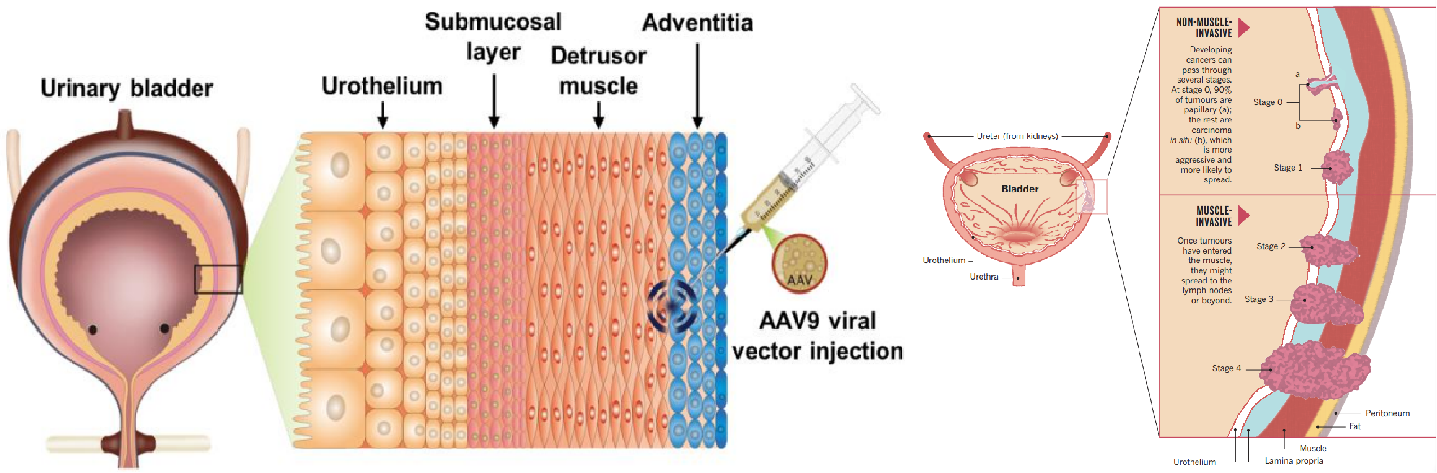
图2. 膀胱组织结构及癌变示意图
前列腺是男性特有的器官,既属于泌尿系统也属于生殖系统,兼具控制排尿和分泌前列腺液的功能。前列腺实质由30 ~ 50个形态和大小不一的复管泡状腺组成,最后汇成16 ~ 32条导管,开口于尿道前列腺部精阜两侧及前列腺窦底的黏膜表面。腺体以尿道为中心排列成内、中、外三个环形区带。内层区域为黏膜腺:最小,位于尿道粘膜内,导管开口于尿道;中层区域为黏膜下腺:位于尿道粘膜下层,导管于精阜两侧开口于尿道;外层区域为主腺:位于前列腺的外围,占前列腺的大部分,亦开口于精阜两侧。前列腺疾病是成年男性的常见疾病,通常指前列腺炎、前列腺增生及前列腺癌等,其中前列腺癌占全球男性诊断癌症的7%,每年诊断出超过120万新病例,前列腺癌相关死亡人数超过35万,该疾病是男性癌症相关死亡的主要原因之一。作为男性中第二常见的癌症,前列腺癌的主要驱动因素被认为是前列腺基底或管腔上皮细胞的基因突变。早期诊断可导致良好的结果和较高的长期生存率,但男性去势抵抗转移性疾病的预后相对较差,亟需开发更有效的治疗策略[2]。
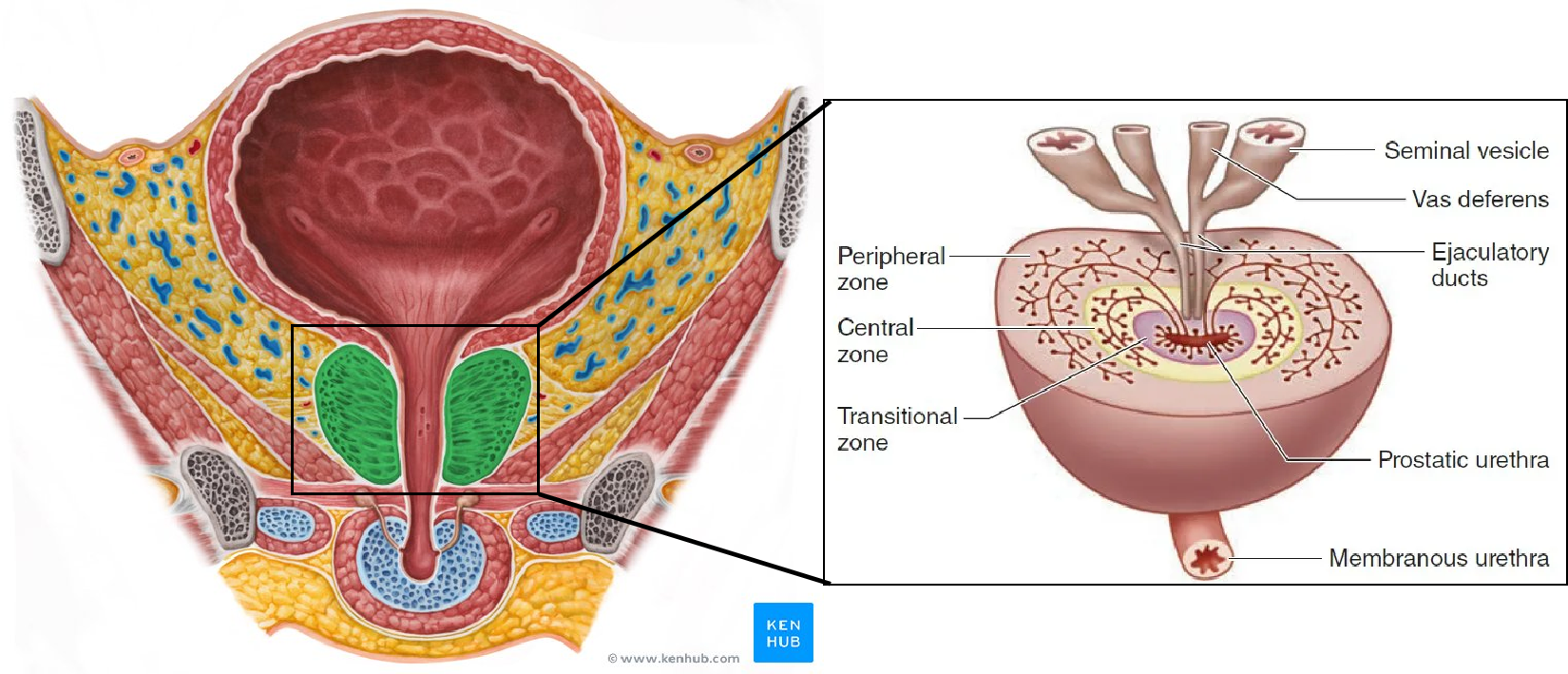
图3. 前列腺组织结构示意图
重组腺相关病毒(rAAV)作为实现基因治疗策略的高效工具,具有宿主范围广、安全性高、免疫原性低、表达稳定等优点。针对不同组织和器官的靶向递送,开发了数十种不同血清型的rAAV,已被广泛地应用于基础研究和临床试验的基因治疗应用中。相对于往期介绍过的其他组织器官,针对膀胱和前列腺的AAV应用相对较少,本期我们聚焦于血清型、启动子及注射方式等方面结合文献案例和大家一起探讨前列腺和膀胱的靶向性递送策略。
一、血清型选择
rAAV的血清型由其基因组编码衣壳蛋白的Cap基因决定,AAV2是目前研究最深入、最广泛的AAV血清型。科研研究常用血清型是在AAV2的基础上改造而来,改造后的rAAV对不同的细胞或组织展现出不同的亲嗜性,根据实验需求选择合适的血清型对于实现高效的基因递送效果至关重要。针对膀胱的感染,汉恒生物推出了AAV-BLS血清型,可高效靶向膀胱,感兴趣的小伙伴可以通过《汉恒生物》公众号或官方技术服务热线400-092-0065申请试用。对于前列腺的靶向递送,四川大学艾建忠教授团队通过原位注射的方式,首次探索了12种不同血清型的rAAV转导前列腺的效率,结果表明rAAV6.2和rAAV7在转导整个前列腺(包括前端前列腺AP和背外侧前列腺DLP)方面优于其他血清型。在AP和DLP中能够转导65-80%的管腔细胞、基底细胞和间质细胞,其中管腔细胞和基底细胞被认为是前列腺癌的起源,而间质细胞则是良性前列腺增生的主要细胞类型。基于此,rAAV6.2和rAAV7可作为前列腺疾病预防及治疗中的理想基因递送工具[3]。
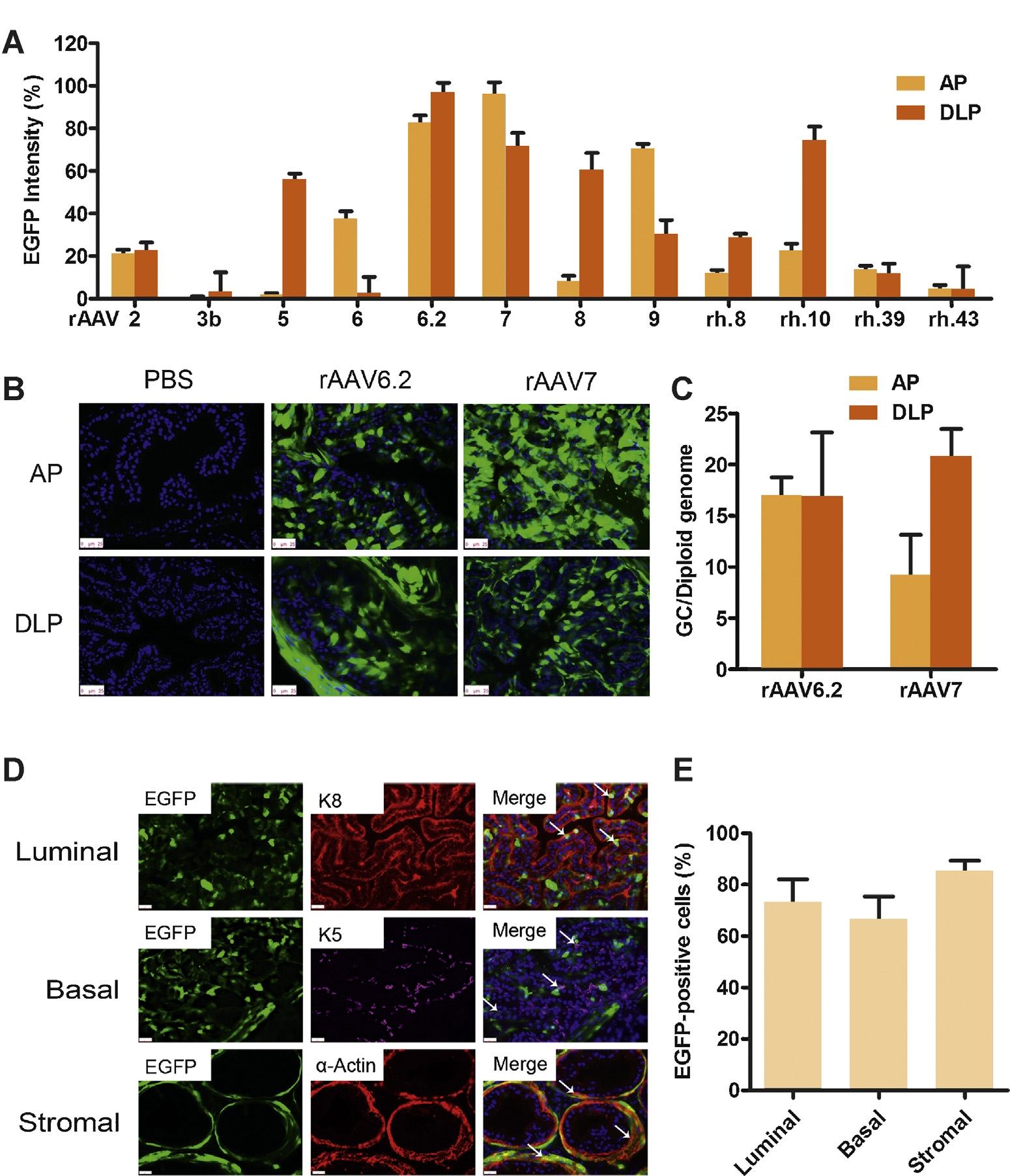
图4. 不同血清型在前列腺组织种的转导情况[3]
二、启动子的选择
基因治疗载体工具的选择,除了组织/器官靶向性的血清型外,不同类型细胞也可以通过载体携带相应的特异性启动子来实现靶基因特异性启动表达的效果。汉恒生物不仅可以提供广谱启动子,如CMV、EF1A等,还推出了靶向泌尿系统的特异性启动子,可帮助您构建高效、特异性靶向泌尿系统组织的rAAV载体。
1、膀胱上皮分化标志物UroplakinII(UPII)启动子
膀胱上皮分化标志物UroplakinII(UPII)被证明仅在膀胱组织源性细胞中表达,因此,UPII启动子被认为可作为膀胱特异性递送载体的有力元件。2020年,兰州大学王治平教授团队构建了携带UPII启动子的AAV9载体,在体内和体外分别测试了膀胱细胞感染的有效性和安全性。结果显示,该载体可以穿透膀胱细胞表面的糖胺聚糖(GAG)层,证实了UPII启动子针对膀胱细胞具有较好的特异性及启动能力[4]。
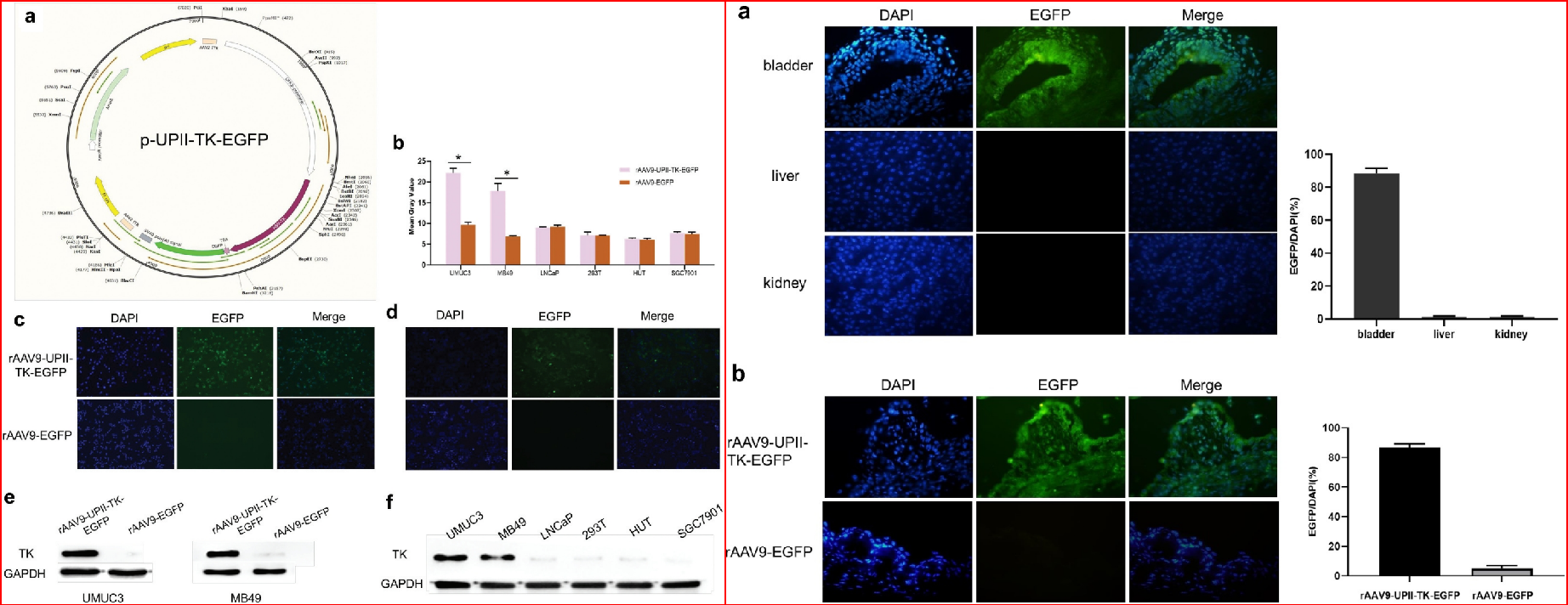
图5. AAV9-UPII在体内(左)、体外(右)转染膀胱和非膀胱细胞情况[4]
2、前列腺癌细胞标记物DD3启动子
前列腺癌细胞标记物DD3启动子在前列腺癌细胞的靶向递送中应用较多。2019年,天津医科大学第二医院牛远杰教授等人使用前列腺癌细胞标记物DD3启动子驱动目的基因在前列腺癌细胞中的特异性表达,有助于微小前列腺癌病变的可视化和定位,为前列腺癌的早期诊断及治疗提供了新的研究思路[5]。
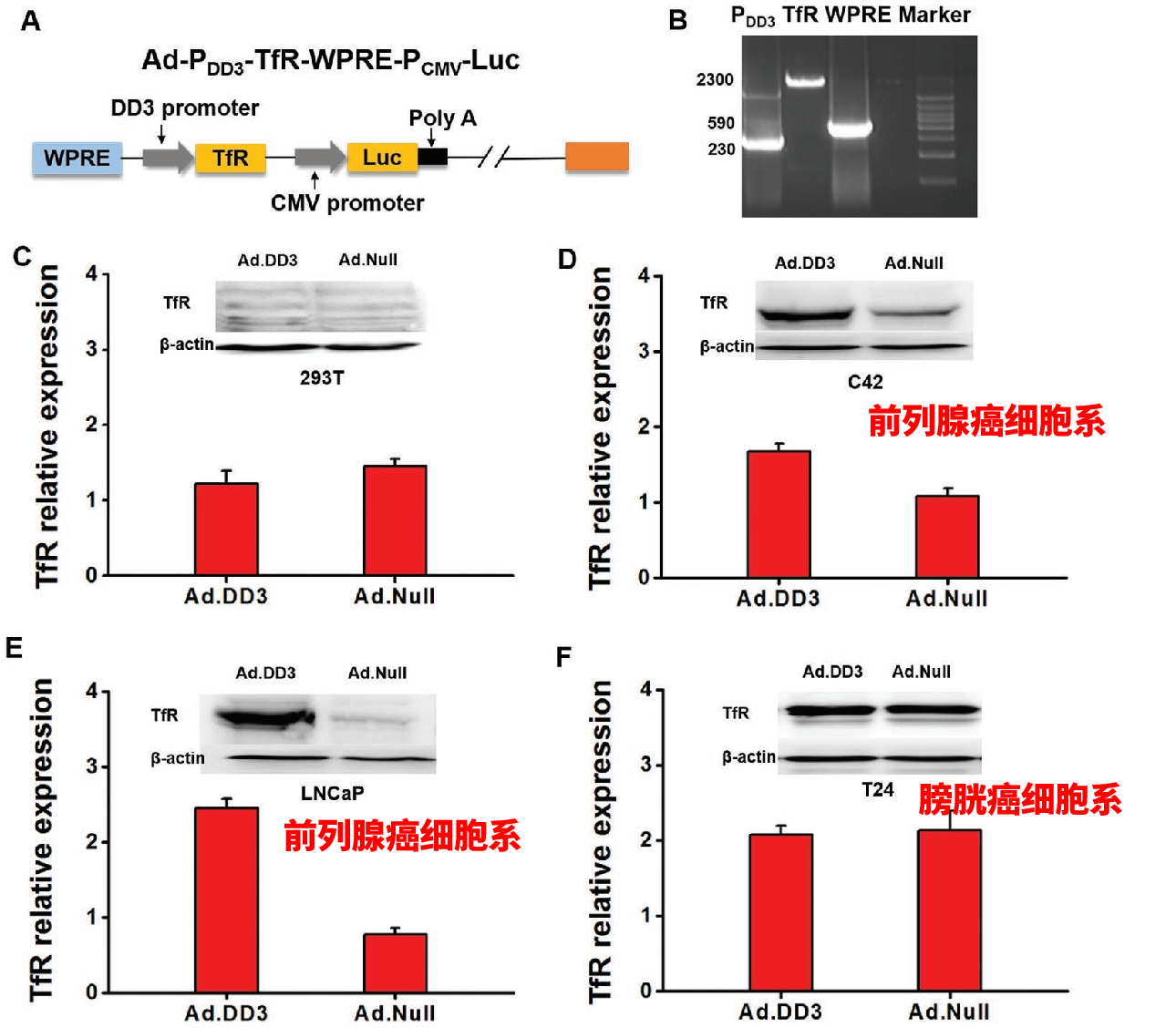
图6. DD3驱动的目的基因TfR在各类细胞中的表达情况[5]
三、感染方式
目前,AAV感染膀胱的主要方式有两种,分别为膀胱灌注和逼尿肌原位注射。而前列腺的感染方式一般为原位直接注射。具体注射方式和用量,建议老师们先进行预实验哦,选择最适合自己实验的AAV血清型、特异性启动子以及操作方式。
膀胱灌注:举例参考,准备8周龄大鼠(200-250g),使用异氟醚进行麻醉;膀胱导尿采用24号静脉导管通过尿道插入,排空膀胱,并用100 μL磷酸盐缓冲盐水(PBS)洗涤3次;在膀胱内灌注化合物(如盐酸溶液等,破坏膀胱管腔表面的GAG屏障)进行预处理,再用PBS冲洗膀胱3次;滴注AAV载体200μL左右;用尼龙绑住尿道,将AAV载体保留在膀胱内,4小时后释放[6, 7]。若不采用化合物进行预处理则需多次灌注。深圳大学刘宇辰团队在研究膀胱原位癌的肺转移模型中,未采取化合物预处理膀胱,连续使用AAV灌注了6周,1次/周(单次病毒量:2×1010vg),同样成功实现了相关基因的调控[8]。
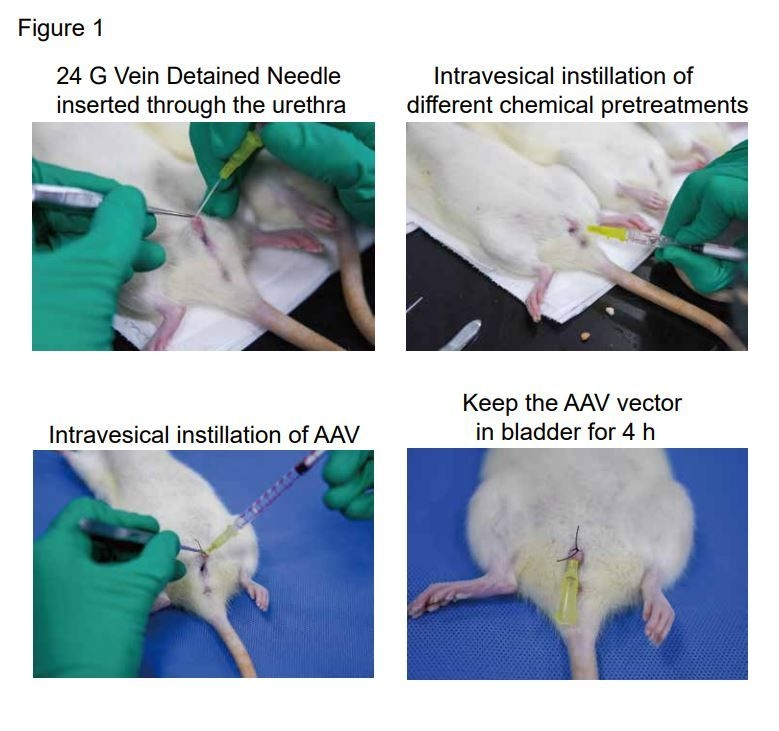
图7. AAV膀胱灌注流程示意图[6]
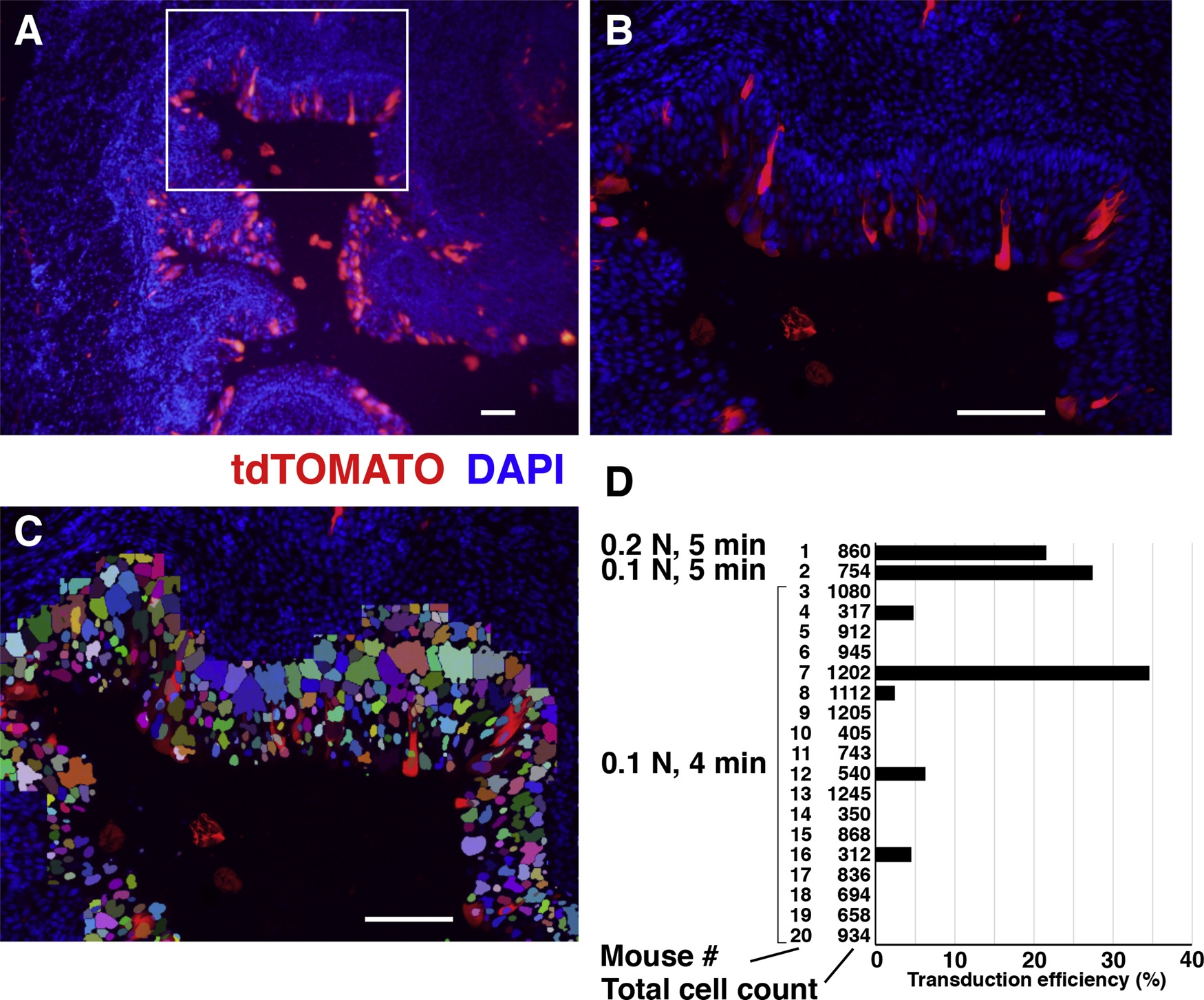
图8. AAV膀胱灌注感染效果[7]
逼尿肌原位注射:举例参考,9周龄雄性小鼠(C57BL/6J)吸入2%异氟醚进行麻醉,使用直肠探针偶联加热垫将体温维持在37 ℃;将腹腔区剃光并用聚维酮碘消毒,沿腹线行最小剖腹术以暴露膀胱;使用10 μL Hamilton注射器和33号针,分多点将30 ~ 50 μL病毒液注射至浆膜和逼尿肌层之间的区域(6-10个点,5 μL/点),以覆盖整个膀胱表面;注射病毒后,用6-0号丝线缝合切口,聚维酮碘消毒;术后大腿肌内给予抗生素和抗炎药;术后6周处死动物,取膀胱组织样品用于后续实验[9]。
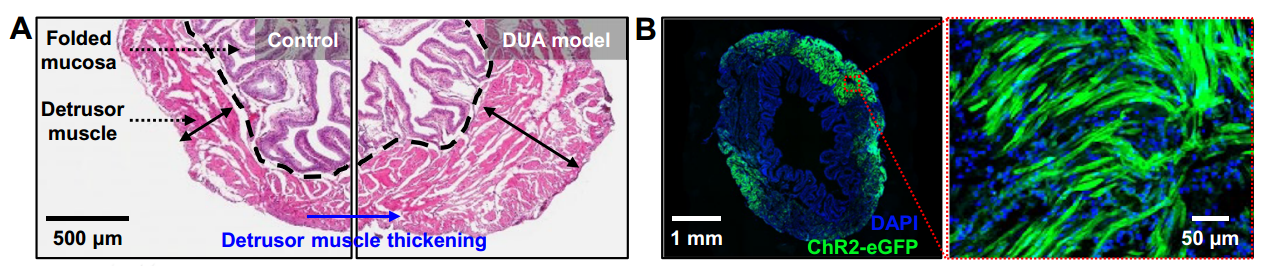
图9. 逼尿肌原位AAV注射膀胱感染效果[9]
前列腺原位注射:举例参考,将雄性小鼠置于含1-3%异氟烷氧的异氟烷室中麻醉,待完全麻醉,将动物从异氟烷室中取出,置于鼻锥装置,持续流1-2%异氟烷氧,确保动物在手术前处于完全麻醉状态,并用加热垫保持小鼠体温;在开始手术之前,用剃须或使用脱毛膏来去除老鼠身上的毛发;将小鼠置于仰卧位置,用10% w/w聚维酮碘溶液清洗下腹部,然后用70%乙醇拭子擦拭;用一把细钳,在包皮腺上方2 mm,阴茎鞘上方1-2 cm,胸腔底部下方2-3 cm处,做一个1 cm长的中线切口;确定膀胱及精囊位置,此时可观察到AP;将两个精囊依次取出体腔,面朝下置于腹部外表面,膀胱位于中间;用棉签轻轻向后倾斜靠近膀胱颈的插入点的精囊,朝向阴茎鞘,可清晰观察到DLP;在显微镜下将病毒注射至DLP;收回针头,用棉签轻轻按压注射部位并保持几秒钟以防止泄漏;将器官依次放回体腔,缝合切口;最后将小鼠放回干净的笼子里,放在加热灯或加热垫下,持续监测动物,直到动物完全从麻醉中恢复并保持胸骨平卧[10]。文献注射病毒剂量:40 μL,总量4×1010 vg[11];10 μL,总量1×1011 vg[12]。
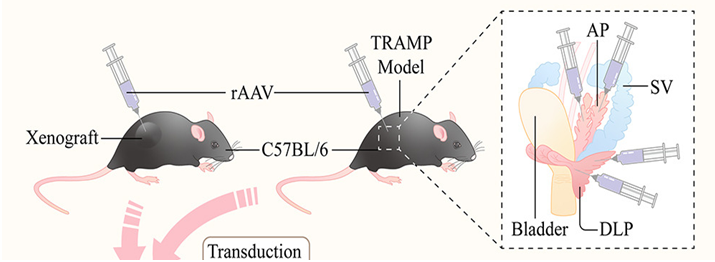
图10. 前列腺原位注射AAV示意图[11]
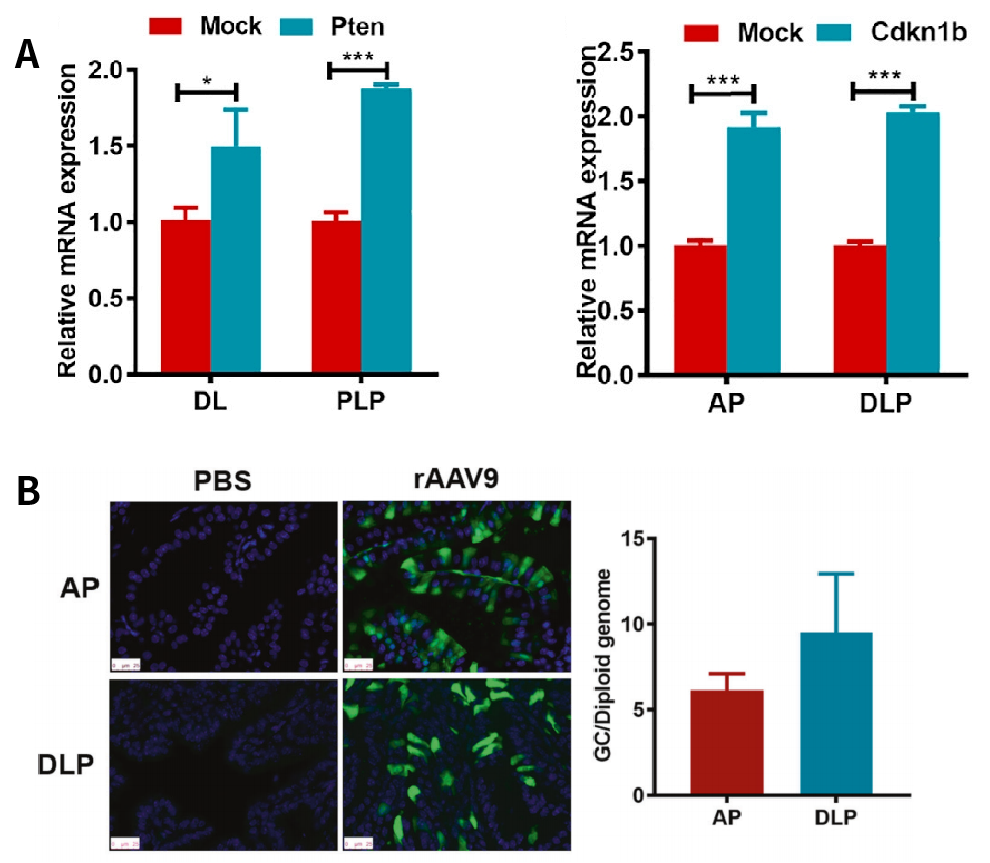
图11. 前列腺原位注射AAV(过表达Cdkn1b和Pten)表达效果:A[11],B[12]
除了AAV,腺病毒(Adenovirus,Ad)也被证明可以通过原位注射在前列腺中实现高效转导,文献注射剂量为3.2×1010 GC/小鼠[13]。
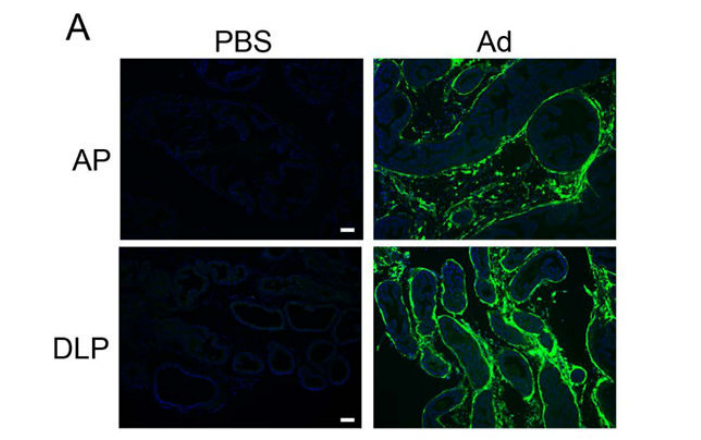
图12. Ad在前列腺组织中的转导效果[13]
本期干货内容主要为大家介绍了靶向膀胱和前列腺的AAV血清型/启动子的选择以及病毒的注射方法,供大家参考。汉恒生物可定制靶向膀胱和前列腺的病毒,除此之外还研发了靶向神经、肌肉、肾脏、肝脏、视网膜等组织器官的AAV特异性启动子和特异性血清型,欢迎各位老师同学来电咨询,热线:400-092-0065。本期内容到这里就结束了,下期我们将会继续分享皮肤的特异性基因调控策略,敬请关注。
参考文献:
[1] Berdik C. Unlocking bladder cancer. Nature. 2017;551(7679):S34-S35.
[2] Prostate cancer. Nat Rev Dis Primers. 2021;7(1):8.
[3] Ai J, Wang D, Wei Q, Li H, Gao G. Adeno-associated Virus Serotype Vectors Efficiently Transduce Normal Prostate Tissue and Prostate Cancer Cells. Eur Urol. 2016;69(1):179-181.
[4] Lian F, Ye Q, Feng B, et al. rAAV9-UPII-TK-EGFP can precisely transduce a suicide gene and inhibit the growth of bladder tumors. Cancer Biol Ther. 2020;21(12):1171-1178.
[5] Zhao Y, Peng J, Yang J, et al. Enhancing Prostate-Cancer-Specific MRI by Genetic Amplified Nanoparticle Tumor Homing. Adv Mater. 2019;31(30):e1900928.
[6] Yanyuan Wu, Jiatong Zhou, Haojie Chen et al. Optimized Pretreatment Method for Long-Term Transduction Efficiency of AAV Into Rat Bladder, 02 March 2022, PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-1360426/v1].
[7] Hamada A, Kita Y, Murakami K, et al. Enhancement of transduction efficiency using Adeno-associated viral vectors by chemical pretreatment to mice bladder urothelium. J Virol Methods. 2020;279:113854.
[8] Liu Y, Huang W, Cai Z. Synthesizing AND gate minigene circuits based on CRISPReader for identification of bladder cancer cells. Nat Commun. 2020;11(1):5486.
[9] Jang TM, Lee JH, Zhou H, et al. Expandable and implantable bioelectronic complex for analyzing and regulating real-time activity of the urinary bladder. Sci Adv. 2020;6(46):eabc9675.
[10] Shahryari V, Nip H, Saini S, et al. Pre-clinical Orthotopic Murine Model of Human Prostate Cancer. J Vis Exp. 2016;(114):54125.
[11] Ai J, Li J, Su Q, et al. rAAV-delivered PTEN therapeutics for prostate cancer. Mol Ther Nucleic Acids. 2021;27:122-132.
[12] Ai J, Li J, Su Q, et al. rAAV-based and intraprostatically delivered miR-34a therapeutics for efficient inhibition of prostate cancer progression. Gene Ther. 2022;29(7-8):418-424.
[13] Ai J, Tai PWL, Lu Y, et al. Characterization of adenoviral transduction profile in prostate cancer cells and normal prostate tissue. Prostate. 2017;77(12):1265-1270.

查看更多

查看更多

查看更多

联系我们

返回顶部