查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
恶性肿瘤是严重威胁人类健康的重大疾病,现已成为中国最常见的死亡原因之一。目前除传统的手术、放疗和化疗外,还建立了一系列肿瘤治疗新方法,如生物治疗、免疫治疗、物理治疗(热、光、磁、电、超声)和动力学治疗等,并且研究发现肿瘤协同治疗效果明显优于单种治疗。
浙江省人民医院临床医学研究所牟晓州/蔡宇课题组于2023年6月26日在《Chemical Engineering Journal》(IF:16.744)发表了一篇题为“Camouflaging multifunctional nanoparticles with bacterial outer membrane for augmented chemodynamic/photothermal/starvation/chemo multimodal synergistic therapy of orthotopic glioblastoma”的文章。研究中作者构建了一种无脂多糖细菌外膜囊(lipopolysaccharide-free bacterial outer membrane vesicles, dOMV)纳米治疗平台,整合化学动力疗法(Chemodynamic therapy, CDT)、光热疗法(photothermal therapy, PTT)、饥饿治疗和化疗四种治疗方式,以协同治疗胶质母细胞瘤(Glioblastoma multiforme, GBM)。值得注意的是,本研究使用了汉恒生物提供的携带Luc的慢病毒。
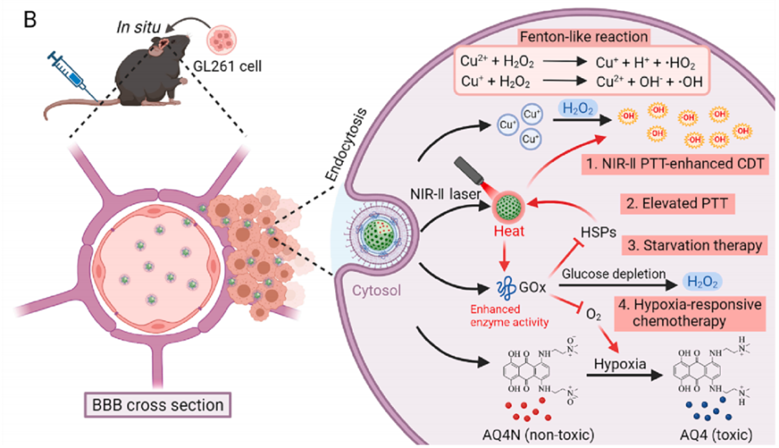
图1 AG@Cu9S8@dOMV穿过血脑屏障到达脑瘤部位的协同治疗机制
让我们一起来看看具体的研究成果吧。
首先,作者以Cu2O为模板,通过原位硫化法制备Cu9S8,,空心Cu9S8的比表面积为42.86 m2/g,具有良好的载药能力,将AQ4N装载到Cu9S8的空腔中,记为A@Cu9S8,利用两亲性的DSPE-PEG2000-COOH分子在Cu9S8表面包裹药物,堵塞孔隙;然后,通过NHS偶联将GOx连接到A@Cu9S8表面,AQ4N/GOx@Cu9S8(记为AG@Cu9S8)上GOx的附着量约为12μg/mg;最后dOMV包被AG@Cu9S8,制得最终产物,记为AG@Cu9S8@dOMV。
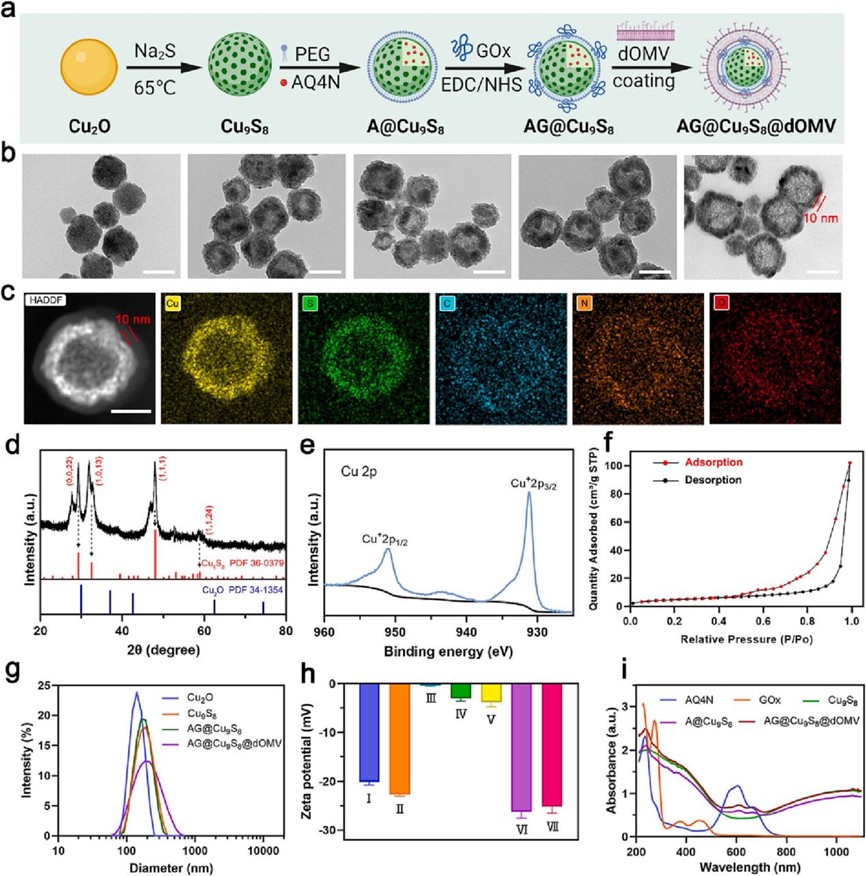
图2 AG@Cu9S8@dOMV的制备与表征
接下来,作者在体外对AG@Cu9S8@dOMV进行了各种活性验证。
Gox能介导葡萄糖氧化,随后通过Cu+引起Fenton样反应生成•OH自由基,并且其酶活在45℃~60℃之间随温度的升高而升高,恰好与PTT的应用温度吻合,为光热强化饥饿治疗提供了依据。研究结果表明AG@Cu9S8@dOMV能在高浓度葡萄糖的诱导下导致H2O2的生成和pH的下降,与对照恒温25℃相比,在1064 nm激光(恒温45℃)照射和有葡萄糖的情况下,AG@Cu9S8@dOMV产生了更多的•OH自由基,这说明光热能引起GOx诱导葡萄糖氧化的级联反应,增强CDT的作用。
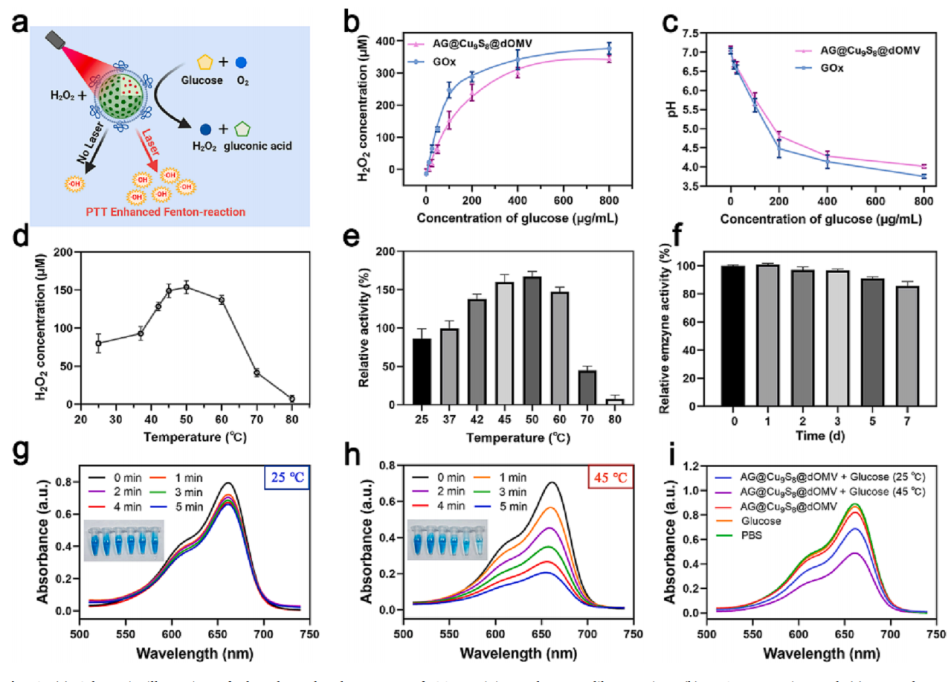
图3 AG@Cu9S8@dOMV通过光热效应和GOx介导的H2O2增强CDT
随后的研究发现,当pH为7.4(正常生理条件下)时,AQ4N未出现爆发释放,而GOx催化葡萄糖生成葡萄糖酸,降低环境pH至5.0时,AQ4N的释放量迅速提高到59%。所以纳米颗粒的pH响应特性可以防止AQ4N在正常组织中过早释放,从而大大降低全身毒性,提高抗肿瘤疗效。
另外,在激光照射(温度平衡为45℃)下,AQ4N的分子运动速度明显加快,30 min内AQ4N的释放量可达到40.9%,即光热效应能增强药物释放;不仅如此,1064 nm激光照射AG@Cu9S8@dOMV(100µg/mL)溶液,溶液的温度随着激光功率的增加而升高,当功率不变时,即使在较低浓度(25µg/mL)下,溶液的温度也能在10 min内升高到47.4℃,足以杀死肿瘤细胞。

图4 AG@Cu9S8@dOMV的光热性能以及pH和光热对药物释放的促进作用
Gox通过消耗氧气来营造缺氧环境,产生H2O2增加氧化应激,通过荧光检测dOMV在NPs内化中的作用发现,与GOx处理组相比,AG@Cu9S8@dOMV处理组的细胞表现出更强的绿色(氧化应激探针)和红色荧光(缺氧探针),说明dOMV使得AG@Cu9S8@dOMV能够有效被内化到细胞内启动应答。
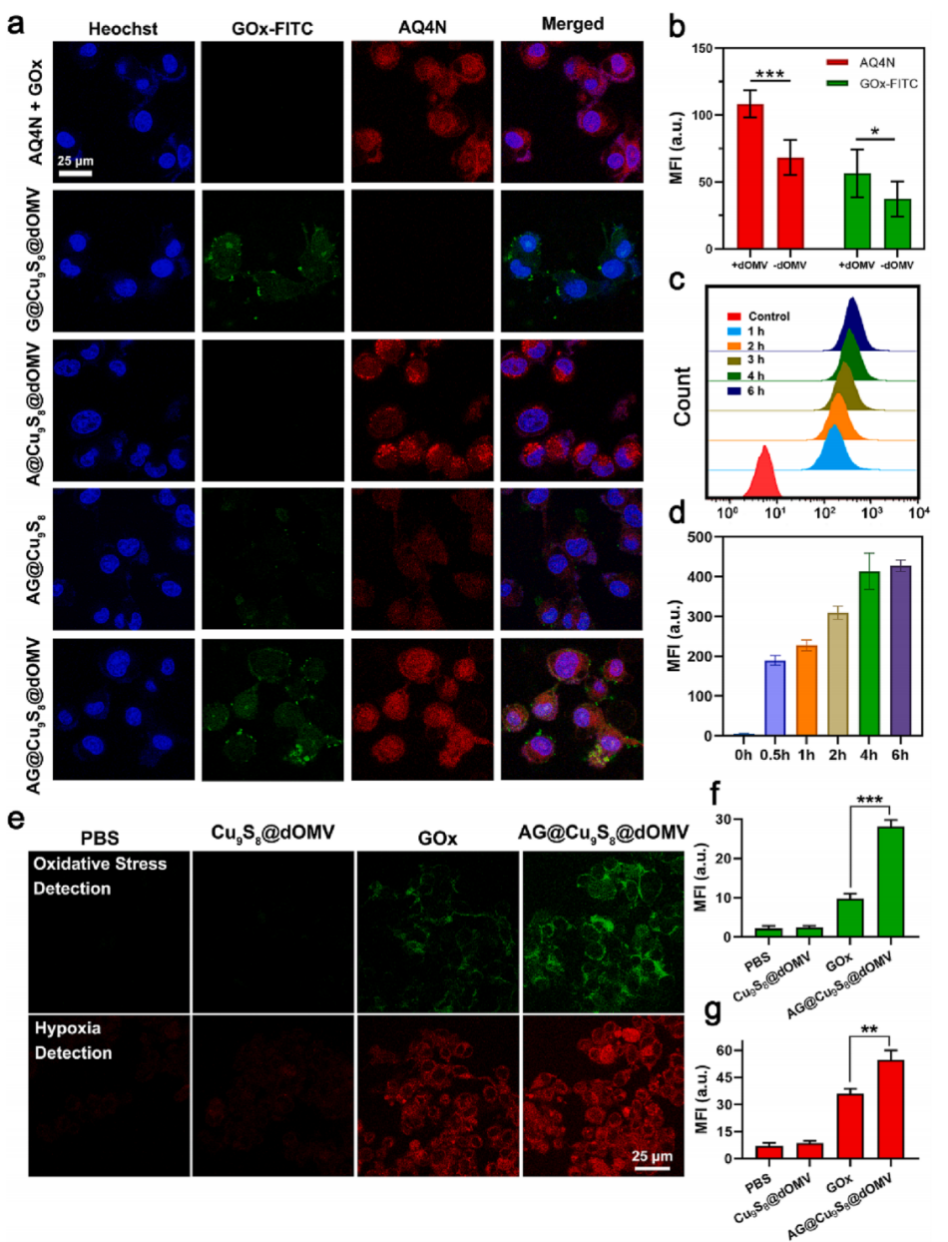
图5 AG@Cu9S8@dOMV的细胞摄取
AG@Cu9S8@ dOMV主要是为了进入脑部发挥抗肿瘤功效,所以它的血脑屏障穿越能力和细胞毒性也是重要的检测指标。利用Transwell构建体外血脑屏障模型,AG@Cu9S8@ dOMV处理的细胞平均荧光强度(MFI)比对照高约6.67倍,说明dOMV有助于NPs穿透血脑屏障到达肿瘤部位进行治疗。AG@Cu9S8@dOMV作为级联传递系统,被其处理过的细胞活力低至21.3%,NIR-II激光照射后,细胞存活率继续下降到7.1%,凋亡实验也表明AG@Cu9S8@dOMV + 激光照射处理的细胞晚期凋亡率最高,说明AG@Cu9S8@dOMV通过饥饿、化疗、PTT和CDT联合治疗对肿瘤细胞有明显的杀伤效果。
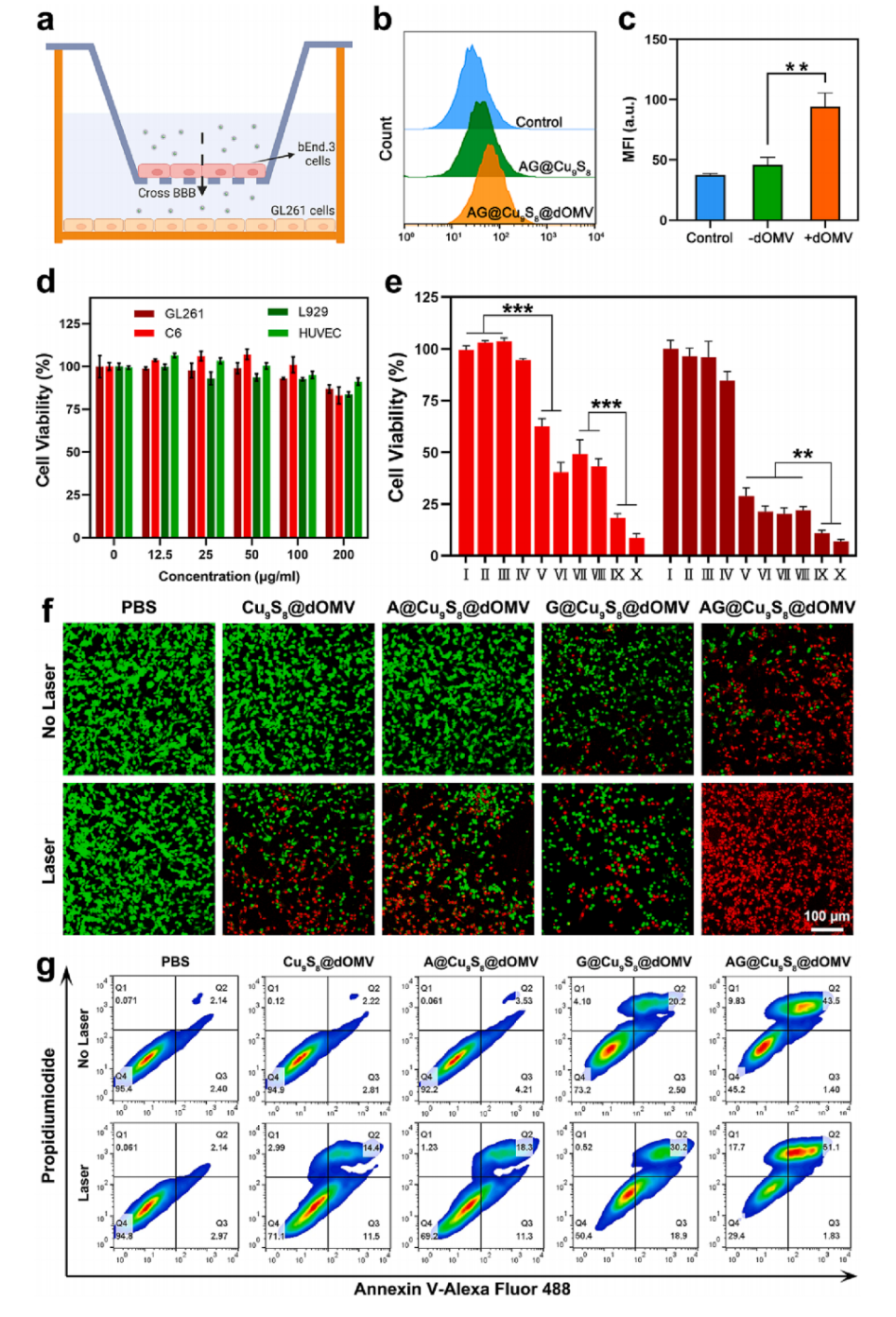
图6 AG@Cu9S8@dOMV的细胞毒性
肿瘤耐热性主要是由于细胞在热刺激下会上调热休克蛋白的表达,抵抗高温对肿瘤细胞的损伤,实验数据也表明42℃或激光处理的细胞中热休克蛋白高表达。但热休克蛋白的表达依赖于ATP的能量供应,AG@Cu9S8@dOMV + 激光照射后细胞ATP水平极显著降低,与此同时,检测到HSP70的相对表达水平显著降低,为对照组的0.44倍。说明激光照射下通过光热效应增强GOx活性,进一步强化葡萄糖的消耗,降低细胞内ATP水平,下调HSP表达,使PTT作用下肿瘤细胞的自我保护机制失效。
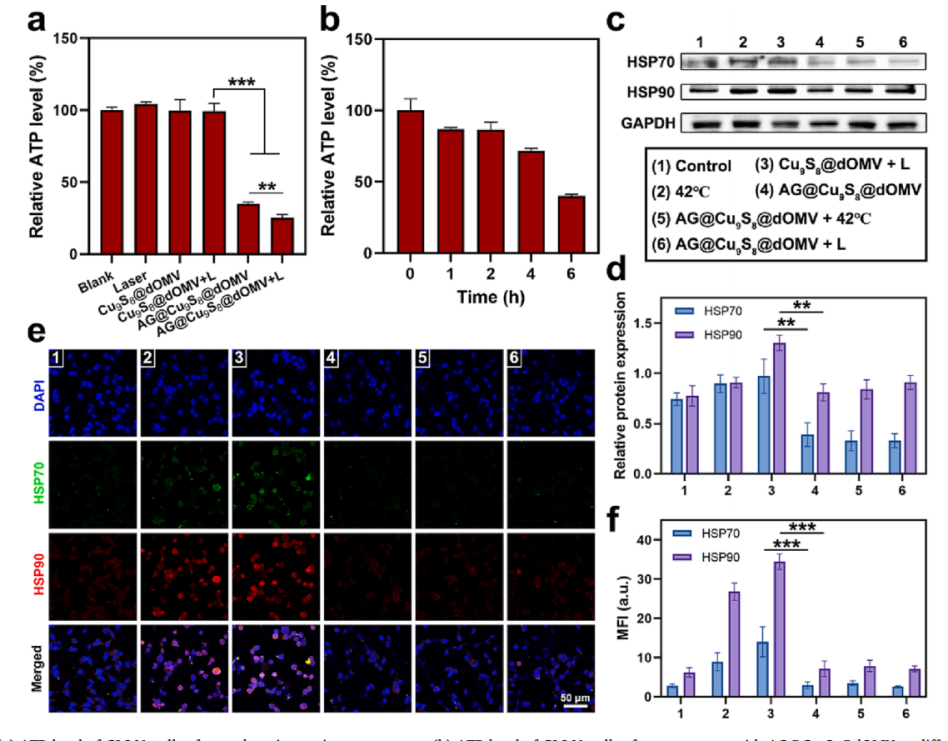
最后进行的体内抗肿瘤实验中,一方面,AG@Cu9S8@dOMV处理组肿瘤部位的荧光信号随着时间的推移逐渐增强,并表现出长期的肿瘤滞留。由于在肿瘤中积累较好,AG@Cu9S8@dOMV +激光照射后,肿瘤区域温度迅速升高,保持在48.2℃,可导致肿瘤热消融,大大提高AG@Cu9S8@dOMV的治疗效果。
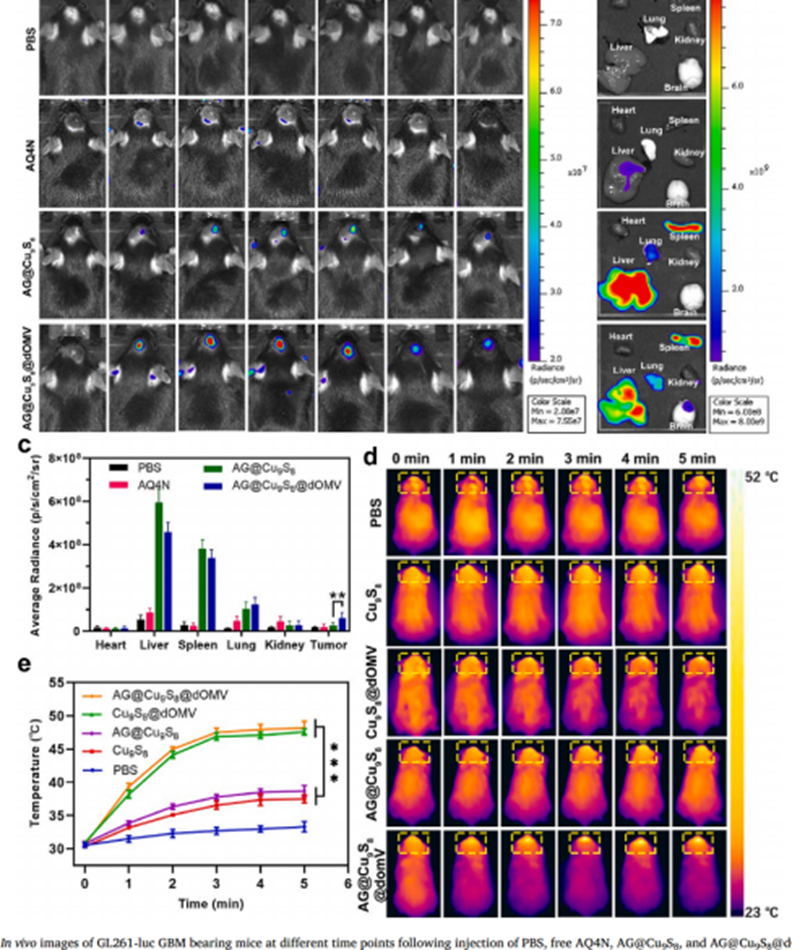
图8 AG@Cu9S8@dOMV的体内生物分布和光热转化能力
另一方面,将携带荧光素酶报告基因的慢病毒(购自于汉恒生物)转染GL261细胞,获得GL261-Luc细胞,小鼠右侧纹状体注射GL261-Luc细胞以建立原位胶质瘤模型,采用活体荧光成像系统间接监测脑肿瘤的生长情况。结果表明单一疗法对肿瘤抑制作用都非常有限,但AG@Cu9S8@dOMV联合NIR-II激光照射在整个治疗期间几乎能完全抑制肿瘤生长,小鼠的体重在治疗过程中变化也可以忽略不计,与对照相比,AG@Cu9S8@dOMV+激光照射处理组小鼠仍保持较高的活性。同时也观察到肿瘤破坏严重,细胞相对疏松,肿瘤组织中凋亡细胞分布广泛,HSP表达下调,综合治疗结果和各方面指标,AG@Cu9S8@dOMV联合NIR-II激光照射组小鼠有望获得更高的存活率,这表明联合治疗具有低系统毒性和有效的治疗效果。对AG@Cu9S8@dOM的毒性和安全性进评估,体内外实验都表明AG@Cu9S8@dOMV NPs具有低毒性和高生物相容性,几乎没有溶血作用,作为一种体内给药策略和治疗剂,AG@Cu9S8@dOMV具有出色的生物安全性。
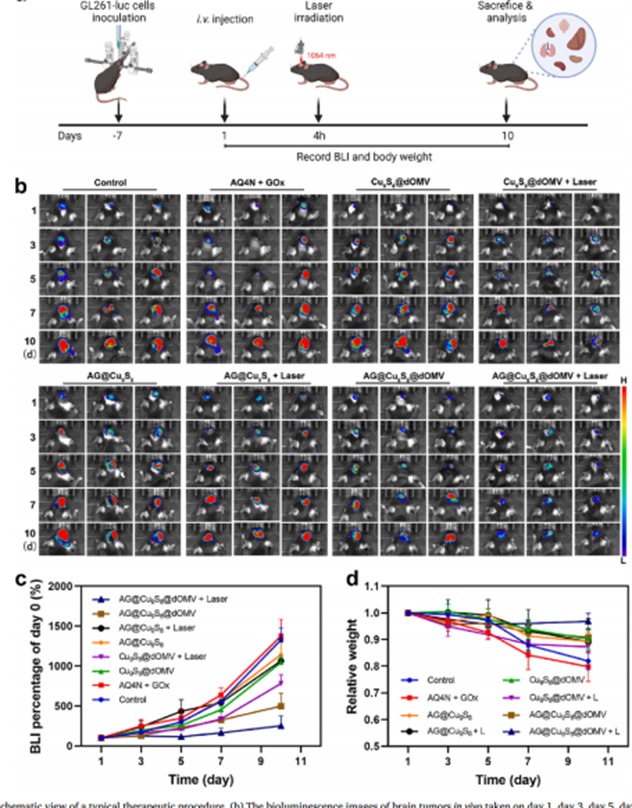
图9 脑肿瘤生长情况
综上所述,AG@Cu9S8@dOMV NPs具有优异的血脑屏障穿透能力和免疫逃逸能力,能主动靶向肿瘤、杀伤肿瘤,取得较高的抗肿瘤效果。AG@Cu9S8@dOMV NPs有望成为一种具有血脑屏障穿透性的多模态肿瘤治疗纳米药物配方,为多模态肿瘤治疗提供了良好的范例。

查看更多

查看更多

查看更多

联系我们

返回顶部