查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
血管平滑肌细胞(Vascular smooth muscle cell,VSMC)由收缩型向增生型转变是心血管疾病发生和发展过程中血管重构的基本病理生理改变。RNA修饰是调节基因表达的必要条件,N-乙酰基转移酶10 (N-acetyltransferase 10, NAT10)能够对mRNA进行N4-乙酰胞嘧啶(N4-acetylcytidine, ac4C)修饰,参与多种生理和病理过程,但在血管重构的生物学功能和潜在的调节机制方面仍不清楚。

2024年10月25日,陆军军医大学陆军特色医学中心、老年心脑血管病教育部重点实验室曾春雨教授、余骏逸副教授和福建医科大学附属协和医院陈良龙教授团队在European Heart Journal上发表了题为“NAT10 Promotes Vascular Remodeling via ac4C mRNA Acetylation”的论文。该研究通过体外和体内血管损伤模型,发现了NAT10和ac4C修饰在损伤后上调,VSMC中NAT10的缺失减少了损伤后新生内膜的形成和VSMC表型转换;多组学联合分析显示NAT10通过对靶基因mRNA 的ac4C修饰,增强mRNA的稳定性及其下游的FAK(focal adhesion kinase)信号通路,进而影响VSMC的增殖和血管重构;而NAT10抑制剂remodelin能有效地阻止新生内膜的形成。汉恒生物有幸为作者提供了AD-shRNA-NAT10腺病毒以实现体内和体外的NAT10基因敲低,以及体内NAT10过表达腺病毒AD-NAT10。下面,我们一起来了解具体的研究内容。
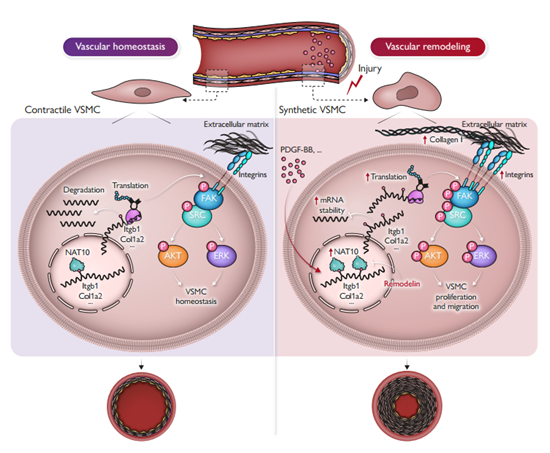
NAT10在VSMC表型转换相关的血管重构过程中表达上调
为了探究NAT10是否参与VSMC表型转换相关的血管重构,作者检测了临床样本以及不同体内、外VSMC表型转换模型中NAT10的表达。与接受冠状动脉搭桥术患者的冠状动脉对照相比,接受心脏移植患者的动脉粥样硬化冠状动脉的VSMC核中NAT10表达上调;在大鼠颈动脉球囊损伤和小鼠颈动脉导丝损伤模型中,NAT10也上调表达,并且NAT10在球囊损伤3天后上调,表明NAT10在应激反应的VSMC表型转换过程中呈正相关。与体内结果一致,在PDGF-BB(血小板衍生生长因子)刺激的大鼠原代主动脉VSMC中,NAT10的表达也以剂量依赖性和时间依赖性的方式上调。总的来说,NAT10可能参与了VSMC表型转换相关的血管重构的发展。
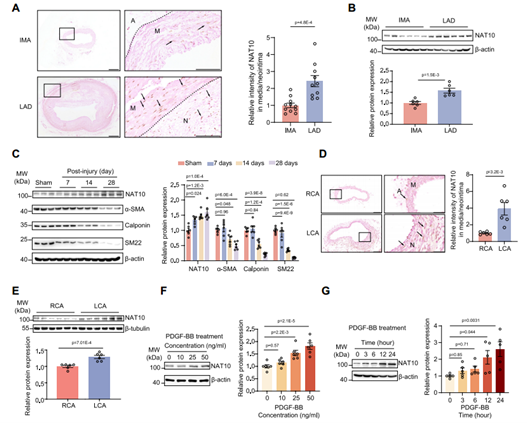
图1 NAT10在血管重构过程中表达增加
NAT10在体内诱导VSMC表型转换
为了进一步明确NAT10在体内VSMC表型转换和血管重构中的功能,基于Cre/Loxp系统构建了VSMC特异性NAT10敲除小鼠NAT10VSMC-/-。检测发现NAT10VSMC−/−小鼠胸主动脉和颈动脉中间层的NAT10显著降低,表明VSMC特异性敲除小鼠构建成功。通过小鼠颈动脉导丝损伤体内诱导VSMC表型转换,在NAT10-loxP小鼠中观察到全身ac4C修饰水平增加,而NAT10 KO小鼠颈动脉组织中ac4C修饰水平显著降低;与对照小鼠相比,NAT10VSMC−/−小鼠的新生内膜形成更少,VSMC收缩标记蛋白(包括α-SMA、Calponin和SM22)的表达在导丝损伤后明显升高,动脉损伤诱导的VSMC增殖也少于对照小鼠。
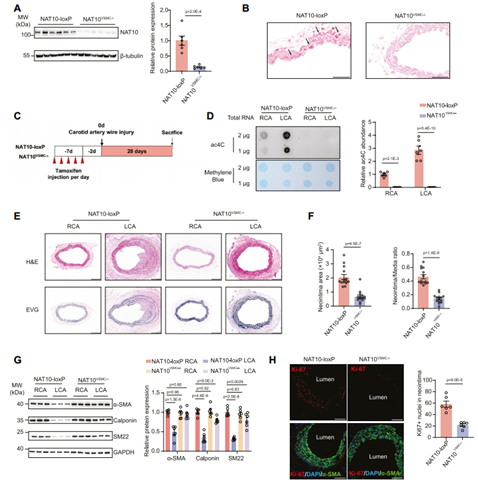
图2 VSMC特异性NAT10基因敲除减弱导丝损伤诱导的新生内膜形成和VSMC表型转换
在大鼠颈动脉球囊损伤模型中也检测了NAT10在VSMC表型转换中的作用。将NAT10干扰腺病毒(AdNat10-shRNA)或过表达腺病毒(AdNat10)递送到SD大鼠颈动脉,与感染对照腺病毒的大鼠相比,Nat10 shRNA抑制了新生内膜的形成,并伴有VSMC增殖减少;相反,Nat10过表达加剧了球囊损伤诱导的新生内膜形成,并增加了VSMC的增殖。两种模型的实验结果表明,NAT10是血管重构过程中VSMC表型转换所必需的。
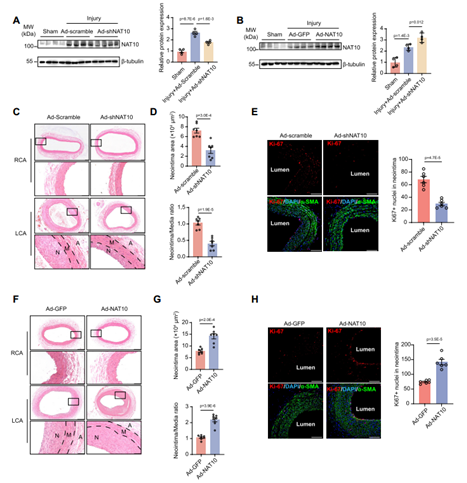
图3 NAT10在大鼠颈动脉球囊损伤诱导的VSMC表型转换和新内膜形成中是必要且充分的
NAT10是体外诱导VSMC表型转换的必要且充分条件
利用大鼠原代主动脉VSMC,在体外研究NAT10对VSMC表型转换的作用。用AdNat10-shRNA敲低VSMC中NAT10的表达,发现NAT10的沉默显著增加了VSMC收缩标记基因的表达,并抑制细胞增殖、迁移和细胞黏附。相反,通过慢病毒过表达NAT10,会显著降低VSMC收缩标记蛋白的表达,增加VSMC的增殖、迁移和细胞黏附。这些数据表明,NAT10是诱导VSMC表型转换的充要条件。
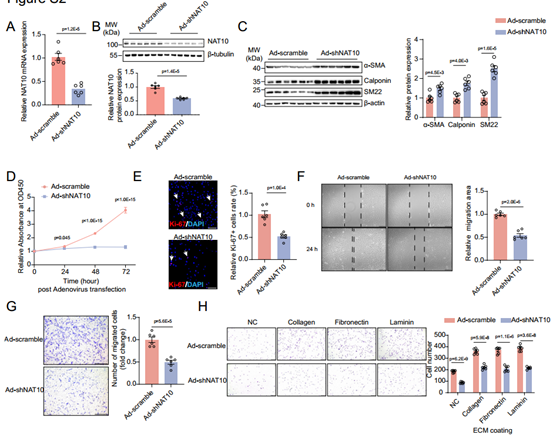
图4 NAT10敲低减少体外VSMC表型转换
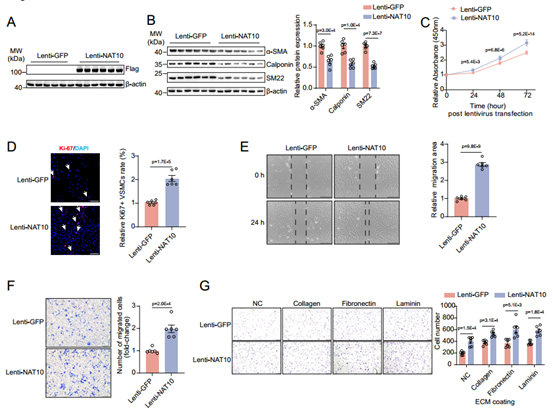
图5 NAT10过表达诱导体外VSMC表型转换
NAT10通过mRNA的ac4C修饰促进VSMC表型转换
NAT10是一种乙酰转移酶,可使RNA乙酰化。通过斑点实验和LC-MS/MS,作者在PDGF-BB刺激的大鼠VSMC、人动脉粥样硬化冠状动脉以及大鼠球囊损伤模型的受损颈动脉中均检测到ac4C修饰水平显著上调。在对照冠状动脉和动脉粥样硬化冠状动脉的临床样本中,内膜中层厚度与ac4C修饰水平呈正相关。为了阐明NAT10在新生内膜形成中的生物学功能是否依赖于其乙酰转移酶活性,作者构建了失去乙酰转移酶活性的NAT10突变质粒Flag-NAT10 G641E。与野生型NAT10(WT NAT10)相比,Flag-NAT10 G641E过表达既没有降低VSMC收缩标记蛋白的表达,也没有诱导VSMC增殖或迁移。
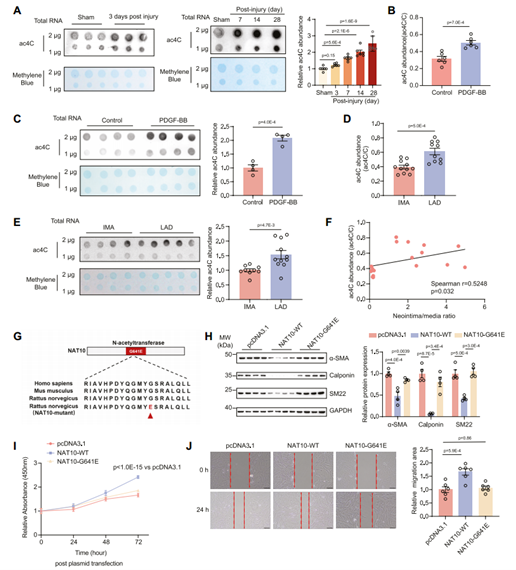
图6 NAT10通过mRNA ac4C修饰促进新生内膜形成
接着,作者在人动脉平滑肌细胞(HASMCs)中探索NAT10介导的ac4C修饰在VSMC表型调节中的功能保守性,结果显示NAT10敲低显著降低了HASMCs中mRNA的ac4C修饰水平。WT NAT10过表达增加了HASMCs中mRNA的ac4C修饰水平,而NAT10 G641E过表达没有相似的结果。这说明与啮齿类动物一致,WT NAT10介导的ac4C修饰在VSMC表型转换中具有保守功能。上述结果表明,NAT10通过RNA ac4C修饰调节VSMC表型转换。
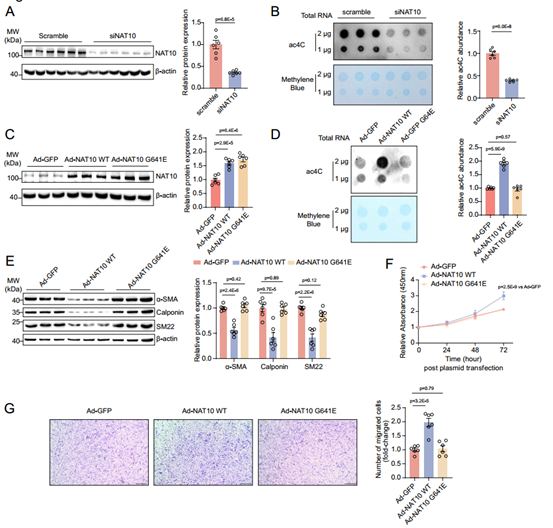
图7 NAT10介导HASMC的ac4C修饰
VSMC中受NAT10调控的ac4C修饰mRNA的鉴定
考虑到ac4C修饰可以促进mRNA的稳定性和翻译效率,作者使用腺病毒敲低VSMC中NAT10后进行了转录组测序(RNA-seq)。NAT10沉默导致647个基因上调,760个基因下调。GO分析显示,这些差异表达基因的生物学功能与细胞周期、细胞外结构/基质组织和肌肉细胞分化有关;KEGG通路分析也显示,在VSMCs NAT10敲低后,平滑肌收缩、细胞外基质组织和细胞粘附通路显著改变。
为进一步确定被NAT10乙酰化的下游mRNA,进行了ac4C免疫共沉淀测序(acRIP-seq)。典型的“CXX”基序表明acRIP-seq结果可信。火山图显示,NAT10敲低后,ac4C修饰水平发生显著变化的基因中,高乙酰化基因有705个,低乙酰化基因有897个。将acRIP-seq测序得到的低乙酰化mRNA与NAT10敲低后RNA-seq鉴定到的下调mRNA交叉,筛选NAT10调控的ac4C靶点,得到75个候选mRNA。GO分析表明,这75个基因在VSMC表型转换和血管重构的关键生物学过程中富集,表明NAT10介导的mRNA ac4C修饰在血管重构相关的转录调节中起关键作用。
接着作者利用NAT10-RNA免疫沉淀测序(NAT10-RIP-seq)来阐明NAT10 ac4C修饰在大鼠主动脉VSMCs中的作用。结果显示,NAT10结合位点广泛分布在转录组中,大多数位于CDS中;基序分析表明,“CXX”在NAT10结合序列中显著富集,说明NAT10通过直接结合mRNA正向调节ac4C修饰。对与NAT10相互作用的mRNA进行GO分析,发现它们参与了VSMC表型转换相关的血管重构的关键生物学过程。通过多组学联合分析,进一步缩小NAT10的靶mRNA范围,发现10个与NAT10结合的低乙酰化mRNA(Itgb1、Nuak1、Myh9l1、Actn1、Tln1、Col1a2、Col11a1、Utrn、Tep1和Pygl),在NAT10敲低后表达下调,其中有6个基因(Itgb1、Myh9l1、Actn1、Tln1、Col1a2和Pygl)被报道参与VSMC表型转换。这些结果说明了NAT10介导的ac4C修饰在血管重构中具有重要作用。
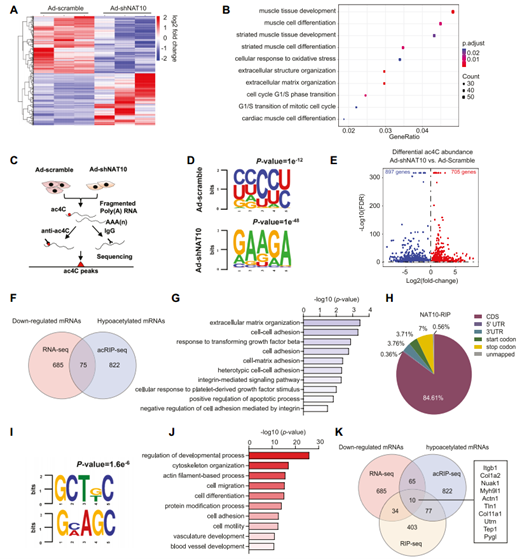
图8 VSMC中受NAT10 ac4C修饰调控的mRNA鉴定
NAT10催化ac4C修饰下游靶mRNA,以增加稳定性
已有报道NAT10介导的ac4C修饰可以增强mRNA的稳定性,在富集到的10个潜在下游靶基因中,ITGB1和Col1a2在血管重构中发挥重要作用。以这两个蛋白为例,深入研究NAT10如何通过调控下游靶mRNA的ac4C修饰进而调控VSMC表型转换。acRIP和qPCR鉴定到敲低NAT10降低了ITGB1和Col1a2 mRNA上的ac4C修饰丰度,mRNA和蛋白质的表达也有所下降;NAT10过表达增加了ITGB1和Col1a2在mRNA和蛋白质水平上的表达;而过表达NAT10 G641E突变体则不能引起的ITGB1和Col1a2表达上调。利用放线菌素D检测RNA稳定性,实验结果显示,敲低NAT10降低了ITGB1和Col1a2 mRNA的稳定性,而过表达NAT10能增加它们的稳定性,进而增加蛋白质水平。这些结果说明NAT10通过催化下游靶mRNA的ac4C修饰,增加稳定性,以提高下游基因的表达。
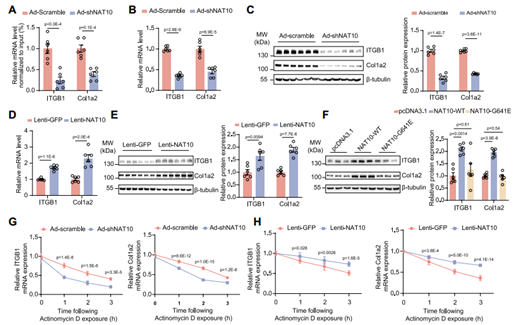
图9 NAT10催化ITGB1和Col1a2 mRNA的ac4C修饰以提高表达
ITGB1是NAT10调控的VSMC表型转换和血管重构所必需的
接下来,作者以ITGB1为主,更深入地阐述NAT10介导的mRNA ac4C修饰在调节VSMC表型转换相关的血管重构中的机制。作者利用VSMC特异性ITGB1过表达腺相关病毒(AAV-ITGB1)感染小鼠颈动脉,可逆转NAT10VSMC-/-小鼠对血管内膜新生的抑制作用。先前的研究表明,ITGB1通过FAK通路对VMSC表型发挥调节作用,因此作者检测了VSMCs中NAT10过表达后下游FAK、类固醇受体共激活因子(SRC)、丝氨酸-苏氨酸蛋白激酶(AKT)和细胞外信号调节激酶(ERK)的磷酸化变化,观察到PDGF-BB刺激可以显著激活FAK通路;敲低ITGB1可减弱NAT10过表达诱导的VSMC增殖和迁移,而ITGB1过表达挽救了NAT10敲低导致的VSMC粘着斑形成减少,表明ITGB1是NAT10调控的VSMC表型转换所必需的。上述数据说明NAT10提高了VSMC表型调节基因mRNA的稳定性,促进VSMC表型转换和血管重构。
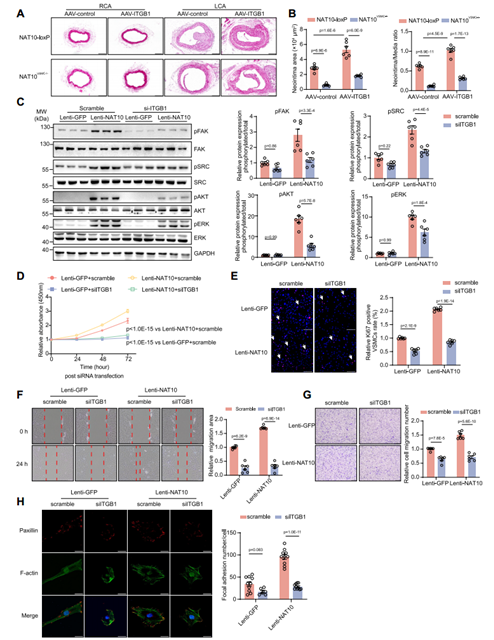
图10 NAT10/ITGB1/FAK信号调节VSMC表型转换和新生内膜形成
Remodelin靶向NAT10具有潜在的预防和治疗作用
考虑到NAT10是VSMC表型转换所必需的,作者探索了NAT10是否可以作为血管重构的潜在预防和治疗靶点。Remodelin是一种选择性的NAT10乙酰转移酶活性抑制剂,已被证明适用于体内研究。首先,为了测试抑制NAT10的预防功能,在小鼠颈动脉导丝损伤前1小时腹腔注射remodelin,损伤28天后处死小鼠,发现mRNA ac4C修饰水平下降,新生内膜形成减少;内膜区VSMC的增殖也明显减少;NAT10和ITGB1表达下调,下游FAK通路失活。接着作者测试了抑制NAT10的治疗功能,在小鼠损伤后14天通过腹腔注射remodelin,并在损伤28天后处死小鼠,发现损伤后经remodelin处理,mRNA ac4C修饰水平和新生内膜形成也出现显著降低,VSMC增殖减少,ITGB1-FAK通路失活。这些结果提示,NAT10作为治疗VSMC表型转换相关的血管重构的靶点具有很大的转化前景。
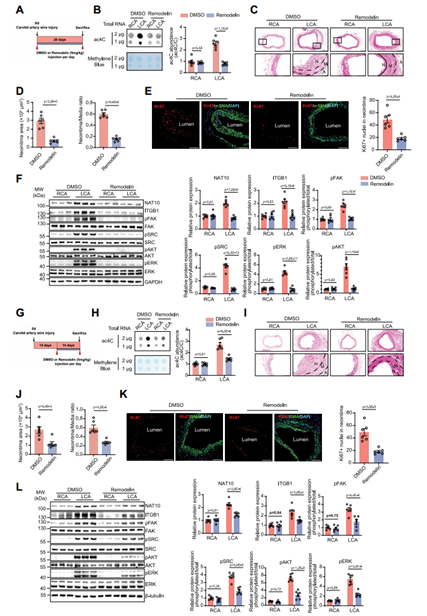
图11 用remodelin靶向NAT10具有潜在的预防和治疗作用
综上所述,本研究揭示了NAT10通过mRNA ac4C修饰在促进VSMC表型转换及血管重构中的关键作用;绘制了血管重构中VSMC ac4C修饰图谱,并以ITGB1和Col1a2为例阐明NAT10介导VSMC中mRNA ac4C修饰促进VSMC表型转化和血管重构的分子机制,从而为血管重构相关疾病的防治提供了潜在新靶点。

查看更多

查看更多

查看更多

联系我们

返回顶部