查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2024年9月17日,河南中医药大学李建生团队和武汉大学张好建团队联合在《Cell Reports Medicine》(IF=11.7)上发表了题为“Lipolysis engages CD36 to promote ZBP1-mediated necroptosis-impairing lung regeneration in COPD”的研究论文。值得注意的是,在本研究中,作者使用了汉恒生物提供的AAV6.2FF-Cre和AAV6.2FF-shZBP1腺相关病毒,成功在CD36flox/flox小鼠肺组织中实现了CD36基因的敲除和在C57小鼠肺组织中实现ZBP1基因的敲低。

慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)是一种严重危害公众健康的重大疾病,每年导致超过300万人死亡。气道炎症和肺组织破坏是COPD的主要病理特征,表现为支气管炎和肺气肿。目前多采用支气管扩张剂和吸入性糖皮质激素等药物进行治疗,但无法阻抑疾病进展,因为这些方法无法有效促进肺组织再生。肺组织再生障碍与肺泡壁破坏所致的肺气肿密切相关,导致肺功能下降和预后不良。促进肺组织再生对于实现COPD的临床改善至关重要。然而,由于对潜在的病理机制缺乏全面了解,因此尚未有任何获批的治疗性药物能够改善肺组织再生能力。
临床研究发现,COPD患者通常伴随体重减轻和脂肪及肌肉含量的减少,随着COPD的进展,体重(尤其是脂肪重量)下降更为明显。针对这一临床现象,研究团队提出“脂解可能参与了COPD进程”的科学假说。脂解作用(Lipolysis)是驱动脂肪组织损失的过程,其中甘油三酯被脂酶分解以释放游离脂肪酸(FFA),而促炎细胞因子会加剧这一过程。通过抑制脂解限速酶脂肪甘油三酯脂肪酶(ATGL)来对抗脂解的方法在减少脂肪和肌肉组织损失方面具有一定的作用,并显示出对某些疾病的治疗潜力。本研究通过一系列体内外实验证实COPD中脂解现象的发生,且证明其参与COPD发生发展,深入研究潜在的分子机制发现脂解引起COPD肺上皮细胞中CD36特异性地上调,导致Z-DNA结合蛋白1(ZBP1)介导的上皮细胞坏死,损害了肺再生,而这一过程又反过来加剧脂解。因此,脂解和肺上皮细胞特异性的CD36过表达形成了一个正反馈环促进COPD的发生发展。研究团队发现,通过敲除肺上皮细胞中的CD36,或通过药物抑制ATGL或CD36,可解除ZBP1诱导的细胞坏死性凋亡,并恢复WNT/β-catenin通路,促进小鼠肺组织的再生,从而改善COPD。在此基础上,团队进一步提出了靶向ATGL-CD36-ZBP1信号轴促进肺再生,治疗COPD的潜在可行性,为临床上开发靶向肺再生策略而治疗COPD提供了重要思路。
下面,我们一起来了解具体的研究内容:
1,COPD模型小鼠中脂解作用增强,抑制脂解可减轻急性香烟烟雾(CS)诱导的肺部炎症
首先作者利用4个月的慢性香烟烟雾(CS)暴露建立小鼠COPD模型,并且对小鼠性腺脂肪组织(GAT)进行体外培养。研究结果显示:COPD小鼠中 GAT的体积和重量显著减少;进一步对脂解相关基因的表达进行分析,结果显示:与对照组(空气暴露)比较,COPD小鼠GAT中ATGL的mRNA和蛋白质表达水平升高,同时,COPD小鼠的GAT中脂蛋白脂肪酶(Lpl)和CIDE-A (Cidea)的mRNA表达降低(Lpl和Cidea是脂解负调节分子)。此外,通过对CS暴露过程的实时监测,作者观察到CS暴露的小鼠GAT中ATGL表达逐渐增加,GAT重量逐渐减轻,并且GAT体重的减轻在4个月时更明显;这些结果表明在COPD小鼠中脂解被激活。
接着,作者测定了来自对照小鼠的GAT和COPD 小鼠的GAT的培养液上清中FFA的含量,结果显示:培养COPD小鼠GAT的培养液上清中FFA水平显著升高,并且COPD小鼠的血清中FFA的含量也显著高于对照组小鼠。同时,研究结果显示,COPD小鼠的GAT培养上清液中释放的炎性细胞因子白细胞介素IL-1β和肿瘤坏死因子TNF-α的表达水平较高,而白细胞介素IL-6的水平保持不变;并且,TNF-α和IL-1β能够增加离体培养的GAT中FFA的释放,此外,COPD小鼠的血清中TNF-α和IL-1β水平显著高于对照组。这些结果表明,COPD增强脂肪组织脂解,导致脂肪组织萎缩。
由于脂解产生的FFA可以被其他器官利用,并且是已知的炎症强效调节剂,作者在细胞水平上探究了FFA和炎症因子的关联。作者用烟雾提取物CSE处理小鼠肺上皮细胞MLE-12,通过转录组测序发现,与对照组比较:暴露于CSE的MEL12细胞的炎症反应和脂肪酸代谢增强,并且对差异基因进行共表达网络分析,结果显示:脂肪酸代谢与炎症反应、细胞凋亡等COPD标志物相关联,预示着脂解在COPD中发挥着重要作用。为了验证这一猜测,作者使用ATGL抑制剂atglistatin处理急性CS诱导的肺部炎症小鼠,并通过细胞染色和细胞计数评估小鼠肺泡灌洗液中的肺炎症反应。研究结果显示:与暴露在空气中的对照组比较,暴露于急性CS的小鼠,总白细胞、中性粒细胞和巨噬细胞的明显增加,并且atglistatin治疗显著阻断了暴露于急性CS的小鼠肺泡灌洗液中总白细胞,中性粒细胞和巨噬细胞的数量。以上研究结果表明:脂解在COPD中增强,并与COPD中观察到的炎症加重有关。
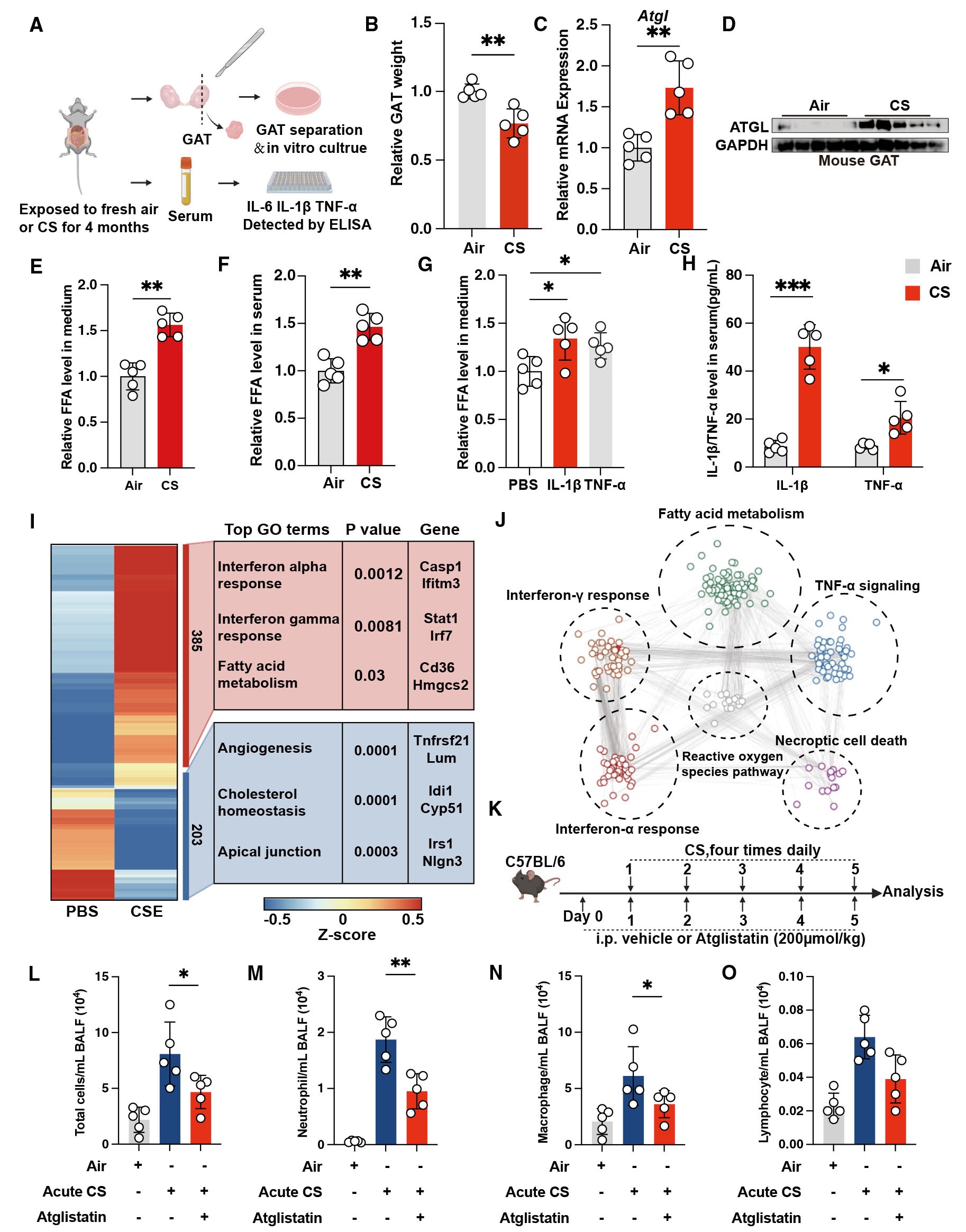
图1. COPD中脂解作用增强,而抑制脂解可减轻急性香烟烟雾(CS)诱导的肺部炎症
2,抑制脂解可改善慢性香烟烟雾暴露小鼠的COPD发病机制
为了探究脂解抑制是否对COPD具有预防作用,作者在慢性CS暴露的第3个月开始给予小鼠atglistatin干预。检测结果显示:与未经过atglistatin干预组比较,atglistatin干预组的CS暴露小鼠的GAT中ATGL的水平显著下降,以及肺泡灌洗液中总白细胞,嗜中性粒细胞,巨噬细胞和淋巴细胞的数量显著降低,更重要的是,atglistatin干预组的CS暴露小鼠气道周围的胶原沉积(气道重塑)显著减少。此外,病理结果显示,atglistatin干预对慢性CS诱导的肺气肿具有保护作用。
接着,为了探究脂解抑制是否对COPD具有治疗作用,作者在慢性CS暴露的第五个月开始给予小鼠atglistatin治疗。组织病理学定量评估显示,atglistatin治疗显著逆转了COPD肺气肿表型,同时伴随着血清中胶原沉积和FFA水平的降低,以及体重和GAT重量的恢复。这些数据表明,脂解是驱动和维持COPD病理过程所必需的。
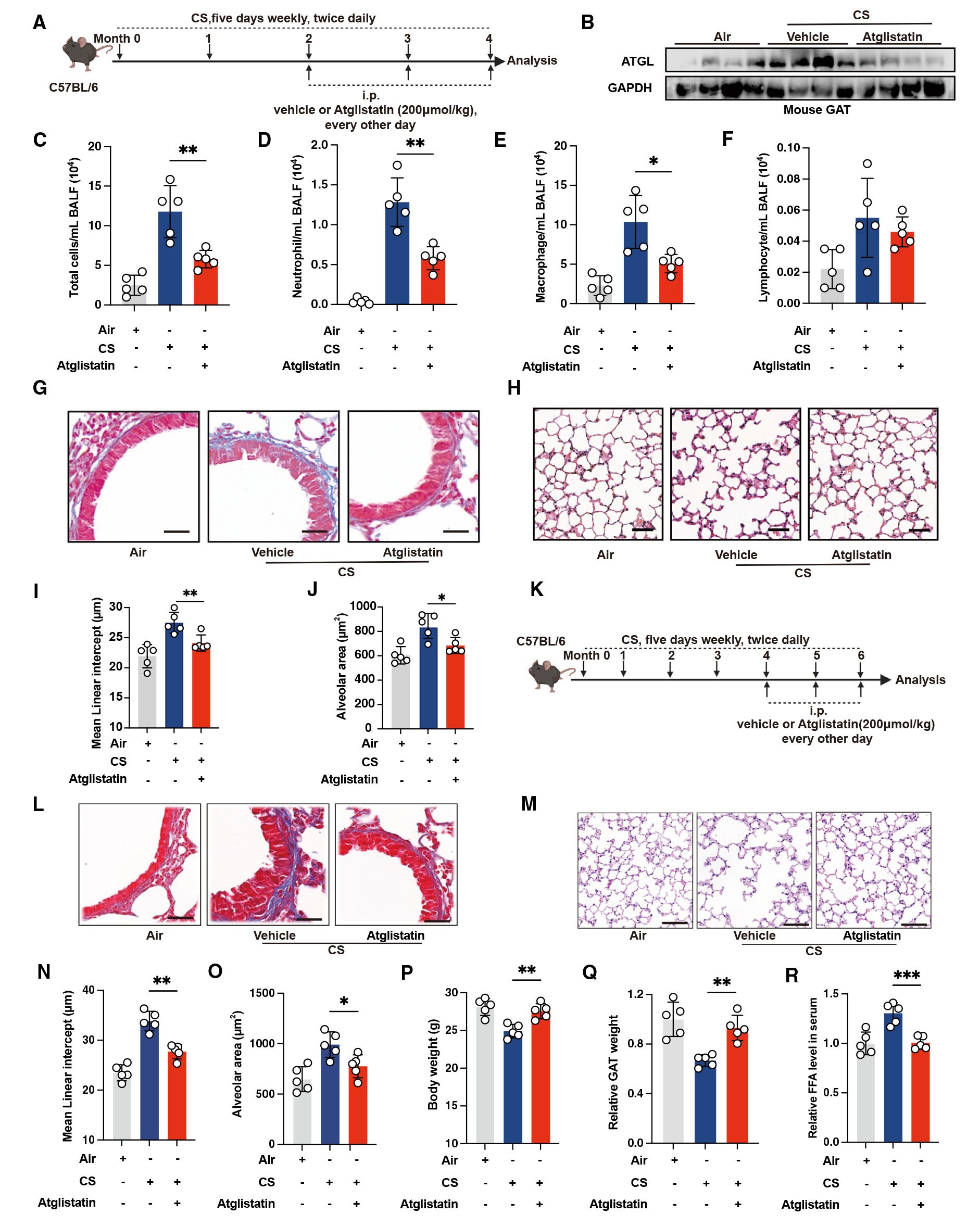
图2. 抑制脂解可改善慢性香烟烟雾暴露小鼠的COPD发病机制
3,CD36在肺上皮细胞中特异性高表达,并驱动COPD的发病过程
清道夫受体CD36可介导脂肪酸进入细胞的转运,脂质转运与炎症反应密切相关。前期转录组测序结果显示在CSE刺激的MLE-12细胞中CD36表达上调,暗示CD36可能参与脂解促进COPD进展的过程。为了验证这一猜测,作者对公共数据库中COPD患者支气管上皮细胞中的基因表达进行分析,结果显示CD36在COPD患者支气管上皮细胞中表达显著升高,同时作者观察到COPD患者支气管上皮细胞中CD36和CXCL8的mRNA 表达与TNF-α和IL-1β之间呈正相关。接着,作者检测了小鼠肺上皮细胞中CD36的表达,与前期研究结果一致:与对照组比较,慢性CS暴露的小鼠肺上皮细胞中CD36的蛋白水平显著升高,而肺非上皮细胞中CD36的表达无显著差异。
脂肪酸是一种混合物,已有研究表明,COPD患者中棕榈油酸和油酸的增加是脂质生物标志物,但其作用尚不确定。因此,作者测试了油酸是否能激活CD36表达(因为油酸常用于创建肺损伤模型),研究结果显示:静脉注射油酸显著增加了肺上皮细胞中CD36的表达。以上研究数据提示CD36在介导COPD病理过程中具有肺上皮细胞特异性作用。
为了进一步研究COPD发病机制中CD36的作用,作者在CD36flox/flox小鼠慢性CS暴露两个月后气管内注射给予AAV6.2FF-Cre病毒,以此特异性敲除CD36flox/flox小鼠肺上皮细胞的CD36基因(简称CD36 CKO小鼠)。研究结果显示, CD36 CKO小鼠与正常小鼠比较,其肺功能没有发生变化,并且病理学检测发现暴露于空气中的CD36 CKO小鼠其肺组织病理也未发生变化以及气道并未发生炎症现象。但是,与慢性CS暴露的野生型小鼠比较,CD36 CKO小鼠显著抑制了肺气肿的发展,同时CD36缺失,显著抑制了气道重塑和炎症的发生。接着,为了研究CD36的缺失是否能改善COPD小鼠的肺气肿表型和肺功能,作者将CD36flox/flox小鼠在慢性CS暴露4个月建立COPD模型,之后通过气管内注射AAV6.2FF-Cre病毒,研究结果显示,敲除CD36后,CD36flox/flox小鼠已有的肺气肿表型明显减轻并且肺功能得到改善。总之,这些数据表明上皮细胞CD36既是COPD发病机制的驱动因素,也是维持因素。
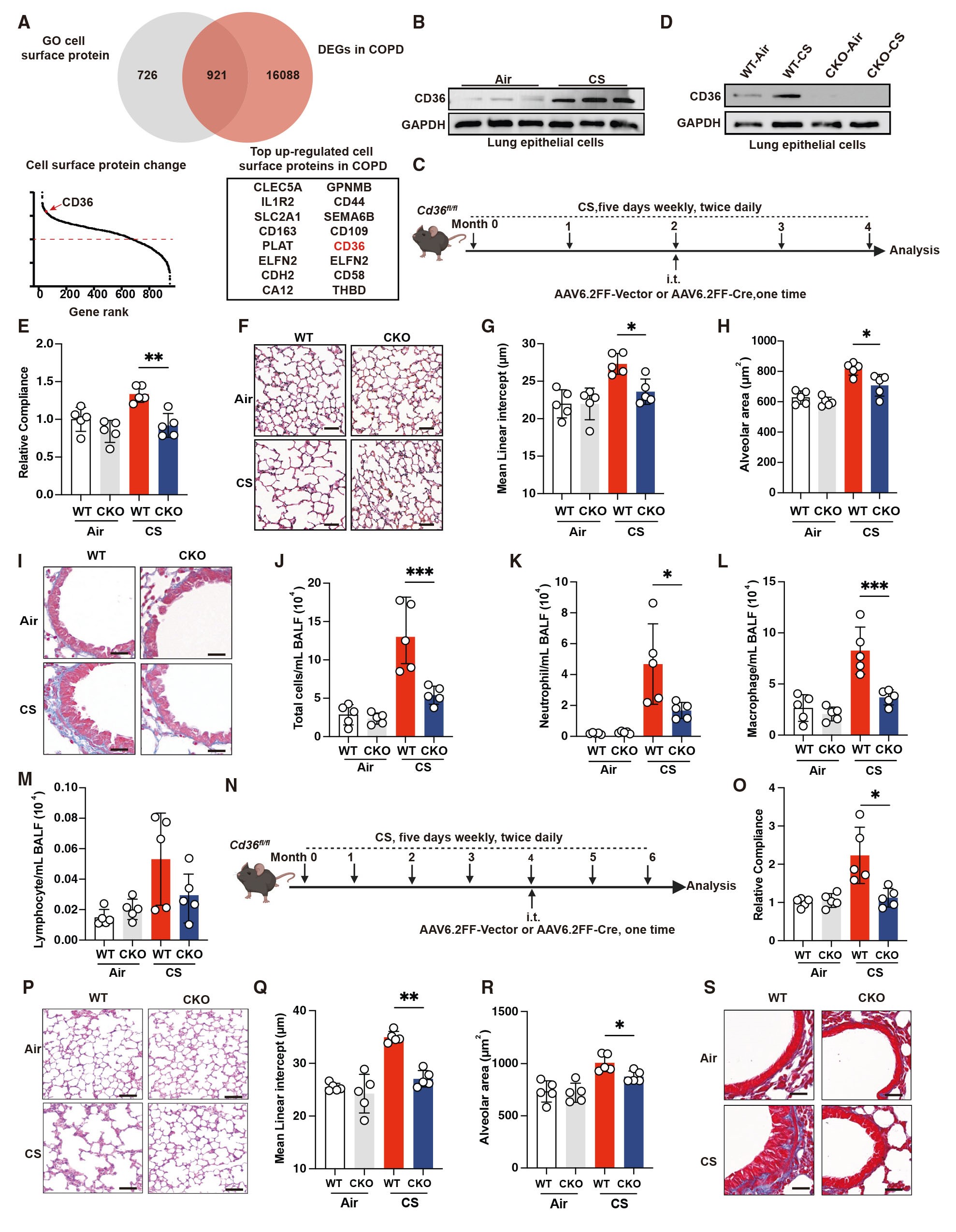
图3. CD36在肺上皮细胞中特异性高表达,并驱动COPD的发病过程
4,CD36与脂解作用之间的相互调节减弱了WNT/β-catenin信号通路,从而损害了肺再生能力
接着,作者观察到,与野生型COPD小鼠比较(慢性CS暴露4个月建立的COPD模型),CD36 CKO型COPD小鼠的GAT大小和体重显著增加,由此推测CD36和脂解之间存在相互调节关系。为了探究这一关系,作者体外培养小鼠GAT并检测上清中FFA的含量。结果显示,与野生型COPD小鼠比较,CD36 CKO型COPD小鼠的GAT释放的FFA显著减少以及促脂解炎症因子(即IL-1β和TNF-α)的水平也显着降低。之后,作者检测了atglistatin治疗或不治疗COPD的野生型小鼠肺上皮细胞CD36的蛋白表达,研究结果显示:atglistatin治疗显著降低CD36的蛋白表达。这些数据表明CD36在肺上皮细胞中的高表达与脂解相互调节。
WNT/β-catenin信号传导对于肺泡再生是必不可少的,激活β-catenin信号传导可以诱导肺气肿中的肺修复。接下来,为了探究抑制脂解或者敲除CD36可以促进肺修复,作者对WNT/β-catenin信号通路进行了检测。研究结果显示:atglistatin治疗显著恢复了COPD小鼠中β-catenin和AXIN2的mRNA和蛋白质的表达。此外,COPD野生型小鼠中,肺泡2型细胞(AT2)的丢失在atglistatin治疗后显著恢复。类似的结果在CD36 CKO的COPD小鼠也观察到。更重要的是,通过体外培养来自小鼠AT2细胞的类器官,作者观察到CD36 CKO显著恢复了COPD小鼠的类器官形成能力。总之,这些发现表明,CD36与脂解的相互调节损害了肺泡干细胞的功能,从而加剧了肺损伤。
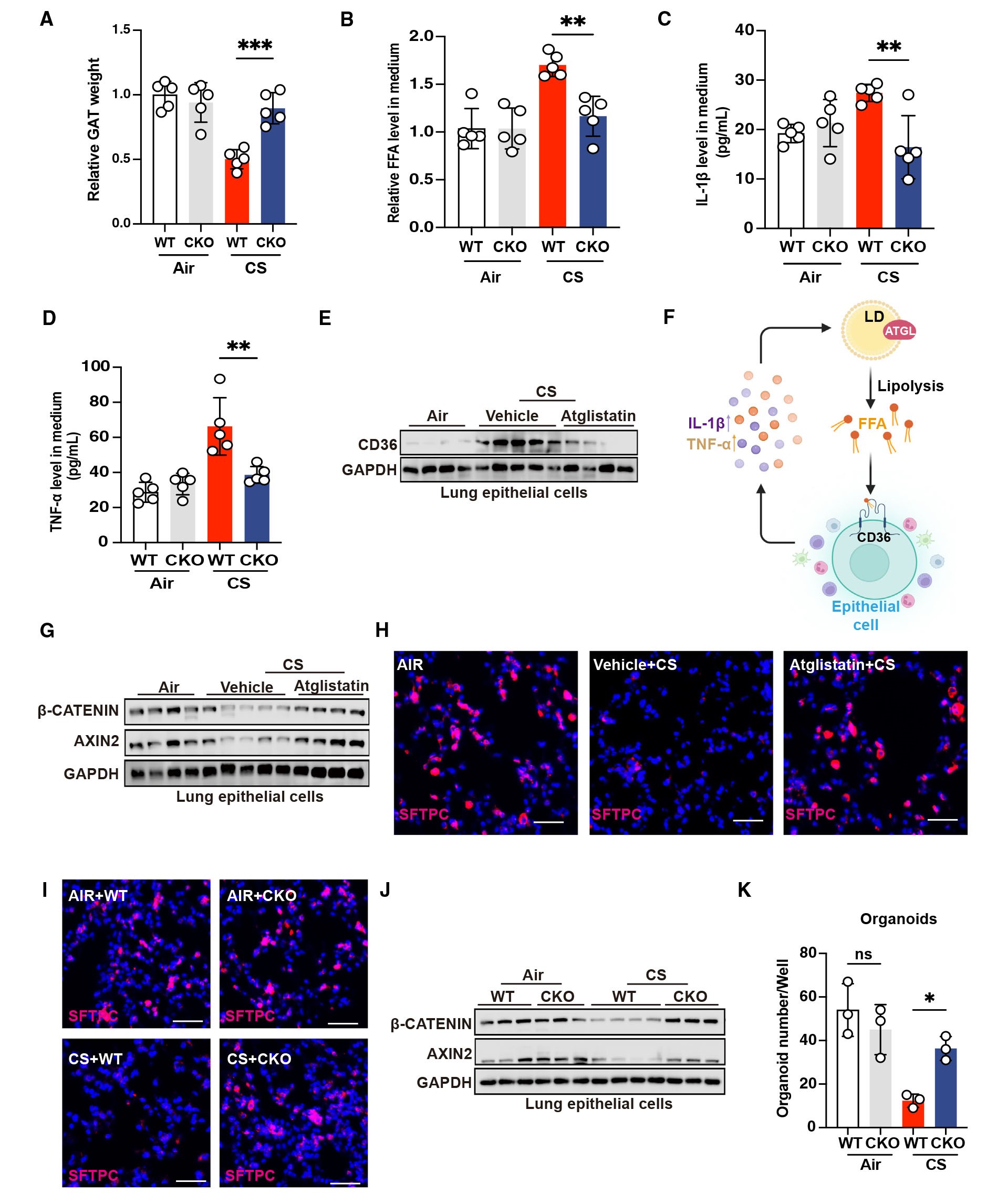
图4. CD36与脂解作用之间的相互调节减弱了WNT/β-catenin信号通路,从而损害了肺再生能力
5,ZBP1介导的CD36下游细胞坏死和脂肪分解损害肺再生
为了了解脂解和CD36相互调节损害肺再生的机制,作者对CSE处理的肺泡上皮细胞的转录谱和COPD患者的转录谱进行了对比分析,结果发现,差异表达信号通路集中在干扰素α和γ响应、脂肪酸代谢、TNF-α和细胞程序性坏死途径;由于细胞程序性坏死与细胞凋亡和炎症相关联,因此,作者推测脂解和CD36相互调节作用可能协调细胞程序性坏死使肺再生恶化。另外,已有研究表明,细胞程序性坏死途径与受体相互作用蛋白激酶1(RIPK1)和ZBP1蛋白相关联,并且,据研究报道,在已建立的肺气肿模型中,抑制RIPK1不能改善其症状,因此,作者推测,脂解和CD36的相互调节通过ZBP1介导的细胞程序性坏死损害肺再生。
为了验证这一假说,作者将ZBP1敲除小鼠进行急性CS暴露,与对照(正常空气暴露)比较,急性CS暴露导致ZBP1激活,并伴随着磷酸化混合谱系激酶结构域样假激酶(MLKL,细胞程序性死亡标志物)的增加,但是ZBP1的敲除完全抑制MLKL的磷酸化水平。同时,研究结果显示,与对照组比较,暴露于急性CS的ZBP1敲除小鼠的β-catenin和AXIN2的mRNA和蛋白质的表达显著增加,并且敲除ZBP1能恢复AT2细胞的类器官形成能力;此外,敲除ZBP1能抑制急性CS暴露诱导的小鼠气道炎症。这些数据表明:ZBP1可诱导CS暴露后肺上皮细胞程序性坏死。
接下来,作者探究了脂解和CD36的相互调节是否调节了ZBP1诱导的CS暴露后肺上皮细胞程序性坏死。作者检测了COPD小鼠肺支气管上皮细胞中ZBP1和MLKL的表达,结果显示:与对照组相比,COPD小鼠肺上皮细胞中ZBP1和磷酸化的 MLKL表达显著上调,并且,在肺支气管上皮细胞中敲低ZBP1可以明显减轻COPD症状。已有研究表明ZBP1通过募集PIPK3促进细胞程序性坏死,作者发现,在COPD小鼠的肺上皮细胞中ZBP1和RIPK3之间有明显的相互作用,并且,与对照组比较,在CD36 CKO型COPD小鼠的肺上皮细胞中ZBP1和磷酸化MLKL的表达显著降低,同时,在atglistatin处理的小鼠中也观察到类似现象。另外,研究结果显示:在AT2细胞中,敲低CD36显着抑制Z-DNA(ZBP1的激活依赖于Z型RNA或 DNA (Z-RNA/DNA)的存在)的表达,促进Sftpc(AT2细胞标志物)mRNA的表达,以及促进细胞增殖。这些研究结果表明:上调CD36通过促进ZBP1介导的COPD肺上皮细胞坏死而损害肺再生。
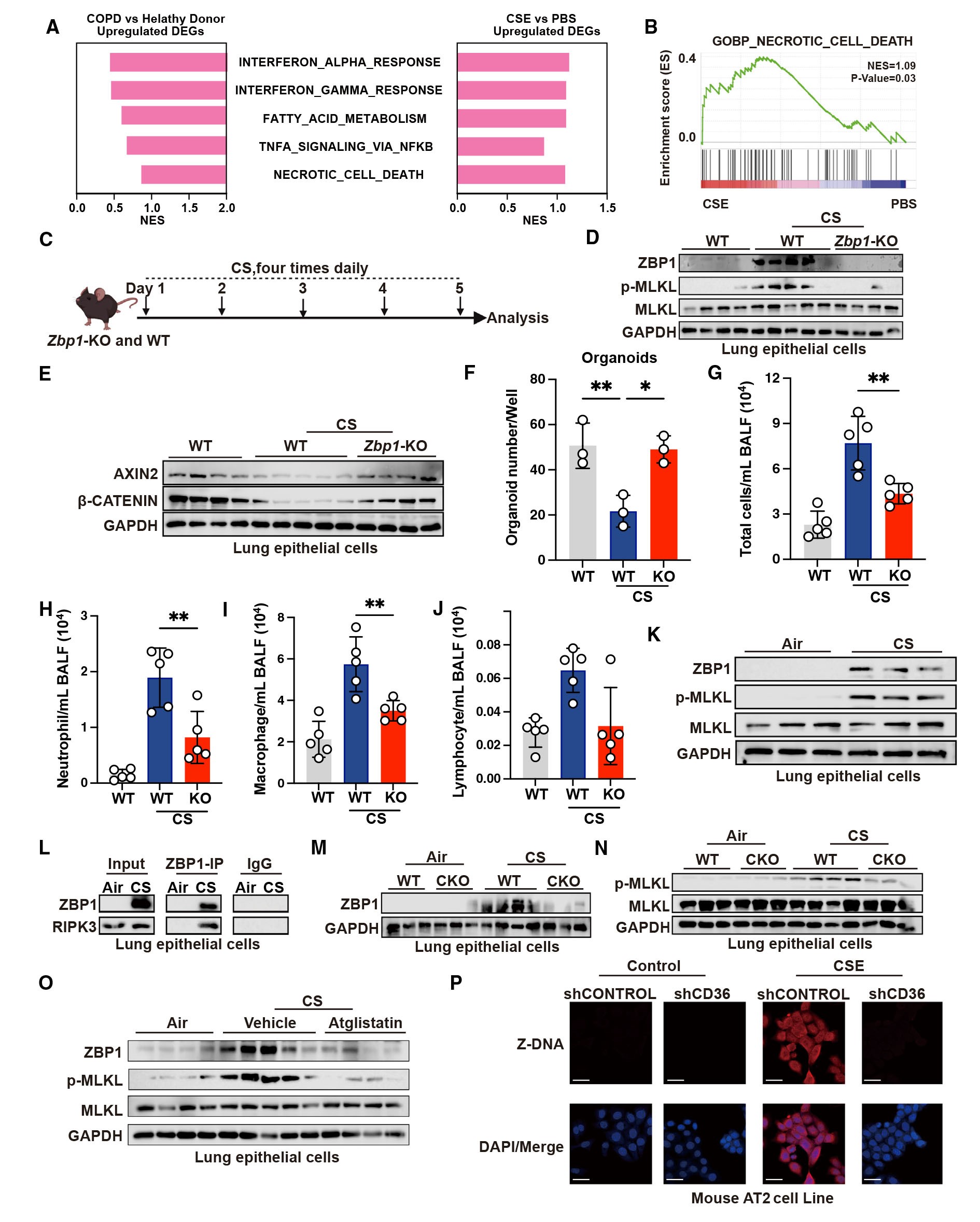
图5. ZBP1介导的CD36下游细胞坏死和脂肪分解损害肺再生
6,CD36靶向治疗减轻COPD发病机制及促进肺再生
为了探究CD36在COPD中的治疗潜力,作者使用特异性靶向CD36的CD36单克隆抗体和小分子抑制剂丹酚酸B (SAB)来预防和治疗COPD。首先,作者测试了靶向CD36能否预防COPD的进展。作者在CS暴露第3个月开始给予小鼠CD36单克隆抗体或SAB,对气道周围胶原沉积的定量评估以及平均线性截距和肺泡表面积的组织病理学量化显示,CD36单克隆抗体或SAB均可以改善慢性CS暴露小鼠的气道重塑和抑制慢性CS暴露小鼠的肺气肿。此外,研究结果发现预防性靶向CD36抑制了ZBP1介导的细胞程序性坏死,并恢复了慢性CS暴露小鼠肺上皮细胞中β-catenin和AXIN2的表达水平,并且,阻断CD36可减轻油酸诱导的ZBP1介导的细胞程序性坏死。此外,远端肺上皮标志物Nkx2.1和AT2细胞标志物(Sftpc、T1a)的表达水平在给与CD36抗体后也显著恢复。
其次,作者测试了靶向CD36对于COPD的治疗作用。作者在CS暴露第5个月开始给予小鼠CD36单克隆抗体治疗,对气道周围胶原沉积的定量评估以及平均线性截距和肺泡表面积的组织病理学量化显示,给与CD36单克隆抗体治疗,改善了COPD小鼠的气道重塑和肺气肿。此外,研究结果显示:在COPD模型小鼠上给与CD36单克隆抗体治疗还促进了再生相关标志物的表达。这些研究结果表明,针对CD36的靶向治疗不仅改善了COPD的发病机制,还促进了肺部再生。
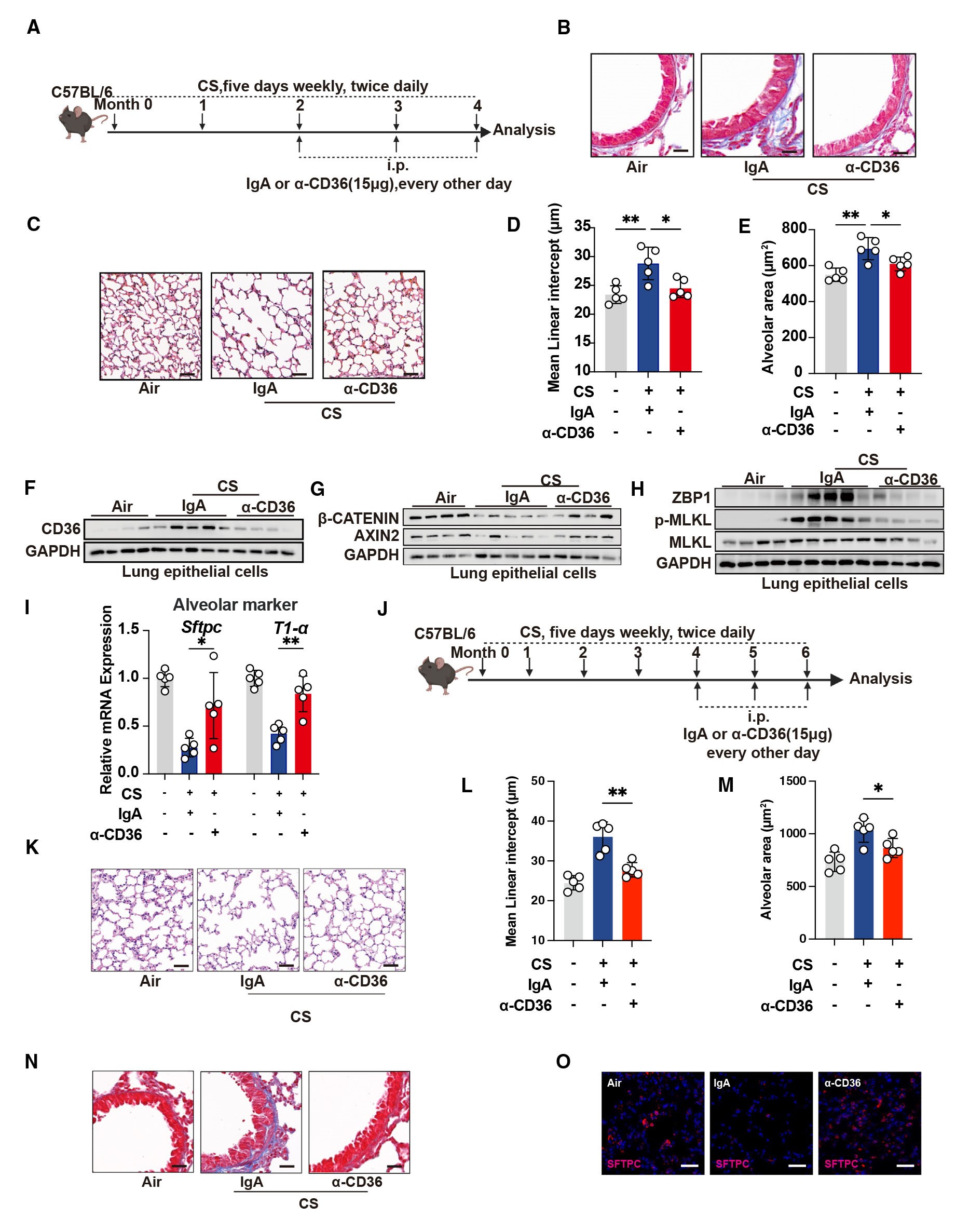
图6. CD36靶向治疗减轻COPD发病机制及促进肺再生
7,针对CD36的靶向治疗干预可减轻弹性蛋白酶诱导肺气肿中的肺部病变,并促进肺再生
由于CD36是一种多功能的受体,参与多种生理和病理过程,因此,作者在猪胰腺弹性蛋白酶(PPE)诱导的肺气肿模型中进一步评估了CD36的治疗潜力。作者在PPE诱导前给予小鼠CD36单克隆抗体或SAB,研究结果显示,CD36单克隆抗体或SAB均可以显著抑制肺气肿的发展,并改善小鼠的肺功能;并且,CD36抑制后可降低ZBP1和磷酸化MLKL的表达,同时恢复AXIN2和β-catenin的表达。这些研究结果提示:CD36靶向治疗可以阻止PPE诱导的肺气肿的进展。接着,作者探讨了CD36的治疗性干预是否对已确立的肺气肿有益,在小鼠灌注PPE7天后,给与CD36单克隆抗体治疗,研究结果显示:CD36单克隆抗体能抑制ZBP1和磷酸化MLKL的表达,并且恢复已建立的肺气肿小鼠中AXIN2和β-catenin蛋白的表达。此外,作者对从单克隆抗体处理的小鼠和对照组中分选出AT2细胞并进行类器官培养; 结果显示阻断CD36显着恢复了AT2细胞的类器官形成能力。以上这些结果表明CD36靶向治疗可以有效地预防和治疗肺气肿,促进肺再生。
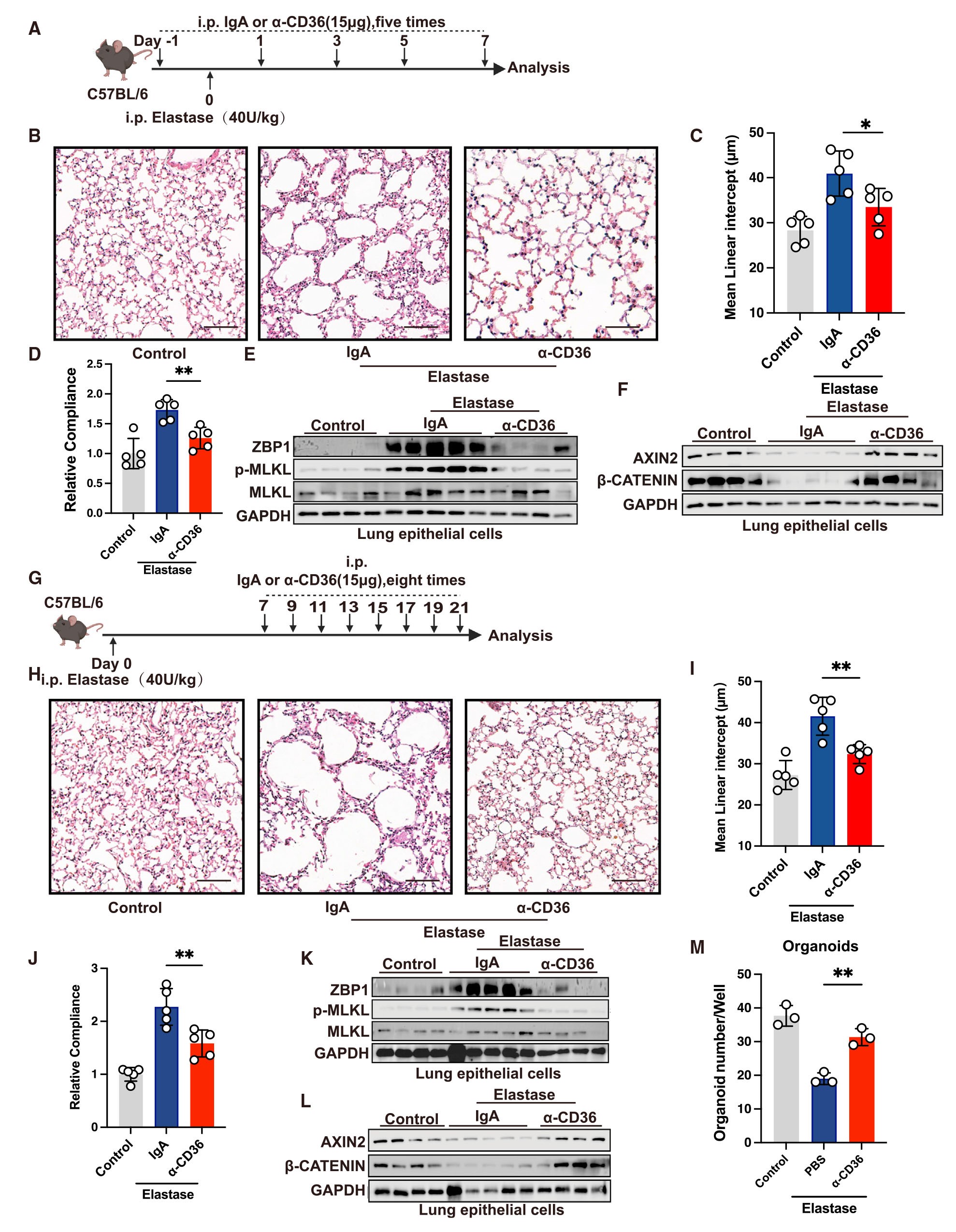
图7. 针对CD36的治疗性靶向干预可减轻弹性蛋白酶诱导肺气肿中的肺部病变,并促进肺再生
综上,该研究揭示:ATGL诱导的脂解作用促使肺上皮细胞中CD36特异性高表达,进而加速ZBP1介导的肺上皮细胞程序性坏死,并损害COPD中的肺再生能力。这表明通过靶向ATGL-CD36-ZBP1信号轴来进行COPD治疗干预具有潜在可行性。
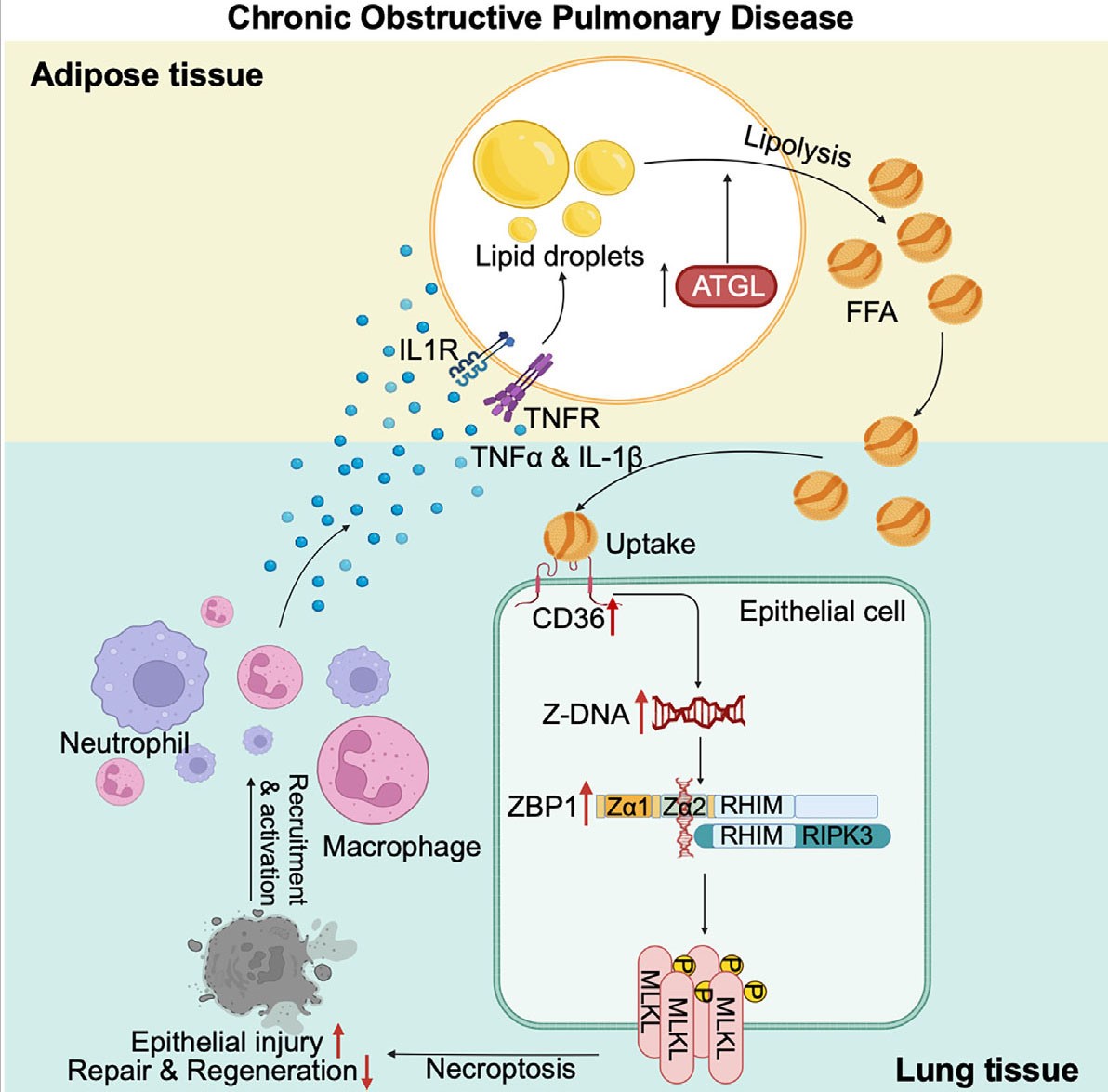
图8. ATGL-CD36-ZBP1轴调节肺再生的分子机制

查看更多

查看更多

查看更多

联系我们

返回顶部