查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
α-突触核蛋白病是一类神经退行性疾病的统称,包括帕金森病(PD)、路易体痴呆(DLB)、多系统萎缩(MSA)、阿尔茨海默病路易体变体(LBV-AD)和纯粹自主神经衰竭(PAF)等疾病,是一类神经退行性疾病;其特征是病理性α-突触核蛋白(α-synuclein, α-Syn)在受损的神经元中错误折叠和异常聚集,逐渐在神经元中形成不溶性α-Syn包涵体。
2023年6月28日,广东省人民医院王丽娟作为通讯作者在Advanced Science (IF=17.521)发表了题为“Cerebral Microvascular Injury Induced by Lag3-Dependent α-Synuclein Fibril Endocytosis Exacerbates Cognitive Impairment in a Mouse Model of α-Synucleinopathies ”的研究论文,该研究发现靶向Lag3可有效阻断α-突触核蛋白向脑微血管内皮细胞(BMVECs)传递,以提高认知能力。值得注意的是,在本研究中,作者使用了汉恒提供的慢病毒成功实现了Lag3 的敲低和过表达。
作者建立了两种稳定的α-突触核蛋白病认知障碍模型,分别在小鼠单侧黑质致密部、海马和大脑皮层联合注射α-Syn预合成纤维(α-Syn preformed fibrils, PFFs)和注射过表达人A53T α-Syn基因的腺相关病毒载体 (AAV-A53T),在注射后6个月,作者检测了这两组模型及假手术组小鼠的酪氨酸羟化酶(TH)+和NeuN+神经元的数量,且应用Morris水迷宫(MWM)和新型物体识别(NOR)测试评估认知障,发现模型小鼠表现出空间学习和记忆能力受损,并且这种认知能力下降与脑微血管损伤相关。

图1 注射AAV和PFFs的小鼠认知功能损伤并伴有轻度神经元损伤
接下来作者评估了毛细血管网络、脑微血管密度、分类血管(静脉和动脉)的体积/直径以及微血管周细胞覆盖率,以反映CMS的变化。对不同大脑区域(中脑、海马体和大脑皮层)进行了毛细血管成像,显示PFFs组的血管灌注量明显低于AA V-A53T组和假手术组;此外,PFFs组的静脉/动脉血管体积和直径明显小于假手术组和AAV-A53T组。以上结果说明,与AAV诱导的病理学相比,α-Syn PFF诱导的病理学导致更严重的CMS损伤。为了研究CMS损伤是否伴有神经胶质炎症,通过电离钙结合适配器分子(IBA1)和神经胶质原纤维酸性蛋白(GFAP)的共染色来测量神经胶质的活化。但令人惊讶的是,尽管PFFs组CMS损伤更严重,但PFFs组IBA1/GFAP阳性细胞比率的增加远小于AAV-A53T组,这表明α-Syn PFFs比AAV-A53T导致更轻微的神经胶质炎症。

图2与注射AAV小鼠中相比,注射PFF导致更严重的CMS损伤和更少的胶质炎症
在神经系统中,微血管内皮细胞(BMVECs)是NVU的中心成分,调节血脑屏障以维持大脑的功能稳态。有证据表明血脑屏障破裂是人类认知功能障碍的早期生物标志物,因此,作者接下来研究了模型中血脑屏障是否受损。为了评估血脑屏障,分析了紧密连接蛋白的表达,然后通过静脉尾静脉注射伊文思蓝(EB)和两种尺寸的荧光标记右旋糖酐来测试体内血脑屏障的通透性。在PFFs组中,所有紧密连接蛋白的表达都明显降低,而在AAV-A53T组中,只有Occludin在中脑、海马和大脑皮层的表达以及Zo-1在中脑的表达降低。此外,PFFs组中所有紧密连接蛋白的相对表达均低于AAV-A53T组。通过qPCR测量的紧密连接蛋白的mRNA表达显示出与蛋白表达相同的趋势。这些结果表明α-Syn PFFs可导致更严重的紧密连接蛋白表达下降。
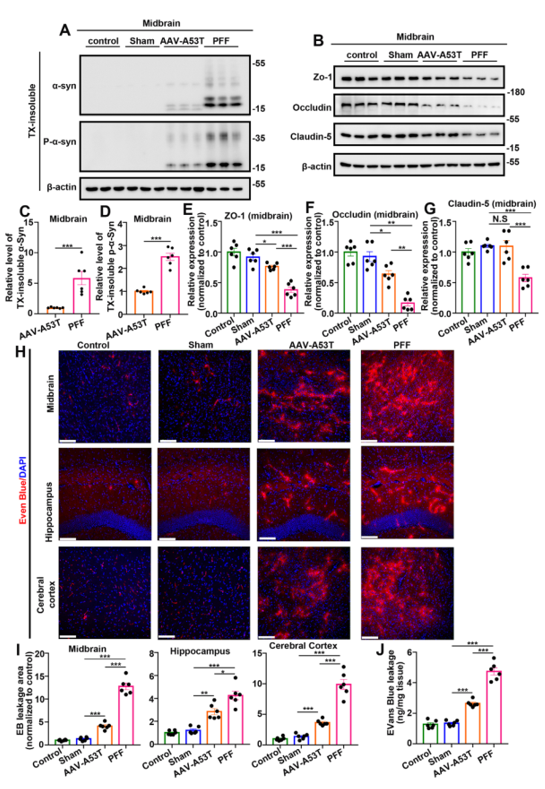
图3与注射AAV小鼠中相比,注射PFFs导致紧密连接蛋白表达的更显著降低和血脑屏障通透性的更显著增加
作者用Alexa Fluor 488标记 PFFs发现外源性PFFs在48小时后通过内吞作用进入BMVECs形成不溶性α-Syn 包涵体。由于Lag3是 PFFs经内吞作用进入小鼠神经元中的所必需的,故作者推测BMVECs中的Lag3也参与了PFFs进入BMVECs。在源自野生型(WT)小鼠的BMVECs中观察到外源性 PFFs和Lag3的共定位,但在源自Lag3−/−小鼠的BMVECs中几乎没有观察到,这证实了作者这一猜想。接下来,作者调节了Lag3的表达,以评估它是否会影响 PFFs的内吞作用。使用从WT或Lag3−/−小鼠中提取的原代BMVECs,用LV-Lag3、LV-Lag-shRNA或者阴性对照慢病毒转染该细胞。发现Lag3的过表达增加了PFFs的内吞作用及不溶性α-Syn包涵体的产生,而Lag3的敲除显著降低 PFFs的内吞作用及不溶性α-Syn包涵体的产生。

图4 PFFs通过Lag3依赖性内吞作用进入BMVECs形成α-Syn不溶性包涵体
接下来,作者研究了内皮细胞特异性Lag3基因敲除是否在体内阻止PFFs进入BMVECs,然后改变PFFs对认知和CMS的影响。实验分为四组:注射PBS的对照小鼠(PBS-Lag3-WT小鼠)、注射PBS内皮细胞特异性Lag3条件性敲除小鼠(PBS-Rag3-ECs-Cko小鼠)、注射PFFs的对照小鼠(PFFs-Lag3-WT小鼠)和注射PFFs的内皮细胞特异性Lag3条件性敲除小鼠(PFFs-Lag3-ECs-Cko小鼠),在注射后6个月的检测认知功能。PBS-Lag3-WT小鼠、PFFs-Lag3-WT小鼠表现出显著的认知能力下降和情绪障碍,尽管PFFs-Lag3-ECs-Cko小鼠的结果仍然不如PBS-Lag3-ECs-Cko小鼠,但它们的结果优于PFFs-Lag3-WT小鼠。这些结果所示,小鼠中内皮细胞特异性Lag3的缺失可以逆转PFFs诱导的认知障碍。
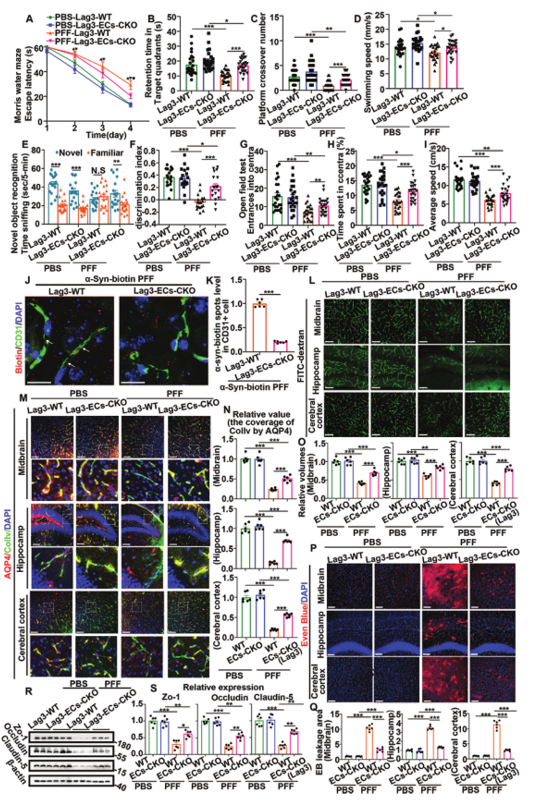
图5 小鼠内皮细胞特异性Lag3的缺失可以逆转PFFs诱导的认知障碍
综上所述,这一研究为证实α-突触核蛋白病认知障碍具有共性微血管病理机制提供了关键证据,并且揭示了靶向Lag3阻断α-Syn纤维向脑微血管内皮细胞扩散对改善认知功能的重要意义。

查看更多

查看更多

查看更多

联系我们

返回顶部