查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一个主题中,我们从原理、应用、实验流程及常见问题几个方面详细了解了细胞迁移,侵袭,克隆形成技术,本期我们继续为大家带来细胞表型实验——血管生成实验的指南和常见问题解析。

一、血管生成
血管生成(angiogenesis)是指新血管从已存在的血管中形成的生物过程。当血管生成的刺激因子与内皮细胞上的受体结合时,将启动一系列血管生成程序,包括基底膜的破坏、内皮细胞的迁移、侵袭、增殖和向毛细血管分化。血管生成是一个关键的生物过程,它不仅在癌症的发展和非肿瘤性疾病中扮演着角色,也参与各类生物体正常生理功能,如生殖、发育和组织修复等。
血管生成是一个相当复杂的过程,其受到生长因子、趋化因子、血管生成素等内源性促血管生成因子,和内皮抑素、血小板反应蛋白-1等内源性抑制剂的动态调节,更牵涉到细胞与细胞、细胞与基质的相互作用。这一过程涉及到内皮细胞的一系列活动:在碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)和表皮生长因子(EGF)等促血管生成信号激活内皮细胞受体后,内皮细胞将释放蛋白酶以降解基底膜。随后,内皮细胞进行增殖和迁移,以每天几毫米的速度形成新芽,最终形成新的血管网络[1,2]。
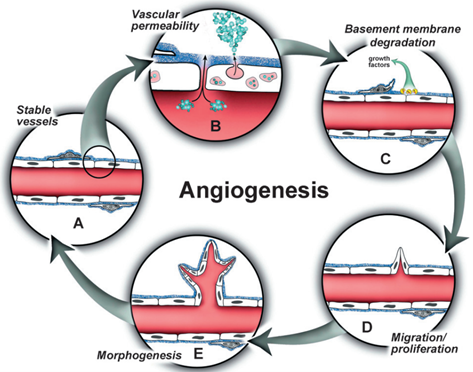
图1 血管生成过程
目前血管生成的测定方式包括体内方法和体外方法。一般来说,体外方法可监测血管生成过程中的特定阶段并用于早期评估,而体内方法更准确地模拟活体微环境以提供更多相关的信息[3]。体外实验常见的检测项目包括增殖能力检测、迁移能力检测、管形成实验(成管实验,tube formation assay)以及胸主动脉环实验,体内实验包括雏鸡绒毛尿囊膜(CAM)测定、角膜血管生成实验、基质胶内血管生成实验、定向体内血管生成实验等。一般来说,需要结合几种不同的检测方法以获得最为全面和准确的数据,在本篇中我们将介绍血管生成检测方法中应用最为广泛的成管实验。
二、管形成实验
管形成实验(Tube Formation Assay)是一种模拟血管生成、以确定参与血管生成的基因或途径的快速定量方法,其利用了体外培养的内皮细胞依然保留响应血管生成信号而快速分裂和迁移能力这一特性[4]。该实验于20世纪80年代首次建立[5],早期的实验结果显示在没有基底膜提取物的情况下,内皮细胞形成管状网络所需时间长达4-6周[6]。Kubota将内皮细胞接种于基底膜成分重组的基质后,内皮细胞在体外快速形成类似于体内环境的毛细血管样结构,这一发现使得管形成实验成为一项快捷高效的表型检测方式 [7]。
目前最为常见的方式为通过在含有细胞外基质成分(如层粘连蛋白、巢蛋白、胶原蛋白等)和生长因子(如VEGF、EGF等)的基质胶上培养内皮细胞,在预定时间点拍摄图片并通过软件处理得到的定量数据,来观察其最终展现的三维毛细血管样结构形成能力(图2),是一种简单、定量、可靠且功能强大的模型,常用于探索血管生成的抑制剂和激活剂、血管生成机制,或定义内皮细胞群等研究。
用于管形成实验的细胞可以是原代内皮细胞,也可以是永生化细胞系,常用细胞包括人脐静脉内皮细胞(HUVEC)、小鼠3B-11细胞系、小鼠SVEC4-10细胞系等。内皮细胞的传代数尽可能在2-8代以内,以保证最佳的细胞状态。根据使用的细胞系以及内皮细胞是否永生化,需要进行优化以确定成管所需的理想时间,相较于永生化细胞而言,原代内皮细胞的管形成时间一般延迟数小时[8]。

图2 管形成实验流程
三、实验步骤
接下来,我们以HUVEC为例,介绍常见的管形成实验流程步骤:
3.1 实验准备
(1)准备实验耗材:在4°C环境中低温融化基质胶,预冷相关器材(如枪头、待铺胶细胞培养板板等)。需要注意的是,进行基质胶铺板时所有步骤需在冰盒上操作,以避免基质胶在温暖环境中凝固。
(2)基质胶稀释和铺板:使用DMEM或条件培养基将基质胶稀释到8-12 mg/mL,可根据实际情况进行调整。由于每一批基质胶浓度会有差异,建议使用前做不同梯度的稀释。稀释基质胶后,分别取50 μL至孔板内,并避免产生气泡,在37℃培养箱中放置30-45 min。
(3)细胞预处理:对状态较好的细胞使用标准的传代细胞程序,进行预实验摸索细胞铺板数量使其在24 h内达到~80%融合。对HUVEC细胞进行饥饿处理:将完全培养基换成含1% FBS的DMEM培养基,培养24 h。
3.2 细胞铺板
(1)使用杜氏磷酸缓冲液(DPBS)清洗细胞,加入胰蛋白酶消化HUVEC,离心沉淀后,使用含有10% FBS的DMEM或条件培养基重悬细胞,进行多次细胞计数取平均值,已保证准确性。(如需荧光影像数据,可在DPBS清洗细胞前添加终浓度为2 μg/ml的钙黄绿素AM,将钙黄绿素AM标记的细胞置于37℃和5%CO2的黑暗中30-45 min后洗涤钙黄绿素AM)
(2)每孔加入100 μl细胞悬液,接种密度约为1至3*10^4个细胞/孔,注意保持枪头垂直在上孔的上方,避免接触孔内凝胶。
3.3 细胞培养观察
(1)将细胞培养板在37℃、5% CO2下静置培养。
(2)可设置时间梯度观察,或在特定时间下观察。使用光学显微镜观察细胞,根据条件培养基中的血管生成因子浓度不同,一般来说细胞在2~4h内开始形成管状结构,HUVEC种植至基质胶后经过4小时左右即可初步成管,管形成峰值约在2-12h之间,并在数小时后结构塌缩。
(3)拍摄毛细管网络的图像,可使用Image J的Angiogenesis Analyzer插件或其他软件分析管状网络的节点、管数量、管长度、管面积等表型[4,9]。
四、实例结果解读
图3所示为HUVECs在铺板后的行为动力学变化,细胞最初在1h左右附着于基质膜,在接下来的2-4 h内相互迁移,形成毛细管样管,在6-16 h内形成较成熟的管状结构。24 h后,细胞逐渐凋亡,小管结构破裂并与基质分离[4]。
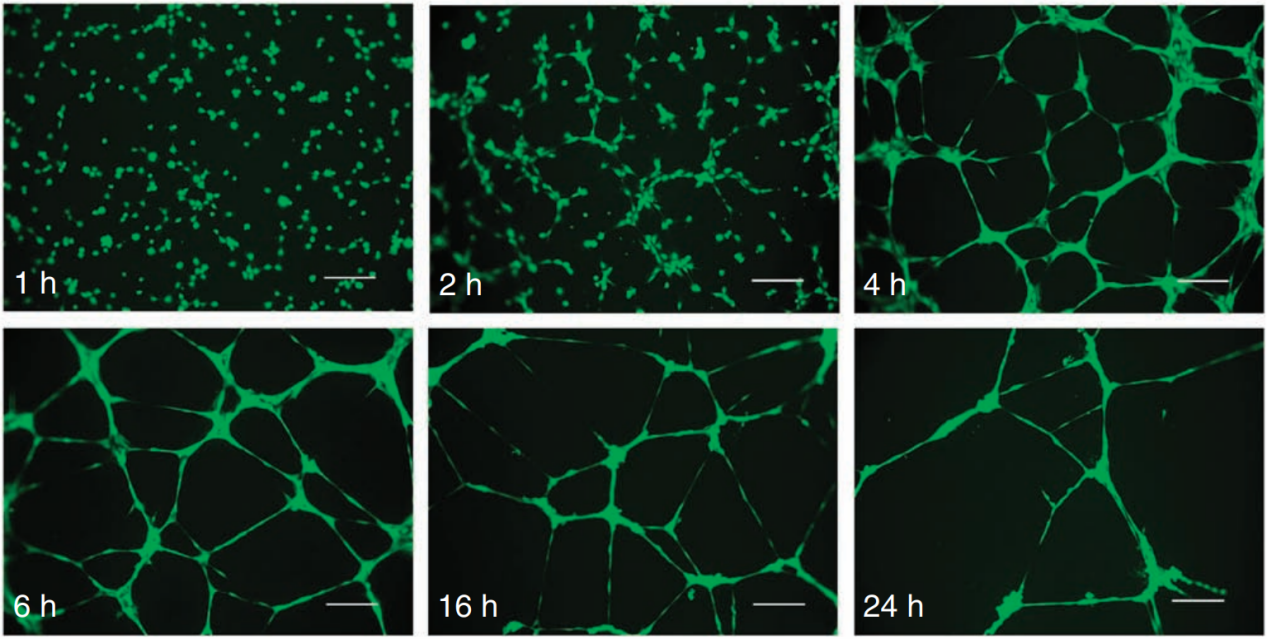
图3 HUVECs在基底膜基质上的管形成过程
图4所示为3B-11细胞在使用钙黄绿素AM处理后在管形成峰值期间的成像数据,原始图像经由Image J处理后得出相关定量数据,图B展示了总节点(红色)/管(粉红色)/网状细胞(蓝色)的处理后图像,分别对其计算后可得节点数为556,小管数为93,网格数量为42[2]。
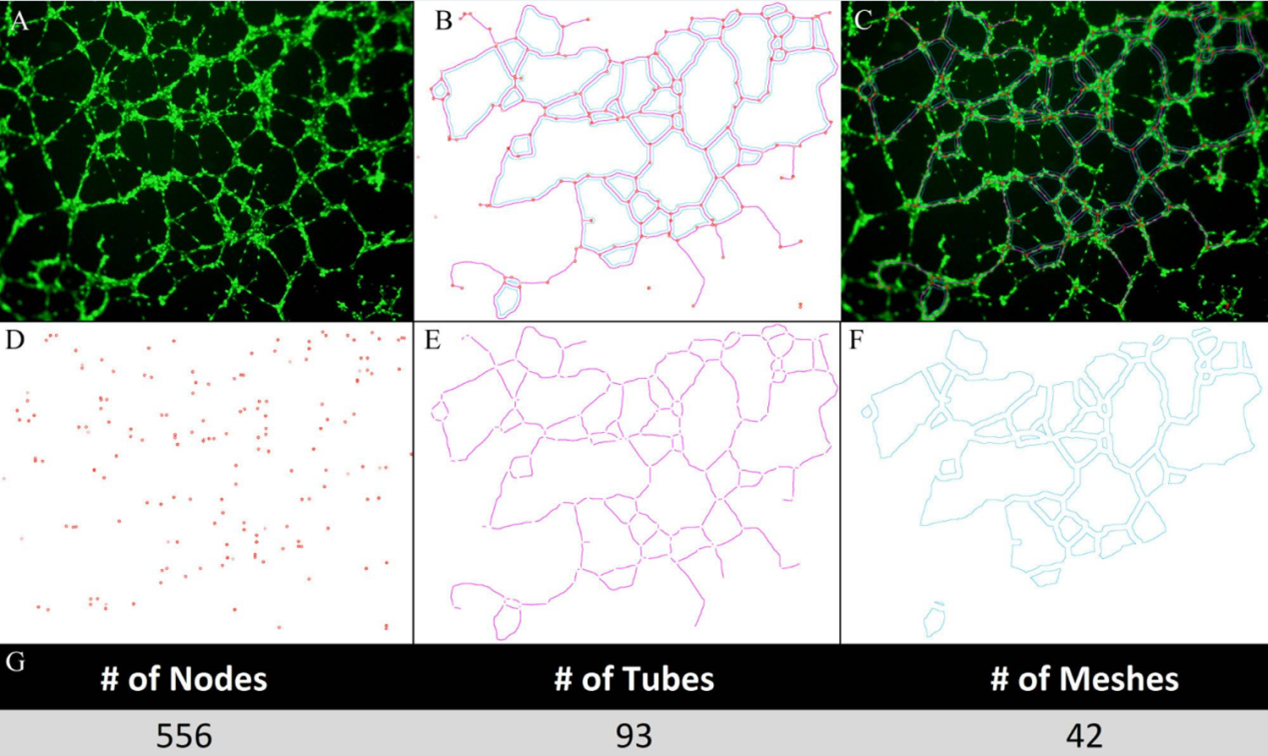
图4 3B-11细胞的荧光显微镜成像和管形成的定量
五、常见问题
1. 阳性诱导剂对照组中无管网络形成如何处理?
可能原因包括:细胞老化、细胞损伤引起的细胞状态不佳、细胞密度过高/过低,或基质胶浓度不合适/过期/质量不佳。①对于细胞状态不佳,我们可通过更换健康细胞或代数较低的细胞;对于密度不佳的问题,首先需保证用于成管实验的细胞是均匀分布、密度适中的,由于最佳接种密度具有细胞类型特异性,故需要多次摸索以确定最佳接种密度;②用于实验的培养基与接种细胞时所使用培养基成分相同、换液时应动作轻柔,以防影响细胞状态;③对于基质胶质量问题,可通过重新稀释、更换品牌、批次等方式确保使用新鲜、质量良好的基质胶。
2. 怎样操作可使基质胶铺板均匀?
①基质胶需保存于-20℃,使用时在4℃融化,铺板时所有操作需在冰上进行以减缓凝固速度;②向孔内加入基质胶时应尽可能垂直加入,防止基质胶流经孔壁而留下残留胶,且一次性将基质胶铺垫均匀,尽量避免多次加减试剂;③在37℃放置固化时,确保放置在水平平面上,以确保实验的准确性和稳定性。④若孔底没有铺满胶,可晃动一下96孔板使底部铺胶均匀。
3. 成管实验需要多长时间?
实验时长与细胞状态、培养基血管生成因子浓度成正相关。一般来说细胞状态较好时,2-3小时开始成管,细胞状态较差时,可能18-24h成管。建议第一次实验时,每4个小时观察一次。另一方面,若使用原代细胞进行成管实验,成管时间将有一定延迟。
4. 内皮细胞在培养过程中出现聚团如何处理?
在成管实验中若出现内皮细胞聚团现象,可能因素包括:①细胞密度过高或铺板不均匀,可根据实验需求调整细胞接种密度,充分混匀细胞悬液,铺板时动作轻柔、均匀;②细胞状态不佳、细胞老化也可能导致聚团,应定期检查细胞状态,及时传代,并避免过度密集培养;③基质胶质量不佳,质量不好或处理不当得基质胶可能导致细胞不能均匀铺展,需确保基质胶新鲜且按说明书正确处理;④培养板亲水性差,此时可在培养容器表面进行明胶包被处理、更换培养板或血管生成载玻片;⑤血清促贴壁因子不足,应使用新鲜培养基或更换内皮细胞专用培养基。
5. 管形成实验中应该包含哪些对照组?
在初次实验时,最少需设置空白对照、阳性对照和阴性对照组。空白对照可以是不含细胞的基质对照组,以排除基质本身可能产生的任何背景信号或结构,也可以仅含有细胞而无基质铺板的组别。阳性对照组中需加入已知的促进血管形成物质,实验条件正确时能够观察到明显的管状结构形成。作为阴性对照,可以使用未经处理的细胞或加入已知的血管形成抑制剂。此外,如果实验目的为测试某种药物或化合物对管形成的影响,应设置不同浓度的该物质作为对照,包括一个无药物处理的对照组,以评估药物剂量与效果之间的关系。
6. 应该手动还是自动监测管状网络的形成?
两种方式均存在其优缺点,选择哪种方法取决于实验的具体需求、可用资源以及预期的结果分析精度。手动监测灵活性高、成本低,而存在主观性强、重复性差、操作耗时长的缺点;自动监测优势在于客观性高、效率高、精确度高,但成本高、适应性有限,软件可能无法满足某些非常规实验设计。需要处理大量样本,或者对结果的客观性和重复性要求很高,自动监测更为合适,特别是不熟悉所用细胞类型的血管生成行为时。常规设置一般为24小时的时间范围内每5-15分钟自动拍摄一张照片,精确监控管形成的进程。若实验规模较小,对结果的详细观察和分析要求较高,实验室资源有限,可选择手动监测。
六、参考文献
[1] Chung, Alicia S., John Lee, and Napoleone Ferrara. "Targeting the tumour vasculature: insights from physiological angiogenesis." Nature reviews cancer 10.7 (2010): 505-514.
[2] DeCicco-Skinner, Katie L., et al. "Endothelial cell tube formation assay for the in vitro study of angiogenesis." Journal of visualized experiments: JoVE 91 (2014).
[3] Stryker, Zachary I., et al. "Evaluation of angiogenesis assays." Biomedicines 7.2 (2019): 37.
[4] Arnaoutova, Irina, and Hynda K. Kleinman. "In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract." Nature protocols 5.4 (2010): 628-635.
[5] Folkman, Judah, and Christian Haudenschild. "Angiogenesis in vitro." Nature 288.5791 (1980): 551-556.
[6] Maciag, T., et al. "Organizational behavior of human umbilical vein endothelial cells." The Journal of cell biology 94.3 (1982): 511-520.
[7] Kubota, Yasuo, et al. "Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures." The Journal of cell biology 107.4 (1988): 1589-1598.
[8] Kelley, Mary, et al. "Endothelial cell tube formation assay: an in vitro model for angiogenesis." VEGF Signaling: Methods and Protocols. New York, NY: Springer US, 2022. 187-196.
[9] Gentile, Maria Teresa, et al. "HUVEC tube-formation assay to evaluate the impact of natural products on angiogenesis." JoVE (Journal of Visualized Experiments) 148 (2019): e58591.

查看更多

查看更多

查看更多

联系我们

返回顶部