查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
癌细胞中普遍存在的基因突变及其产物是健康细胞和正常基因组中所没有的,而非同义突变的表达可以产生肿瘤特异性抗原(TSA),称为新抗原,通过细胞毒性T淋巴细胞(CTL)诱导适应性抗肿瘤免疫。然而仅有极少数的新抗原具有足够的抗原性以引起免疫反应。因此,探索可触发T细胞反应的新抗原替代物对于肿瘤免疫治疗至关重要。
2023年12月13日中山大学宋尔卫/苏士成研究团队在Nature上发表了一篇题为“Tumour circular RNAs elicit anti-tumour immunity by encoding cryptic peptides”的研究论文。作者发现了一种由肿瘤特异性的环状RNA(circFam53b)编码的隐性抗原对人类白细胞抗原(HLA)具有很强的亲和力,可引起CD8 T+细胞的大量浸润,诱导抗肿瘤免疫,并且由circFam53b组成的疫苗能够有效抑制乳腺癌和黑色素瘤小鼠体内的肿瘤发生。研究结果为利用肿瘤特异性circRNA对恶性肿瘤进行免疫治疗提供了新的策略。值得注意的是,在该研究中,作者使用了汉恒生物提供的circRNA过表达慢病毒pHBLV-CMV-Circ-EF1-zsgreen-T2A-puro感染肿瘤细胞,使其表达circFam53b或circGigyf2并筛选稳转株,以研究circRNA的作用机制。
下面,我们一起来了解具体的研究内容:
作者首先用来自6名乳腺癌患者肿瘤样本进行HLA-I免疫沉淀,并进行质谱(MS)分析将MS结果与UniProt数据库、乳腺癌样本及其邻近正常乳腺样本的外显子测序(WES)、翻译组测序(Ribo-seq)和RNA测序(RNA-seq)数据进行匹配(图1a),并结合实时荧光定量PCR(RT-qPCR)实验结果,最终发现circFam53b(192-200,(ALFRLT-NRA)) 和circFam53b(210-218,RTAHYGTGR)对HLA- 1具有较强的亲和力(图1b-d)。
circFam53b来自基因组的非编码区,因此作者猜测它可能编码隐性抗原,即正常情况下不会引起免疫反应的抗原。为了证实这一猜测,作者对另外6个乳腺癌样本进行了HLA- 1 MS分析,并与去除rRNA后(rRNA-depleted RNA-seq)测序获得的circRNA图谱比对,在其中2个样本中检测到了circFam53b衍生肽,对HLA- 1具有很强的亲和力,免疫原性高(图1a)。此外,原位杂交(ISH)实验结果显示,circFam53b在乳腺肿瘤组织中表达,而在正常乳腺组织中未检测到(图1e)。以上实验结果表明circFam53b可能是TSA的候选肽。
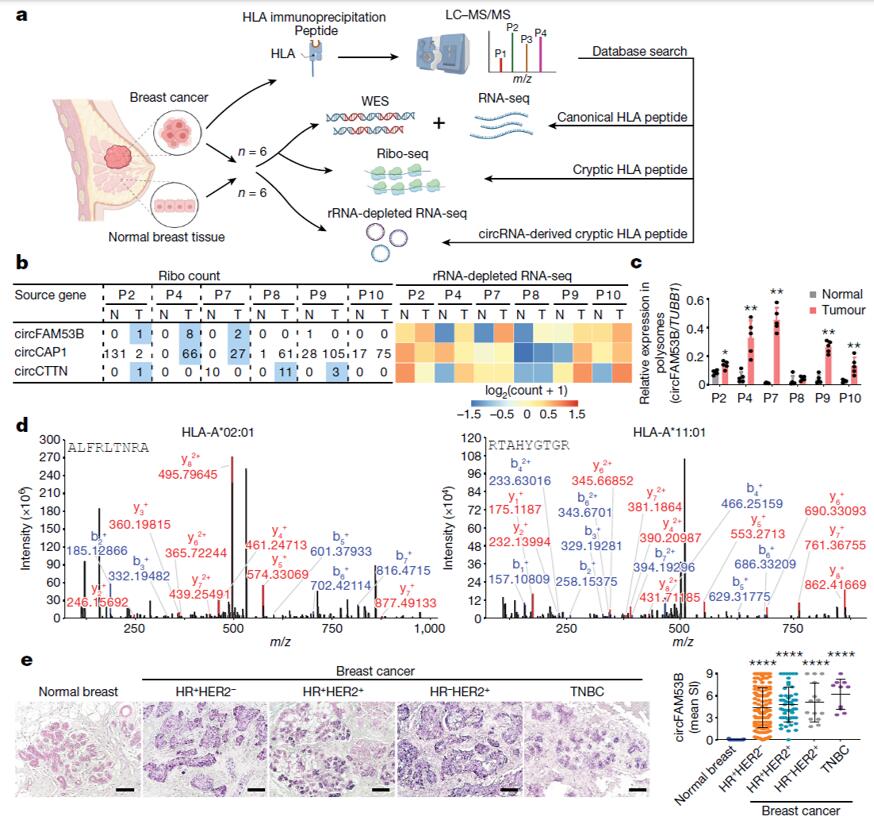
图1 肿瘤中的circFam53b是TSA候选物
基于以上发现,作者对circFam53b诱导抗肿瘤免疫的能力进行了研究。在circFam53b+乳腺癌细胞中,细胞因子(包括IFNγ、IL-2和TNF)显著增加(图2a-b)。转染circFAM53的树突状细胞(DC)诱导的效应性T细胞能够识别和裂解circFam53b+乳腺癌细胞(图2c),但不能识别circFam53b敲低的乳腺癌细胞(图2d)。这些数据表明,转染circFam53b的DC可触发先天性和适应性免疫反应,适应性抗肿瘤免疫可能依赖于特异性circRNA编码的蛋白。
为检测circFam53b在体内的免疫原性,作者将乳腺癌患者来源的异种移植物(PDXs)植入NOD/SCID小鼠体内,然后静脉输注自体DC和T细胞。与DC未转染linFam53b的小鼠相比,DC转染circFam53b 的小鼠肿瘤生长明显减缓(图2e)。随后作者从切除的异种移植物中分离并纯化了肿瘤浸润淋巴细胞。在体外用circFam53b+肿瘤细胞再刺激后,在带有circFam53b转染DC的小鼠中,CD4+T和CD8+ T细胞中IFNγ(图2g)以及CTL中穿孔素和GZMB(图2h)的表达量显著升高,表明肿瘤生长受到抑制。因此说明circFam53b具有较高的免疫原性和抗原特异性,可诱导抗肿瘤免疫。

图2 circFam53b引发抗肿瘤免疫
作者在circFam53b起始密码子上游发现了一个具有翻译活性的内部核糖体进入位点(IRES),该circRNA编码一个长度为219个氨基酸的多肽(circFam53b-219)。与其对应的线性mRNA翻译肽(linFam53b-422)相比,在ORF的跨越交界处有一个独特的39个氨基酸的肽段(circFam53b(181-219)),与linFam53b-422不同(图3a)。使用自制的针对circFam53b(181-219)尾部13个氨基酸(circFam53b(207-219))的多克隆抗体(anti-circFam53b-219)(图3a)进行WB验证,结果显示这个独特的肽段由circFam53b-219编码而非linFam53b。为进一步研究circFam53b编码肽的功能,作者使用合成的circFam53b(181–219)和linFam53b(264–302)肽段,通过将它们转染至HLA-A*02+患者的DCs中,并与原代CD4+T和CD8+T细胞培养。结果显示,circFam53b(181–219)肽段能够有效引导原始CD4+T和CD8+T细胞分化成效应T细胞,而linFam53b(264–302)肽段则不具备这一功能(图3b-d)。随后,为了验证circFam53b(192-200)是否诱导抗原特异性T细胞反应,作者使用circFam53b(181-219)肽脉冲或circFam53b转染DC,检测到circFam53b(192-200)-五聚体+ CTL的大量增加(图3e)。紧接着作者在动物体内验证circFam53b(181-219)隐肽是否能在体内引发抗肿瘤免疫。携带circFam53b+ 患者来源肿瘤异种移植(PDX)的小鼠输注自体T细胞和circFam53b(181-219)或肿瘤裂解物脉冲DC。与未经处理或linFam53b(264 - 302)脉冲DC相比,circFam53b(181-219)脉冲DC显著抑制肿瘤生长,且比肿瘤裂解物脉冲DC更有效(图3f)。此外,circFam53b(181 - 219)脉冲DC显著增强了PDX浸润的CD4+T和CD8+T细胞中IFNγ、穿孔素和GZMB的产生(图3g)。总之,这些发现表明circFam53b可以通过在体内编码抗原肽来驱动抗原特异性适应性抗肿瘤免疫。
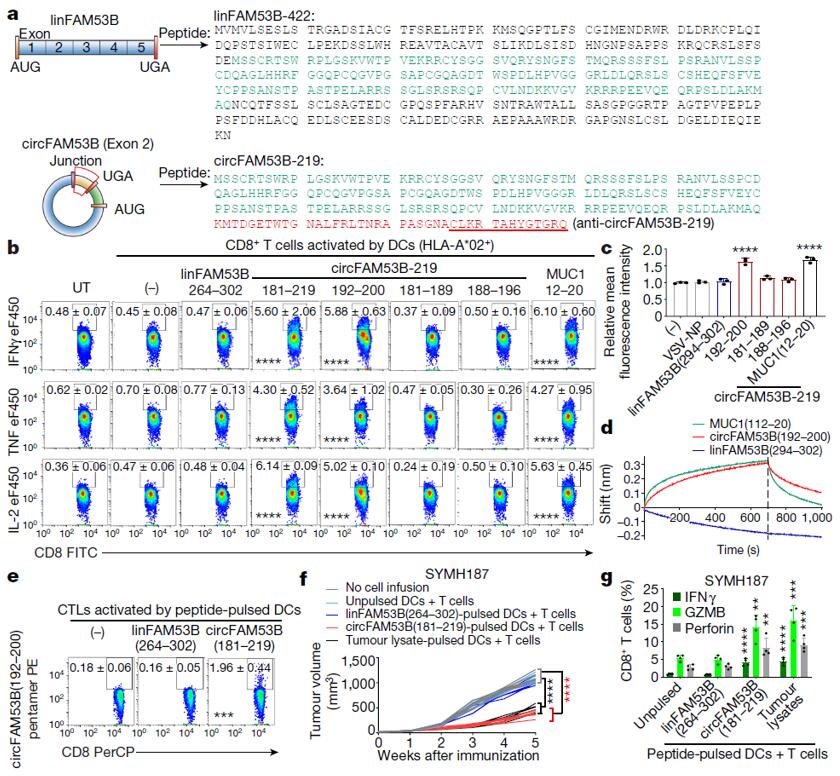
图3 circFam53b编码抗原肽
为验证以上研究发现是否具有临床相关性,作用分别利用RT-qPCR、ISH 和免疫组化染色(IHC)检测人乳腺癌样本中circFam53b的RNA和蛋白质水平。根据免疫治疗反应评分(IRS),355例原发乳腺肿瘤组织样本中均可检测到circFam53b-219,而在29例正常乳腺组织样本中未检测到(图4a)。RT-qPCR结果显示,乳腺癌组织中circFam53b-219肽的表达水平与其circRNA的转录水平呈正相关(图4b)。使用circFam53b(192-200)-五聚体和CD8抗体对来自乳腺癌患者的212个样本进行免疫染色,结果显示肿瘤中较高的circFam53b特异性CTL浸润与较高的circFam53b RNA和蛋白水平相关(图4c-d)。Kaplan-Meier生存曲线显示,circFam53b RNA和circFam53b-219肽的高表达与患者较好的存活率有关(图4e-f)。另外,作者在临床黑色素瘤样本中也检测到了circFam53b,circFam53b含量高的肿瘤体积小。这些发现表明circFam53b-219在乳腺癌和黑色素瘤中的表达增强适应性抗肿瘤免疫,癌症预后良好。
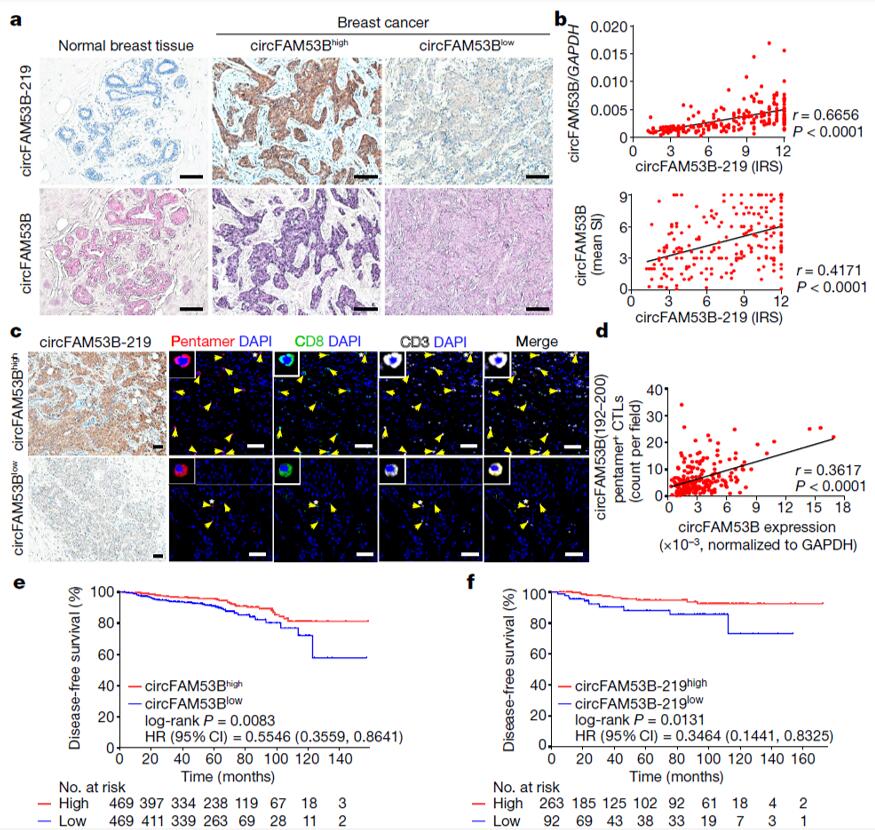
图4 circFam53b与较好的癌症预后相关
然后,作者针对circFam53b是否能够在小鼠中引发免疫反应进行了研究。由于在低免疫原性4T1乳腺癌细胞系中作者发现了另一种细胞质肿瘤特异性circRNA(circGigyf2)的丰富表达,所以作者构建了小鼠B16F10黑色素瘤模型和小鼠4T1乳腺癌模型。体外实验中,将转染circFam53b的骨髓源树突状细胞(BMDC)与小鼠的脾T细胞共培养,结果显示接种circFam53b的T细胞分泌了大量IFNγ,而接种linFam53b的则没有(图5a)。IFNγ、TNF和IL-2的流式细胞术结果表明,circFam53b转染的BMDCs的明显促进了circFam53b接种小鼠CD4+T和CD8+T细胞中细胞因子的产生(图5b)。此外,体外细胞毒性实验显示接种circFam53b的小鼠中CD8+ T细胞对B16F10表现出很强的细胞溶解活性(图5c),circGigyf2的相关实验结果与circFam53b类似(图5b-c)。随后,作者用circFam53b(181-221)肽与佐剂poly(I:C)免疫C57BL/6小鼠,并在体外用多种截短的circFam53b肽脉冲BMDCs与CD8+T细胞共培养。其中,circFam53b(181-221)和circFam53b(187-196)激活抗原特异性CD8+T细胞,细胞因子(IFNγ、TNF和IL-2)蛋白水平上升(图5d-e)。接种了circFam53b RNA和circFam53b(181-221)肽的小鼠中,抗原特异性circFam53b(187-196)-五聚体+CTL显著扩增(图5f)。circGigyf2及其编码的肽circGigyf2(82-104)在4T1乳腺癌小鼠中诱导抗原特异性T细胞的产生(图5g)。小鼠模型的实验数据表明,circRNA通过非经典翻译途径产生隐性抗原肽,从而引发免疫反应。

图5 circRNA在小鼠中引发免疫反应
上述验证实验之后,鉴于2022年北京大学魏文胜研究团队制备的circRNARBD疫苗可有效免疫新冠病毒,于是作者同样制备了circFam53b疫苗以评估circrna编码肽的治疗潜力。作者用circFam53b(181-203)和circGigyf2(82-104)分别免疫B16F10黑色素瘤小鼠和4T1乳腺癌小鼠,发现与单独接种佐剂poly(I:C)或相应的linFam53b(281-303)疫苗的小鼠相比,接种circFam53b的野生型肿瘤生长被显著抑制(图6a),接种circGigyf2(82-104)可显著减缓circGigyf2 野生型4T1乳腺癌肿瘤的生长,减少肺转移(图6a-c)。此外,接种circFam53b(181-203)或circGigyf2(82-104)增强了野生型肿瘤小鼠脾脏、原发肿瘤和肺转移灶中circFam53b(187-196)-五聚体+或circGigyf2(95-103)-四聚体+ CTL的浸润,但不影响天然免疫细胞的浸润(图6d)。随后,作者通过静脉注射脂质体包裹的circFam53b或circGigyf2分别对携带B16F10或4T1肿瘤同种异体移植物的小鼠进行免疫,发现小鼠体内肿瘤生长减缓和肺转移减少(图6e-f),脾脏中circRNA特异性T细胞的大量增加,并且在接种免疫原性circRNA的小鼠的原发肿瘤和肺转移瘤中富集(图6g)。综上所述,编码隐抗原肽的天然肿瘤特异性circRNA可以诱导肿瘤特异性T细胞的产生,从而有效控制癌症的生长和转移,表明circFam53b疫苗有希望应用于肿瘤免疫治疗。
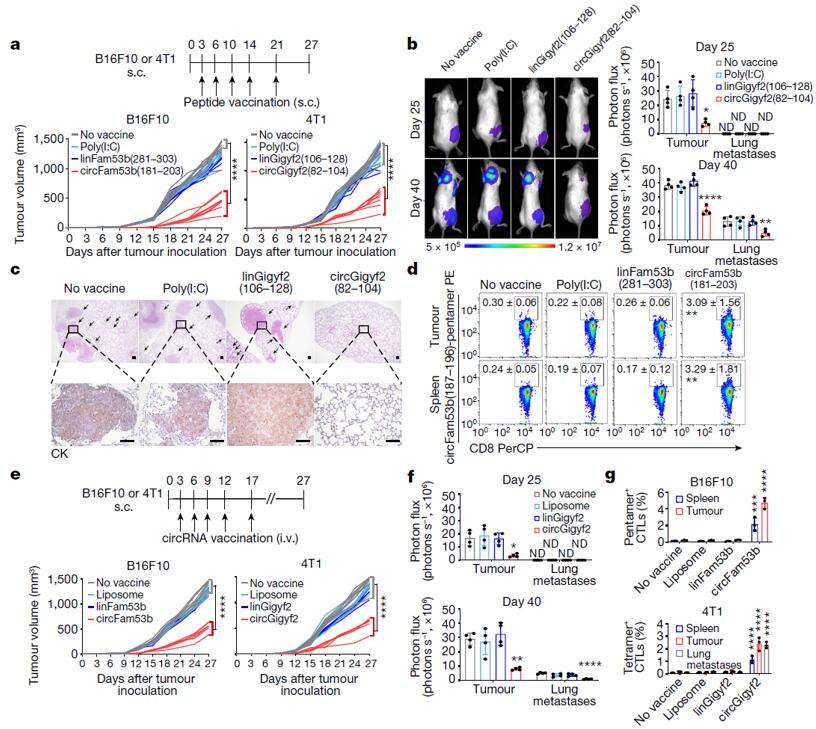
图6 circRNA疫苗抑制肿瘤进展
综上,该研究结果表明circFam53b编码的隐性抗原,免疫原性强,使用由circFam53b或其编码的隐性抗原制成的疫苗可以促进抗原呈递并刺激适应性免疫,从而有效地控制肿瘤进展。因此,作者认为肿瘤特异性circRNA疫苗在恶性肿瘤的免疫治疗方面具有巨大的潜力,之后需进一步的研究来评估治疗性circRNA癌症疫苗是否可以单独或与其他抗癌免疫疗法联合使用,以获得最佳的临床效益。
原文链接:https://www.nature.com/articles/s41586-023-06834-7

查看更多

查看更多

查看更多

联系我们

返回顶部