查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
骨关节炎(OA)是最常见的慢性致残性关节疾病,有多种风险因素,包括年龄、肥胖、创伤、遗传和性别,其中衰老是最突出的因素。软骨细胞是软骨组织中一种独特的细胞类型,随着年龄的增长,细胞衰老,并在OA发生过程中导致软骨合成代谢和分解代谢稳态失调。有研究表明靶向衰老细胞(SnCs)可能是OA治疗的一种有前途。然而,软骨细胞衰老的发生和调控机制尚未完全阐明。
2023年10月4日,南方医科大学李凯副研究员和白晓春教授团队在Nature Communications(IF=17.694)发表了题为“MYL3 protects chondrocytes from senescence by inhibiting clathrin-mediated endocytosis and activating ofNotch signaling”的研究论文,该研究发现MYL3通过抑制网格蛋白介导的内吞作用(CME)和激活Notch信号来保护软骨细胞免于衰老。值得注意的是,在本研究中,作者使用了汉恒提供的AAV-Myl3成功实现了Myl3在小鼠体内的过表达。
首先作者通过Alexa Fluor 594标记转铁蛋白(CME的标志物),研究了CME在软骨细胞衰老中的作用。第七代原代软骨细胞或者原代软骨细胞经H2O2 处理后显示出衰老表型,此时,作者在衰老的原代软骨细胞中观察到转铁蛋白摄取能力增强,这表明衰老软骨细胞的CME能力增强。此外,为了探索控制软骨细胞CME和细胞衰老的机制,作者对年轻(2月龄)和老年(12月龄)小鼠的关节软骨进行了全蛋白质组筛选。在鉴定的3171种蛋白质中,发现MYL3是老年小鼠软骨中肌球蛋白家族中下调最多的蛋白质。这些数据表明,CME在衰老软骨细胞中增强,而MYL3在衰老软骨细胞中减少。

图1 衰老软骨细胞中CME增强,MYL3表达降低
接着作者探讨了MYL3在CME和软骨细胞衰老中的作用。首先,通过对不同传代的软骨细胞中的MYO6和网格蛋白进行共染色来追踪CME,观察到第七代软骨细胞的CME升高。通过药理学或遗传学方法抑制CME降低了不同传代或H2O2刺激下衰老标志物的水平。这些数据表明,CME过程的抑制可以防止软骨细胞衰老。接下来,在MYL3敲低的软骨细胞中,作者发现转铁蛋白摄取比对照更强。为了探明MYL3如何调节CME,作者测试了MYL3是否与CME的两个主要调节因子MYO6或网格蛋白相互作用。免疫共沉淀分析显示,MYL3与MYO6相互作用,但不与网格蛋白结合。与对照相比,在H2O2刺激的软骨细胞中 MYO6和网格蛋白的相互作用和共定位增强。此外,在Myl3敲低后,也发现MYO6和网格蛋白之间的相互作用增强。使用IF双染色,证实了在第七代或H2O2刺激的软骨细胞中, MYO6和网格蛋白的共定位通过敲低Myl3而增强,并且当Myl3过表达时降低。这些数据表明,MYL3负调控CME,通过抑制MYO6和网格蛋白之间的相互作用来保护软骨细胞免于细胞衰老。
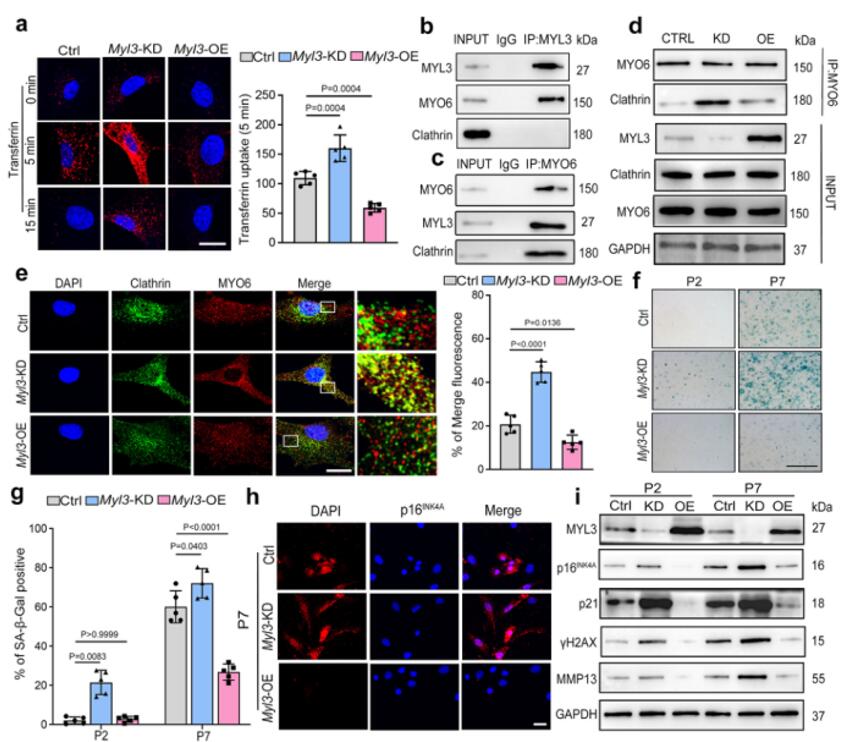
图2 MYL3负调控CME和软骨细胞的细胞衰老
作者构建了Myl3-KO条件敲除小鼠和Myl3-iKO诱导型条件敲除小鼠,分析了老龄 Myl3-KO 小鼠关节的组织病理学变化。与年龄匹配的对照组小鼠相比,6个月大的Myl3-KO小鼠软骨破坏严重,18个月大时变得更加严重,同时伴随着滑膜炎症的加重,但骨质增生的成熟度相当。IF和IHC分析证实,衰老(p16INK4a)、DNA损伤(γ-H2AX)和代谢标志物(MMP13)的表达显著增加,HMGB1的核水平降低。Myl3-iKO小鼠注射他莫昔芬后也观察到了相似的情况。这些结果表明,Myl3基因缺失会促进软骨细胞衰老,从而加速 OA 的发展。
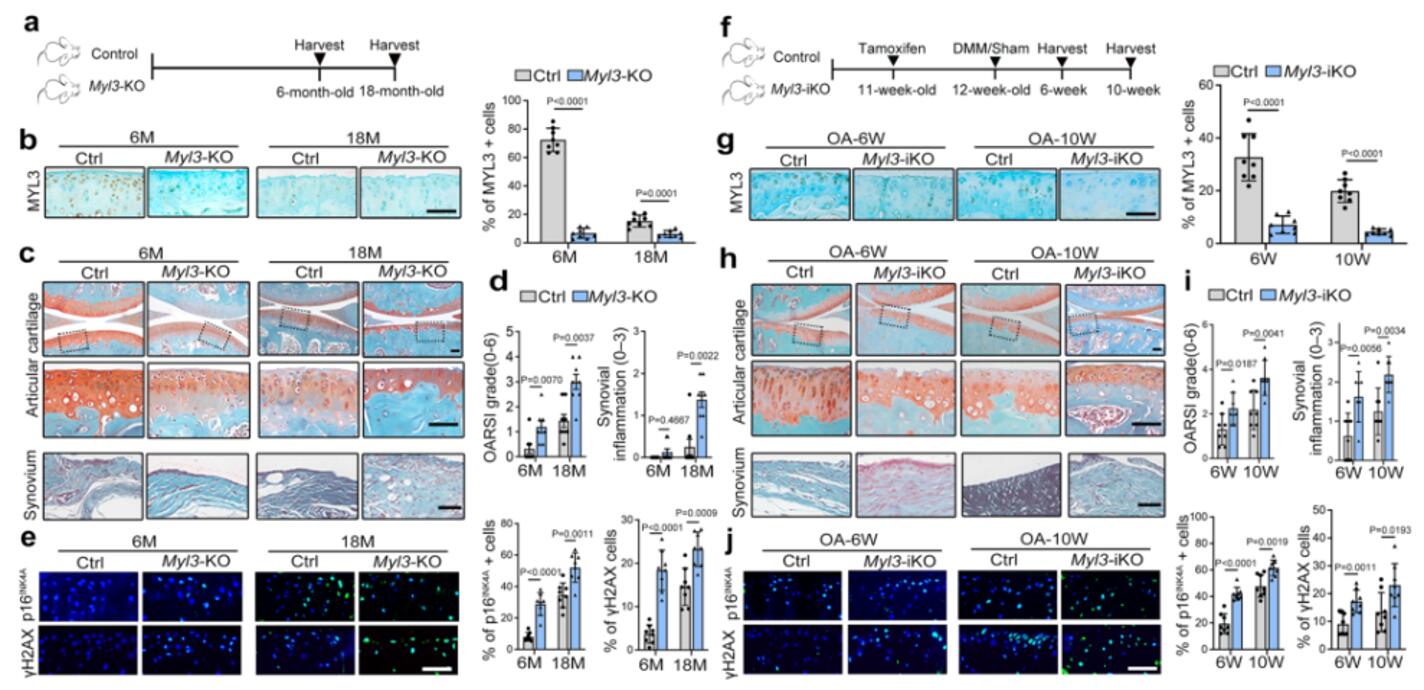
图3 软骨细胞中MYL3的缺失促进小鼠软骨细胞衰老和OA进展
为了探索上调的MYL3在软骨细胞和OA发病机制中的作用,将编码MYL3的过表达腺相关病毒注射到野生型小鼠关节中,在小鼠6个月和18个月大时分析关节组织病理学变化。组织学检查显示,与对照组相比,老龄Myl3过表达小鼠的软骨破坏和蛋白多糖损失显著改善。IHC检测显示,老龄Myl3过表达小鼠软骨细胞的衰老、DNA 损伤和分解代谢标志物减少,HMGB1的核表达水平升高。作者还分析了MYL3过表达对创伤后OA的影响。DMM手术后6周和10周,DMM诱导的软骨断裂均有所改善,滑膜炎症在术后10周得到改善。这些数据表明,过表达MYL3可通过抑制软骨细胞的衰老来改善小鼠与年龄相关和创伤后OA的表现。

图4 MYL3的过度表达减弱了小鼠与年龄相关和实验性OA的发展
为了更加全面探讨MYL3调节软骨细胞衰老的潜在机制,对来自MYL3-KO和对照小鼠的原代软骨细胞进行了RNA测序分析。在142个差异表达基因中,作者重点研究了最具有代表性的Notch转录因子。qRT-PCR和蛋白质印迹分析显示Myl3缺失增强了Notch相关基因(HES1、HEY1和NICD)和衰老相关基因(p16、p53)的表达。接着作者发现NICD与网格蛋白的共定位在衰老软骨细胞或Myl3-KO小鼠的软骨中增强,证实了Notch信号在衰老软骨中通过体内CME过程被激活。为了证实靶向MYL3和CME Notch信号在软骨细胞衰老中的关键作用,作者比较了Notch通路抑制剂RO4929097和CME抑制剂dynasol对MYL3-KO和对照小鼠创伤后或年龄相关性OA进展的保护作用。在手术后6周,关节内注射RO4929097和dynasol减轻了对照和Myl3-iKO小鼠的软骨破坏。这些数据表明,体内CME-Notch信号的药理学靶向将减少衰老软骨细胞的数量,最终缓解与年龄相关和实验性OA。
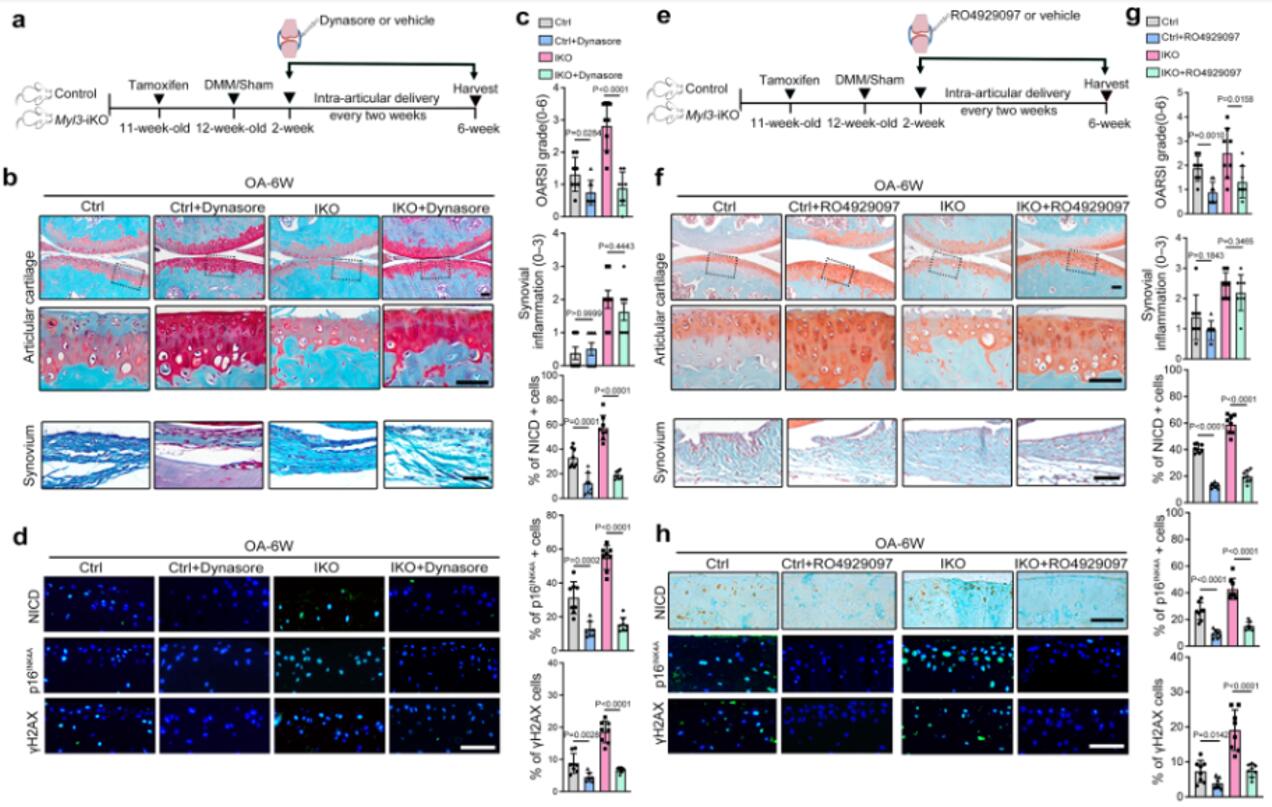
图5 靶向MYL3 Notch信号减轻年龄相关和实验性OA
综上所述,在OA发展过程中,软骨细胞中MYL3水平的降低增强了MYO6与网格蛋白的相互作用,并增加Notch受体的CME,激活Notch信号,触发软骨细胞衰老,促进软骨破坏,加重OA进展。补充MYL3和靶向阻断CME-Notch信号有效地改善了小鼠软骨细胞衰老和OA的发展。该研究建立了一个以前未知的细胞衰老的必要机制,并为OA提供了一个潜在的治疗方向。

查看更多

查看更多

查看更多

联系我们

返回顶部