查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
近几十年来,肝脂肪变性的全球患病率和发病率一直在上升,尤其是在中国和西方国家。肝脂肪变性是最常见的慢性肝脏疾病之一,通常与肥胖和胰岛素抵抗(IR)有关。肝脂肪变性的发病机制复杂,尚未完全阐明,但IR被认为是其发展的主要致病因素。在生理条件下,胰岛素可以抑制肝脏糖异生,促进肝脏脂肪的从头合成(DNL)以储存热量。在IR期间,胰岛素不能抑制肝脏葡萄糖的产生,肝脏DNL仍无限制地增加,胰岛素水平与肝脏脂质沉积之间存在正相关关系,但肝脏脂肪变性增加的机制尚不完全清楚。
2023年9月21日,山东第一医科大学附属省立医院赵家军教授团队在《Nature Metabolism 》在线发表题为“Upregulation of WDR6 drives hepatic de novo lipogenesis in insulin resistance in mice”的研究论文,该研究发现WD40重复序列的蛋白6(WDR6)在IR期间促进肝脏DNL。人WDR6蛋白是含有WD40重复序列(WDR)的蛋白,WD40重复序列是一个保守的蛋白质结构域,由40-60个氨基酸残基组成,它的基本功能是协调多种蛋白质复合物的组装,含有这种重复序列的蛋白质广泛分布在各种组织中。在本文中,作者发现WDR6在高脂饮食(HFD)诱导的IR期间上调,随后通过上调参与肝脏DNL的关键代谢酶——脂肪酸合成酶(FASN)促进肝脏DNL,作者还发现了一种天然小分子—XLIX,可以阻断WDR6的相关作用,从而减少IR期间的肝脏脂肪变性。总之,这些结果指出了WDR6 在IR状态下DNL升高过程中发挥的作用,并揭示了缓解脂肪肝疾病的潜在治疗途径。值得注意的是,本研究使用的特异性敲低小鼠肝脏WDR6的腺相关病毒(AAV2/8-TBG-shWDR6)来自汉恒生物。
接下来,我们一起看看研究结果:
首先,作者通过HFD建立IR小鼠模型,然后注射胰岛素,发现在HFD小鼠中FASN随着胰岛素的注入而升高,表明胰岛素在IR过程中仍然可以驱动该脂肪生成基因的表达。为了确定在IR状态下仍然对胰岛素有反应的基因,研究人员进行了肝脏转录组分析,通过分析差异表达基因结合RT-PCR,最终选择WDR6进行进一步的研究。在注射胰岛素或饥饿后重新喂食的情况下,WDR6蛋白水平均增加,此外,在非酒精性脂肪性肝病(NAFLD)小鼠肝脏中也观察到WDR6蛋白表达增加,这支持了WDR6参与肝脏脂质代谢的假设。
为了验证WDR6是否有助于IR诱导的肝脏代谢紊乱,作者使用了肝脏特异性的AAV病毒(AAV2/8-TBG-shWDR6)敲低小鼠肝脏WDR6的表达,注射后4周再喂食8周的HFD,通过超声分析、油红O染色、透射电镜等的分析发现,WDR6敲低小鼠的代谢紊乱以及肝脂质沉积得到改善,此外,作者用CRISPR-Cas9技术构建的WDR6敲除小鼠也得到了同样的验证结果。为了明确敲低肝脏WDR6是否可以改善HFD的不良反应,作者开发了一种治疗模型,即将AAV-shWDR6注射到已经喂食2周HFD的小鼠中,与注射对照病毒(AAV-shNC)的小鼠相比,shWDR6组HFD诱导的IR和肝脏脂质沉积减轻。综上所述,肝脏特异性抑制 WDR6可改善或逆转IR期间的代谢紊乱,尤其是肝脂沉积。
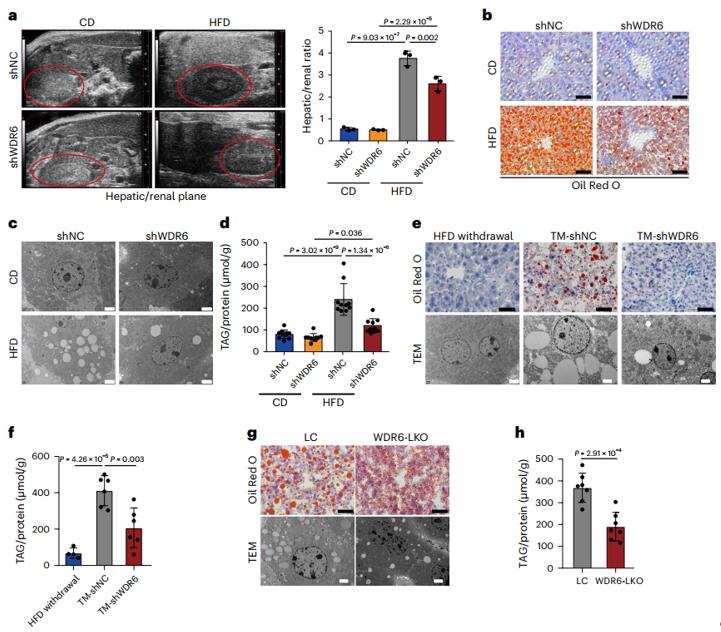
图1. 在HFD诱导的胰岛素IR期间,WDR6的肝脏特异性敲低可有效阻止肝脏脂质沉积
随后,作者分别对正常饮食组和HFD喂养组的shWDR6和shNC小鼠的肝脏进行脂质组学分析,以深入了解可能受WDR6影响的脂质代谢途径。发现组间差异最大的代谢产物是甘油三酯(TAG),因此,研究人员进一步评估了shWDR6和shNC小鼠中参与肝脏TAG代谢主要途径的各种代表性基因的表达模式,包括DNL、脂肪分解、游离脂肪酸氧化和摄取以及葡萄糖代谢的代表性基因,结果发现HFD组中shWDR6小鼠的DNL相关基因—Fasn在mRNA和蛋白质水平上均低于shNC小鼠,FASN酶活性也较低,而各组间葡萄糖代谢基因的转录没有明显差异。结合同位素分析新合成的棕榈酸(FASN的产物)的含量降低,表明WDR6在IR过程中促进肝脏DNL,而Fasn可能是主要靶点。为了确定WDR6介导的Fasn表达调控是否依赖于DNL的关键转录因子SREBP1c,作者在SREBP1c-KO小鼠的背景上过表达WDR6,尽管SREBP1c缺失可以减少TAG沉积,但WDR6过表达仍然可以增强SREBP1c-KO小鼠的肝脏TAG和FASN蛋白水平。这些结果表明,SREBP1c对于WDR6介导的Fasn表达和肝脏TAG沉积的调节作用不是必需的。
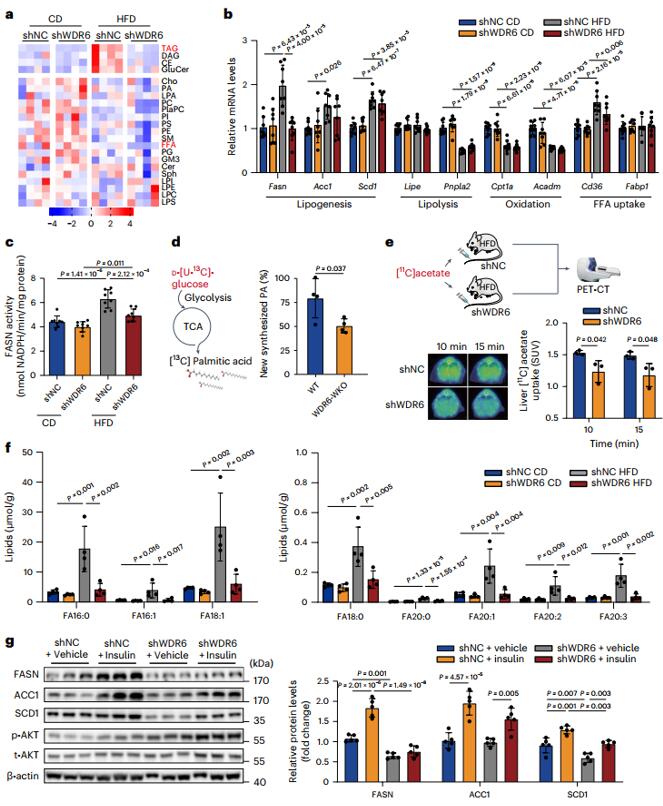
图2. 肝脏WDR6通过调节脂肪从头合成影响甘油三酯沉积
接下来,作者继续探索了WDR6调控Fasn表达的机制。作者对WDR6全身敲除的小鼠(WDR6-WKO)和WT小鼠的原代肝细胞进行转录组学分析,结果提示WDR6可能参与FASN翻译后调控过程。然后作者用免疫沉淀(IP)结合质谱确定了WDR6与PPP1CB结合,随后对WDR6-WKO和WT小鼠的原代肝细胞进行磷酸化蛋白组学分析发现,PPP1CB的第316位苏氨酸(Thr316)的磷酸化在WDR6-WKO的肝细胞中增加。接着,作者研究了磷酸化PPP1CB(Thr316)是否受到WDR6的影响,作者检测了WDR6肝脏特异性敲入小鼠(WDR6-LKI)和WDR6肝脏特异性敲除小鼠(WDR6-LKO)中PPP1CB的磷酸化水平,发现WDR6-LKI小鼠中较低,而WDR6-LKO中较高,同时测试了PPP1CB的磷酸化对外源性/内源性胰岛素的反应,他们发现,与对照组相比,HFD诱导的IR小鼠的PPP1CB磷酸化水平较低,此外,与正常喂养相比,禁食16小时后PPP1CB磷酸化水平升高并在重新喂养6h后急剧下降,上述处理中FASN水平与PPP1CB磷酸化水平显示出相反的变化。这些结果表明,PPP1CB(Thr316)磷酸化水平受WDR6、胰岛素和外部营养环境的影响。
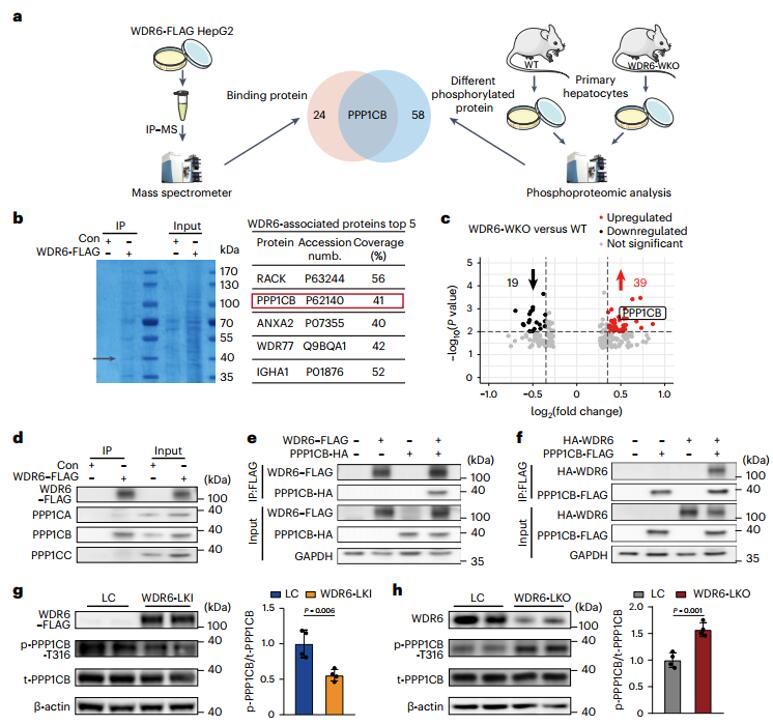
图3. WDR6与PPP1CB相互作用并促进PPP1CB在Thr316位点的去磷酸化
为了阐明PPP1CB在肝脏DNL中的生理功能,作者先用si-PPP1CB或PPP1CB-FLAG过表达载体转染HepG1细胞,发现FASN水平与PPP1CB呈负相关。然后,作者构建了PPP1CB的突变型过表达载体,其中Thr316被丙氨酸(PPP1CB-Thr316Ala)或天冬氨酸 (PPP1CB-Thr316Asp)取代,以分别模拟蛋白质的去磷酸化和磷酸化,发现PPP1CB去磷酸化后 FASN 水平升高,相反,PPP1CB磷酸化后 FASN 水平降低,随后,作者在小鼠肝脏中过表达PPP1CB-Thr316Asp并结合WB实验检测,结果表明,WDR6通过降低PPP1CB(Thr316)磷酸化水平,并在上游刺激因子1(USF1)的介导下促进Fasn基因的转录和脂肪酸的合成。
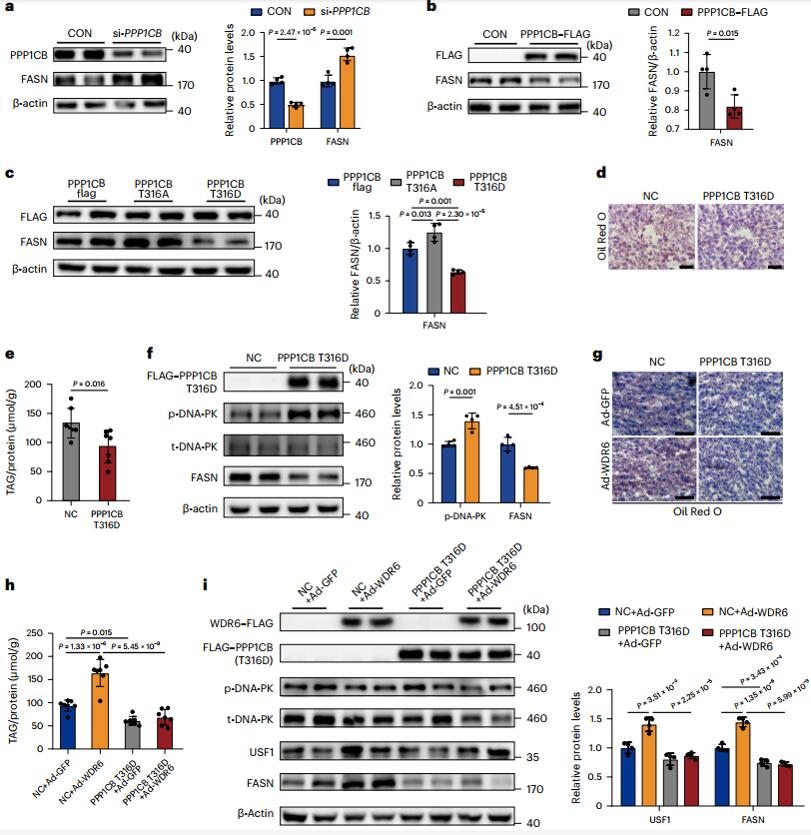
图4. WDR6 通过促进 PPP1CB 的去磷酸化来调节 FASN 转录
为了探索WDR6与PPP1CB相互作用的机制,作者使用了AlphaFold蛋白质结构数据库预测WDR6蛋白质的结构,然后基于预测的结果设计了一系列WDR6的截短体,IP实验表明,WDR6通过结合基序“FKSRSR”与PPP1CB结合。综上所述,WDR6介导的调节肝脏DNL通过其与PPP1CB的相互作用发生,以促进PPP1CB在Thr316位点的去磷酸化。
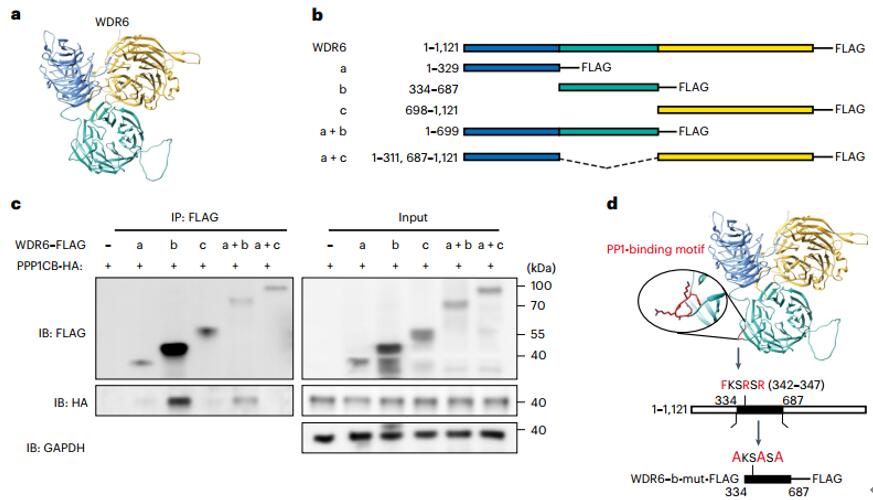
图5. WDR6通过FKSRSR基序与PPP1CB 相互作用
接下来,作者将研究结果扩展到了人类样本,检测了来自山东省立医院接受肝切除手术的肝胆肿瘤患者的20份肝组织样本的WDR6和FASN的蛋白质水平以及肝脏TAG含量,发现肝脏WDR6蛋白水平与肝脏TAG或FASN水平呈正相关,提示WDR6可能是肝脂肪变性的潜在治疗靶点,随后作者通过分子对接筛选出绞股蓝中的一个小分子化合物—XLIX可以与WDR6结合,并通过分子动力学模拟分析发现XLIX可以抑制WDR6与PPP1CB结合,然后作者在NAFLD模型和NASH(非酒精性脂肪性肝炎)模型中检测了XLIX的治疗效果。在NAFLD模型中,用XLIX治疗4周后(40mg/kg/天,腹腔注射),发现与对照组相比,XLIX治疗组的血脂和胰岛素敏感性有所改善,肝脂沉积和TAG水平降低,磷酸化PPP1CB增加,FASN水平降低,在NASH模型小鼠中也得到同样的验证结果,另外,NASH模型小鼠中促炎基因以及促纤维化基因的表达也有所减少。最后,作者在WDR6-LKI小鼠中进行XLIX处理,发现肝脏特异性过表达 WDR6减弱了XLIX减少肝脂积累的能力。总之,这些结果表明,XLIX通过抑制WDR6与PPP1CB结合以增加PPP1CB磷酸化的方式改善肝脂沉积并缓解疾病进展。
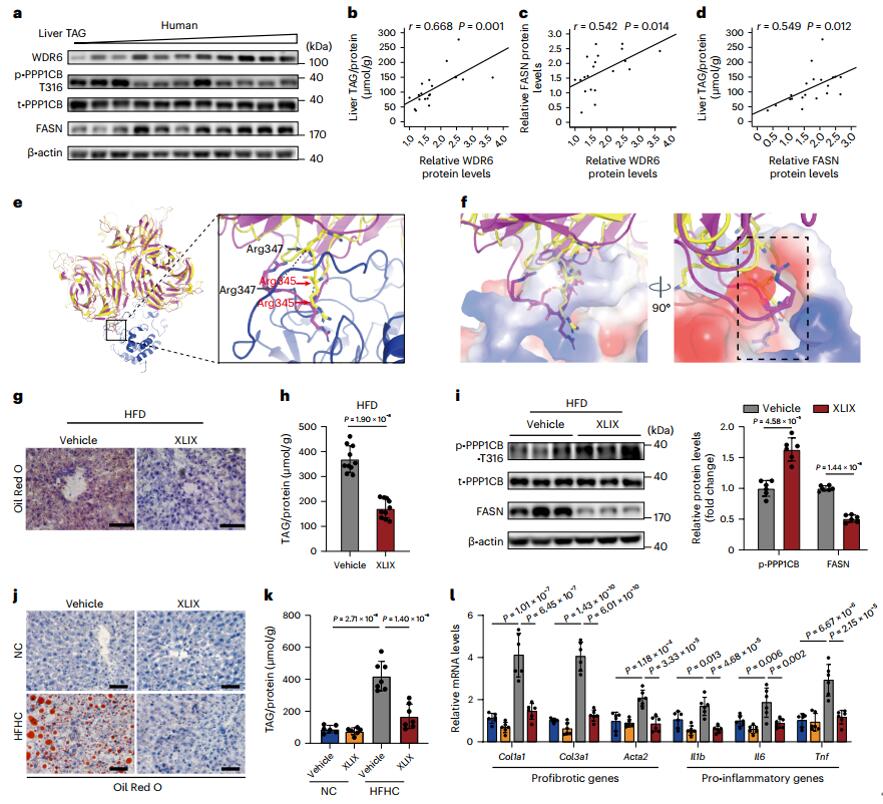
图6.WDR6可能是肝脂肪变性的潜在治疗靶点
综上所述,本研究发现了未报道过的肝脏DNL关键调节因子—WDR6,在胰岛素抵抗期间,肝脏WDR6上调,并通过促进PPP1CB的去磷酸化来上调FASN的表达最终促进肝脏DNL。更有科学价值的是,研究人员从中药绞股蓝中筛选并鉴定了抑制WDR6与PPP1CB结合的天然小分子—XLIX,可以有效改善胰岛素抵抗引起的肝脂沉积并缓解疾病进展,为NAFLD的预防和治疗提供了新的潜在干预靶点和治疗策略。

查看更多

查看更多

查看更多

联系我们

返回顶部