查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
镉(Cd)被国际癌症研究机构(IARC)列为I类人类肺癌致癌物,主要通过香烟烟雾表面扩散,有大量研究表明在肺癌的发展过程中circRNAs异常表达现象普遍存在,导致多种信号通路的激活,可能通过影响细胞功能发挥致癌或抗癌作用。
DNA碱基切除修复(BER)是一种高度保守的DNA损伤修复途径,对于不同类型的内源性和外源性DNA碱基损伤的修复至关重要。已有研究证明APEX1和XRCC1参与DNA损伤部位的损伤识别和碱基修复。基于circRNAs和DNA损伤的重要,广州医科大学附属第一医院的蒋义国教授带领的研究团队猜测circRNAs可能通过调节DNA修复在Cd诱导的肺癌中发挥作用。
2023年2月,蒋义国的研究团队在《ADVANCED SCIENCE》期刊发表题为“circCIMT Silencing Promotes Cadmium-Induced Malignant Transformation of Lung Epithelial Cells Through the DNA Base Excision Repair Pathway(circCIMT沉默通过DNA碱基切除修复途径促进镉诱导的肺上皮细胞恶性转化)”的研究论文。研究证明了circCIMT与APEX1相互作用,通过BER通路抑制DNA损伤,强调了表观遗传学在Cd诱导的肺癌中介导遗传损伤的作用。值得一提的是,该研究中使用了汉恒生物提供的用于沉默circCIMT和APEX1的慢病毒感染肺上皮细胞,以此来研究circCIMT和APEX1在肺癌发展过程中的作用。
首先,作者建立了小鼠慢性Cd接触模型,根据人体实时接触数据,让小鼠通过口鼻吸入等效实时接触浓度(0.640mg·m-3)的Cd 。Cd接触45周后,在小鼠血清中检测到高浓度的Cd(图1B),病理检查显示肺组织中出现大面积大核细胞、大面积嗜碱性细胞和异常增生(图1A)。另外,癌症干细胞(CSCs)的分子标志物Aldh1a1和Sox2的表达水平显著升高(图1C,D),肿瘤体积和重量明显大于对照组(图1I-K)。另外,作者还使用正常支气管上皮细胞株BEAS-2B和16HBE构建了体外cd诱导细胞恶性转化模型。通过估计接触香烟1年的人血液中Cd的累积浓度,最终选择低浓度(1 μM和10 μM)以研究慢性低剂量照射对细胞转化的影响。将BEAS-2B和16HBE细胞分别暴露于1 μM和10 μM Cd下,连续65周,实验结果显示Cd处理的细胞的增殖和迁移能力增强,侵袭增加,软琼脂克隆形成实验表明细胞克隆形成能力增强并且可形成球体(图1E-H)。体内和体外实验结果表明,长期接触低浓度Cd中会促进小鼠肺支气管上皮细胞的恶性转化和恶性病变。
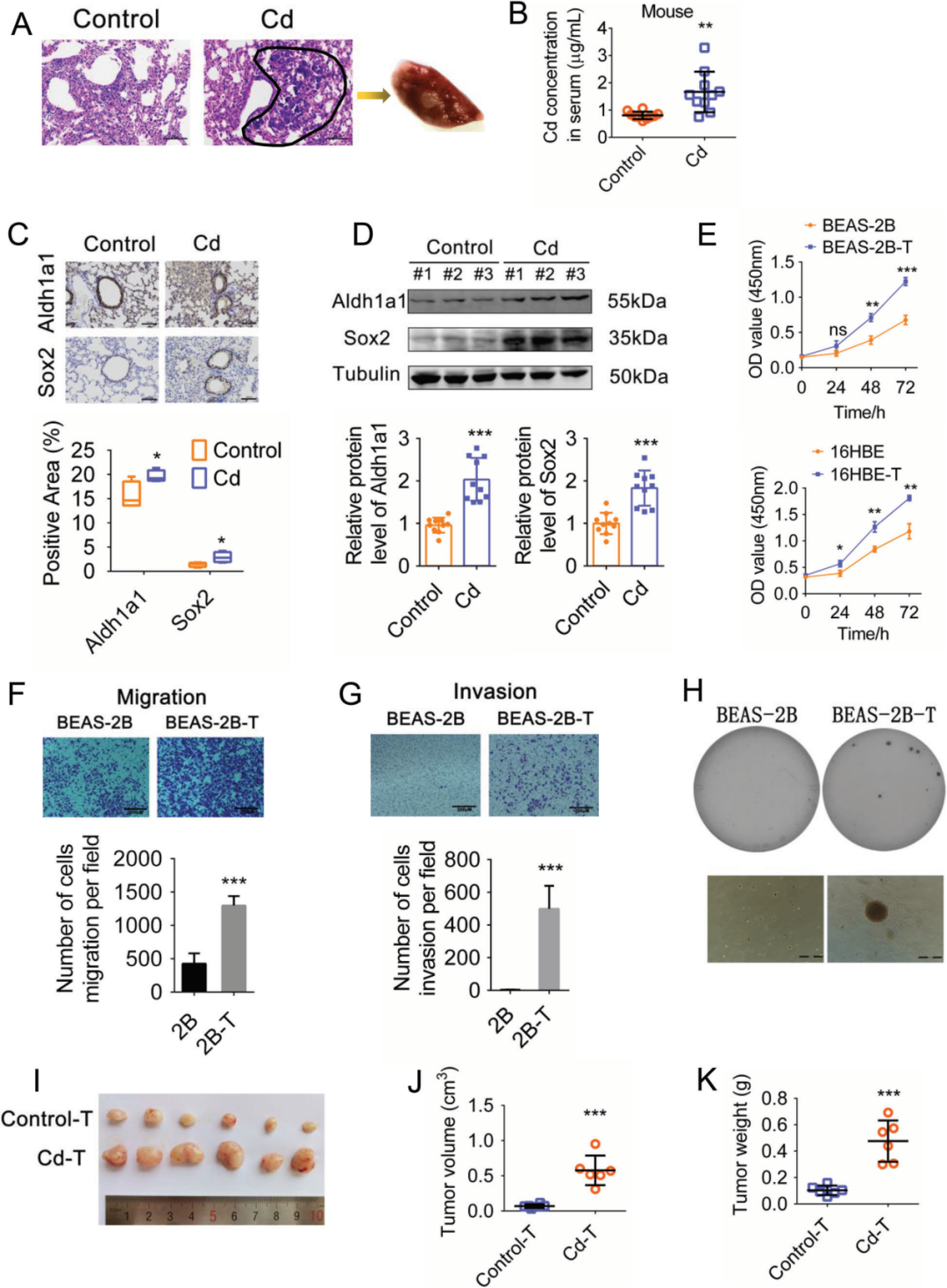
图1慢性低剂量镉暴露可导致小鼠肺部恶性病变和支气管上皮细胞恶性转化
接着作者试图探索circRNA在Cd诱导的肺癌中的作用,通过对接触Cd 10周后的BEAS-2B细胞进行全转录组测序分析,发现novel_circ_004401(circCIMT)下调最为显著。通过检测肺癌患者体内以及注射Cd后的小鼠体内的Cd和circCIMT水平,发现circCIMT与Cd浓度呈负相关(图2A-E)。作者构建了circCIMT的干扰和过表达模型进一步研究circCIMT的作用,发现circCIM沉默后,Cd处理的BEAS-2B细胞的迁移和侵袭能力增强,提高了Cd处理的BEAS-2B细胞的扩增能力,软琼脂克隆形成实验表明细胞克隆形成能力增强,而circCIMT过表达则具有相反的效果(图2I-M)。以上实验结果表明circCIMT负向调节Cd处理的细胞的生长。
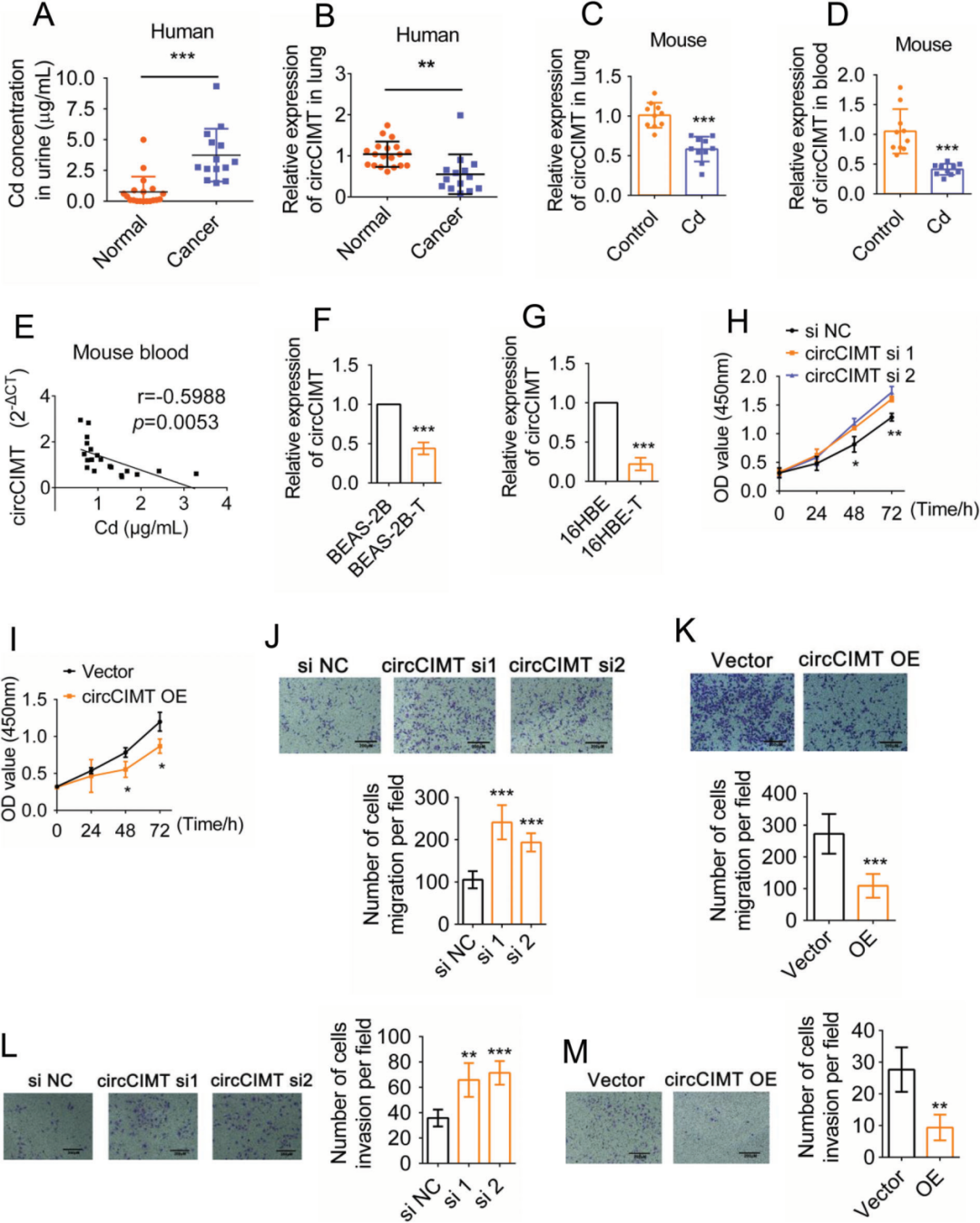
图2 circCIMT在Cd诱导的恶性转化模型中的表达和功能
作者通过基因富集分析接触Cd 10周的BEAS-2B细胞发现DNA损伤反应基因γ-H2AX表达水平增加,彗星实验中DNA的橄榄尾矩(OTM)增加,表明接触Cd会导致DNA损伤。因此,作者试图确定circCIMT在Cd诱导的DNA损伤中的作用以研究circCIMT在Cd诱导的肺癌转化中发挥作用的机制。作者设置了实验组BEAS-2B细胞(接触Cd)和对照组(不接触Cd),分别敲低和过表达circCIMT,发现对照组敲低和过表达circCIMT前后没有变化,而实验组中沉默circCIMT可以观察到γ-H2AX表达水平增加,OTM增加,过表达circCIMT则相反,表明circCIMT可以抑制暴露于Cd时肺上皮细胞的DNA损伤。
而circCIMT是如何介导DNA损伤反应的呢?RNA Pull-Down实验发现参与DNA损伤修复的蛋白APEX1富集在circCIMT下拉蛋白复合物中(图3A,B),由此猜测circCIMT通过APEX1影响DNA损伤。作者发现,小鼠停止吸入Cd后,肺组织中的APEX1表达水平显著下降,其表达水平与circCIMT的表达呈正相关(图3D,E)。敲低APEX1导致细胞接触Cd期间γ-H2AX表达增加,而过表达APEX1则相反(图3F,G)。当细胞接触Cd时,同时敲低circCIMT和APEX1比单独敲低circCIMT或APEX1的DNA损伤更严重(图3I)。由此可得,APEX1是circCIMT调控DNA损伤的关键分子。
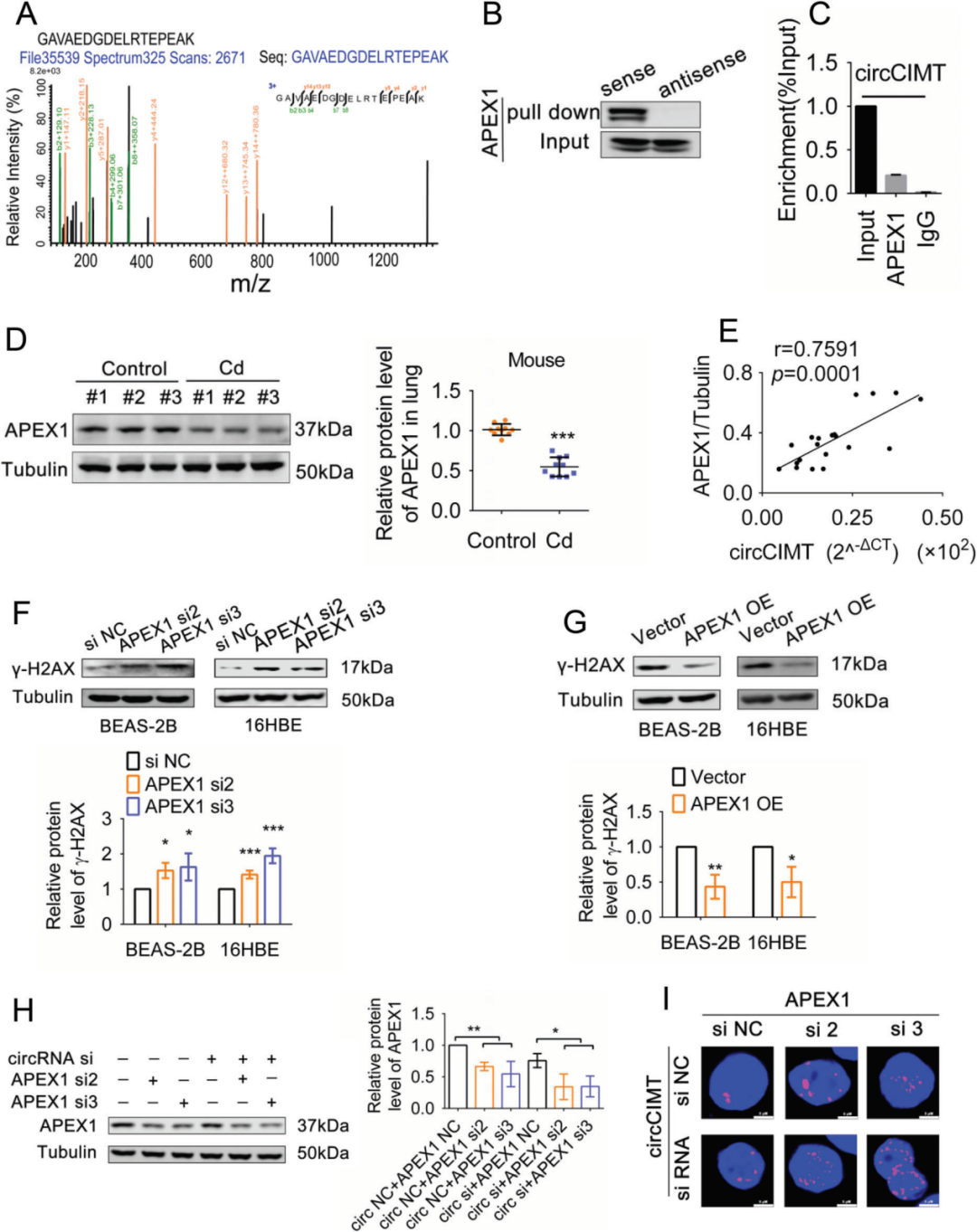
图3 circCIMT与APEX1相互作用抑制DNA损伤
APEX1是一种核酸内切酶,参与DNA损伤部位的损伤识别和碱基修复,已得出APEX1是circCIMT调控DNA损伤的关键分子,所以作者接着研究了circCIMT和BER蛋白在Cd诱导过程中的调控关系。Cd暴露期间,细胞中BER蛋白(如XRCC1、PARP1和LIG3)表达水平均下降,表明Cd暴露损害BER通路,而过表达circCIMT后BER复合蛋白的表达显著增加,同时γ-H2AX的表达降低(图4A-C),敲低circCIMT则抑制BER复合蛋白的表达(图4D-F)。免疫荧光染色显示APEX1、XRCC1、PARP1和LIG3主要在细胞核中表达(图4G),分离细胞核和细胞质蛋白,发现敲低circCIMT导致细胞核中BER通路蛋白显著减少,而对细胞质中的这些蛋白表达水平无显著影响(图4I)。这些实验结果表明,circCIMT干扰通过降低核BER通路蛋白的表达来抑制DNA损伤反应。
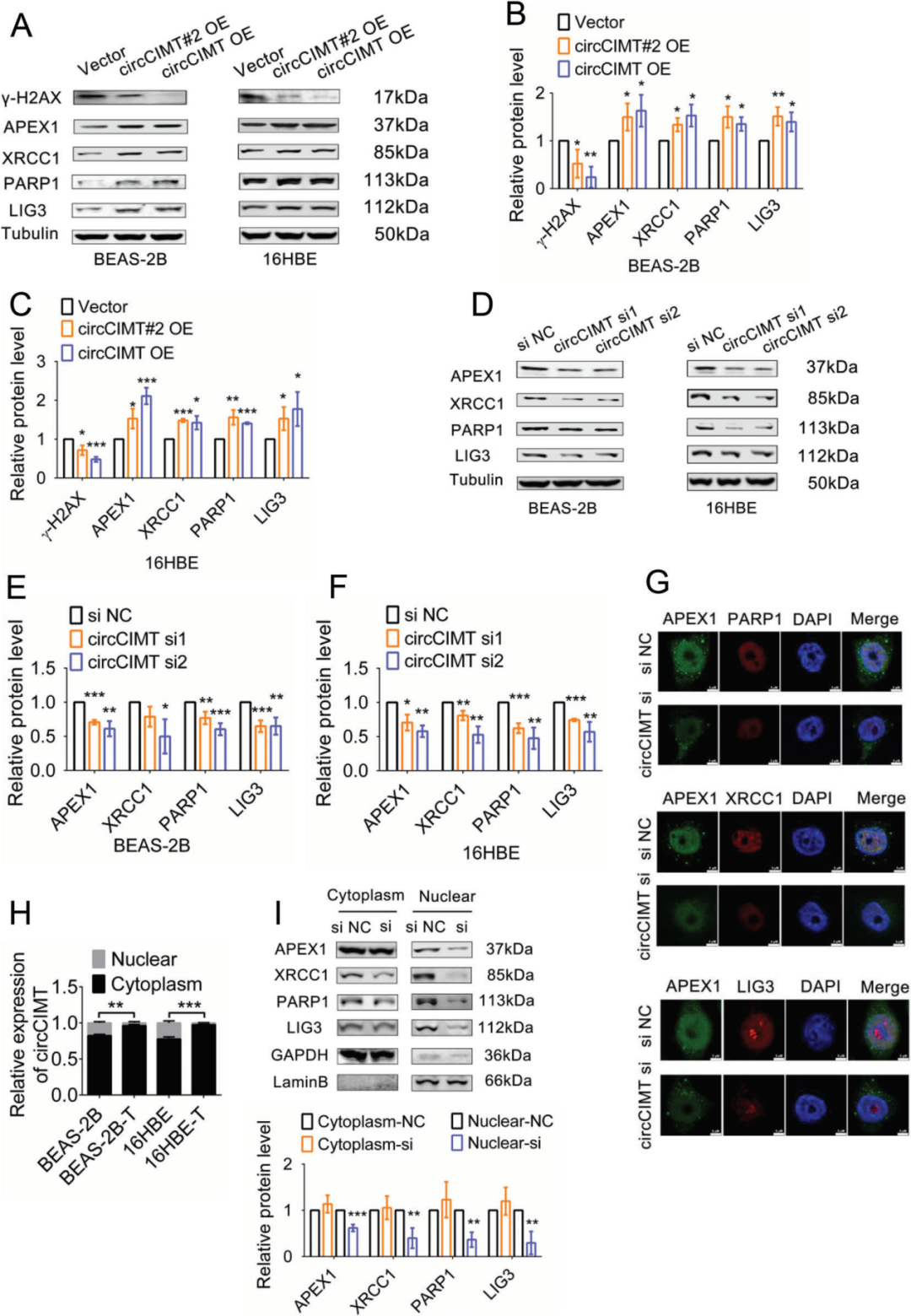
图4 circcimt干扰抑制Cd暴露后核碱基切除修复(BER)复合蛋白的表达。
KEGG富集分析散点图显示多个基因与CSC相关通路相交,包括Gsk3b、Notch2、Pik3cb、Myc、Cdkn1a和Smad3,在人类样本的肺癌组织中也观察到了Pik3cb、Myc和Cdkn1a的高表达(图5A,B)。作者在持续接触Cd的细胞中同时敲低circCIMT和APEX1,发现CSC相关通路基因(Pik3cb、Myc、Cdkn1a和Smad3)稳定上调(图5C-F),持续基础15周后,细胞增殖水平增加(图5G),接触20周时,软琼脂克隆形成实验表明细胞克隆形成能力增强(图5H),异种移植小鼠模型结果显示同时敲低circCIMT和APEX1促进Cd诱导的恶性转化和细胞生长(图5I-K)。以上结果均表明,在接触Cd的细胞中,circ CIMT和APEX1的下调不仅促进了肿瘤相关基因的表达,而且显著缩短了细胞发生恶性转化的时间。
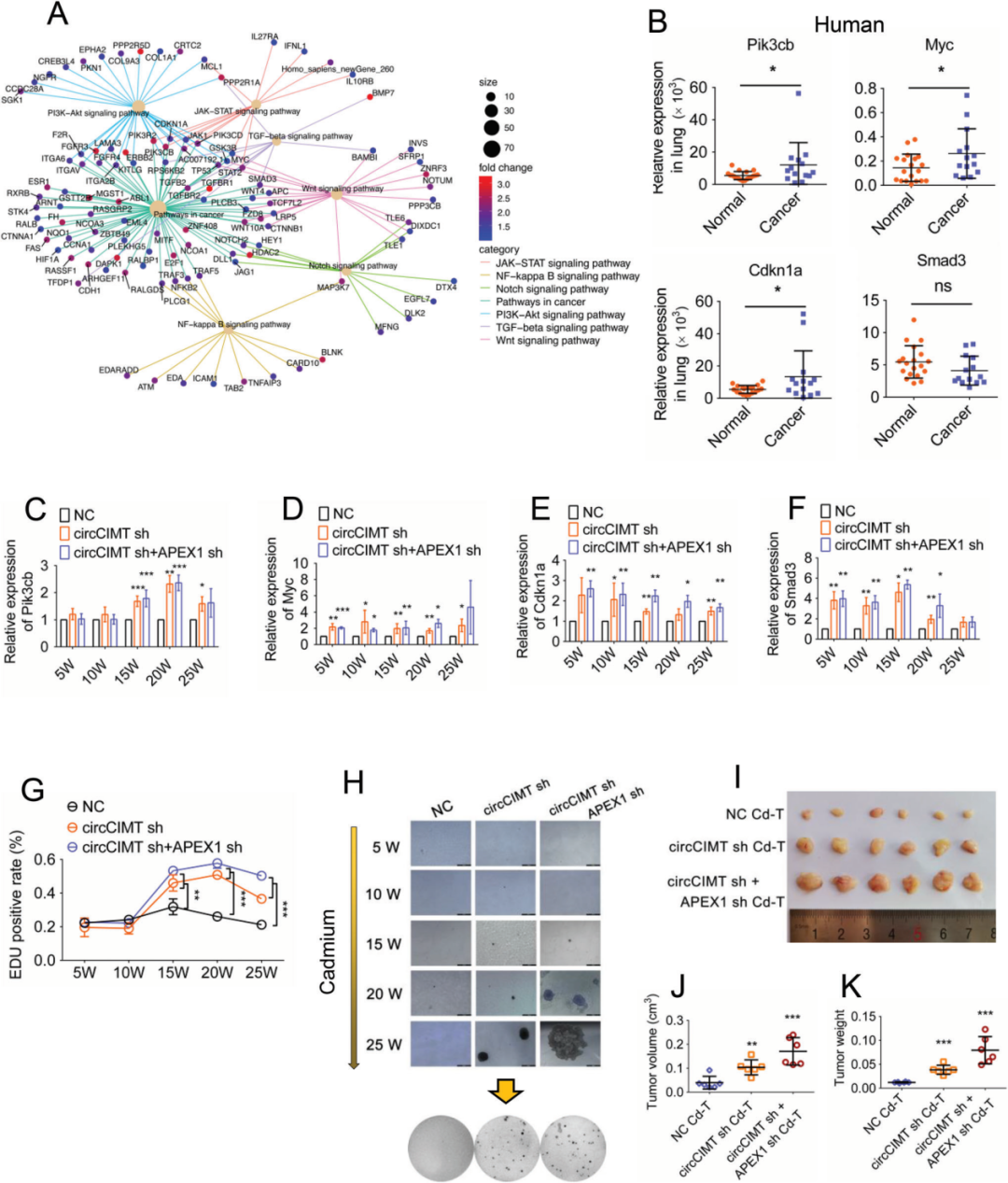
图5同时敲低circCIMT和APEX1促进肿瘤相关基因的表达和细胞的恶性转化
综上,该研究阐明了circCIMT在镉诱导的肺癌中的作用,circCIMT通过与APEX1结合,介导DNA碱基切除修复通路减少DNA损伤,从而抑制镉转化细胞的迁移和侵袭能力,证实了circCIMT通过调节DNA损伤影响化学致癌的发生,提供了circCIMT作为Cd诱导恶性转化的调节因子的表观遗传学证据,为识别肺癌中的关键遗传-表观遗传-环境相互作用提供了新的见解。

查看更多

查看更多

查看更多

联系我们

返回顶部