查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2023年2月20日,南京大学闫超、陈迪俊及刘翔宇团队合作在Nature Neuroscience(IF=28.776)上发表了题为《Lipid-accumulated reactive astrocytes promote disease progression in epilepsy》的研究论文,该研究发现在颞叶癫痫(TLE)患者和癫痫小鼠模型中,星形胶质细胞中过度的脂质积累导致反应性星形胶质细胞(LARAs)的形成,这是一种新的反应性星形胶质细胞亚型,其特征是APOE表达升高。文中使用了汉恒生物的在体研究工具产品:AAV2/9-gfaABC1D-A2AR-shRNA-eGFP,用于星形胶质细胞中A2AR的特异性敲低。
癫痫是最常见的神经系统疾病之一,约30%的患者最终发展为耐药癫痫,并伴有不可预测的复发性癫痫发作,除了手术外,治疗选择有限。致癫痫灶内的神经元死亡和神经胶质瘢痕的形成是耐药性癫痫的两个主要病理组织学特征。反应性星形胶质细胞是神经胶质瘢痕的主要细胞成分,与阿尔茨海默病(AD)、帕金森病(PD)和多发性硬化症(MS)等几种中枢神经系统疾病的神经元活动和神经元死亡有关。然而,与癫痫相关的反应性星形胶质细胞的分子特征及其对疾病病理的贡献尚不清楚。
在这项研究中,研究者在癫痫患者的大脑中发现了一种新的反应性星形胶质细胞状态,它们积累脂滴(LD)。这些LARAs以APOE依赖的方式形成,表现出独特的转录特征,并加剧了神经元的过度兴奋性。干预神经元-星形胶质细胞的脂质转移或脂质代谢可减少LARA的形成并减轻癫痫发作症状。这些发现表明,LARAs代表了癫痫患者大脑中一种功能失调和潜在靶向的反应性星形胶质细胞状态。
下面,我们一起来了解具体的研究内容:
1. 颞叶癫痫患者脑内脂质积累异常
研究者首先通过分析耐药TLE患者的磁共振波谱(MRS)数据,研究是否可以观察到癫痫患者的大脑中异常的脂质积累,这是最常见的局灶性癫痫形式。与同一参与者的对侧正常侧相比,TLE患者的致痫灶的脂质信号明显增加,表明癫痫脑内脂质异常积累。然后检测LD累积情况,发现在TLE参与者的神经元(NeuN+)和星形胶质细胞(GFAP+)中,LD形成显著增加。TLE参与者的脂质水平显著高于正常对照组。这些数据表明,致痫灶异常脂质积累是耐药TLE患者的一个重要病理特征。
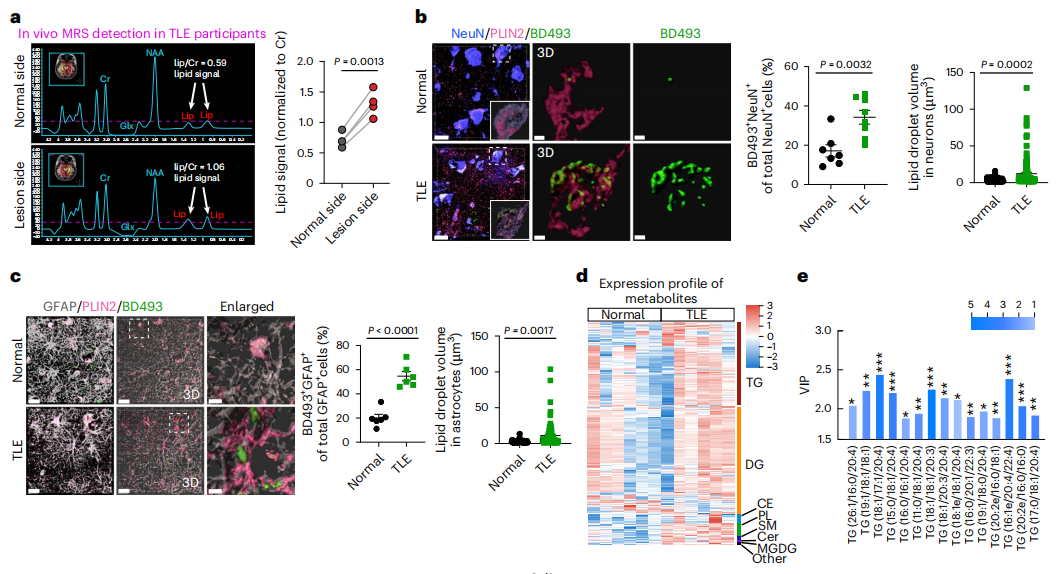
图1 癫痫患者脂质积累异常
2. 癫痫模型脂质积累
上述临床观察结果在经典红藻酸(KA)诱导的小鼠癫痫模型中得到证实。KA诱导的局灶性癫痫模型建立成功后,研究者使用MRS来定量小鼠大脑中的脂质水平。在注射后24h(急性)和3周(慢性),癫痫小鼠海马的脂质信号显著升高。为了更好地模拟TLE参与者的全身性慢性癫痫发作,研究者用腹腔注射(i.p.)KA刺激小鼠。C57BL/6小鼠i.p.注射后约20 min发生急性癫痫发作,注射KA后2至3周内慢性反复发作。在慢性阶段,小鼠海马PLIN2/BD493染色和电镜均显示LD在神经元和星形胶质细胞中积累。人类和小鼠的数据都表明,大脑中过度的脂质积累是癫痫的一个重要病理特征。
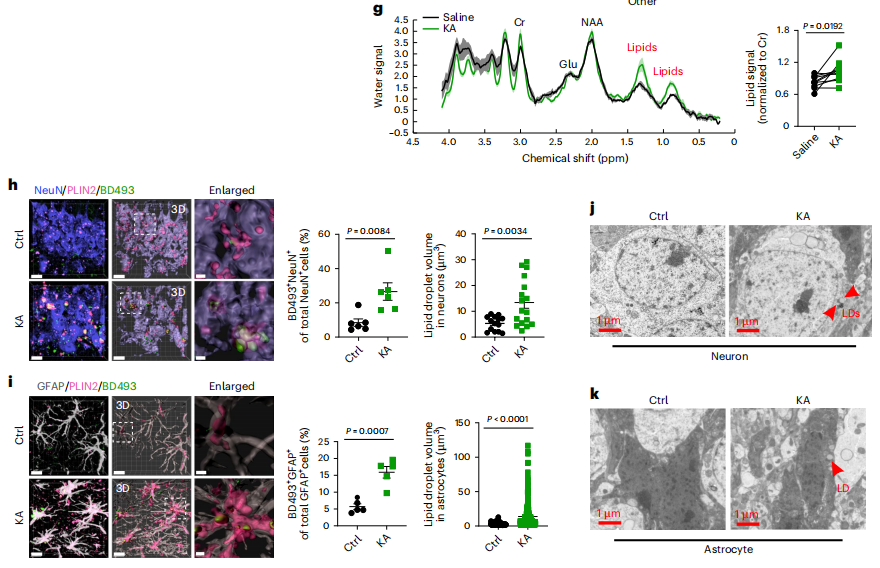
图2 癫痫小鼠模型脂质积累异常
3. 颞叶癫痫患者的单核RNA测序
为了检测异常的脂质积累是否会导致癫痫患者大脑的脂质代谢改变,研究者使用新鲜收集的TLE参与者和年龄匹配的非TLE对照组的皮质样本进行了单核RNA测序(snRNA -seq)。星形胶质细胞通过典型标志物GFAP、FGFR3、GJA1、AQP4和ALDH1L1的表达来定义。对snRNA-seq数据的基因富集分析显示,星形胶质细胞中脂质转运相关和代谢相关通路明显激活,而在神经元中仅中度激活。然后,研究者在星形胶质细胞簇中的TLE参与者和对照组之间进行了差异表达分析,并确定了一组与脂质感知、运输、存储和水解相关的上调基因。其中,脂质转运基因APOE(编码载脂蛋白E)是星形胶质细胞中TLE参与者和对照组之间表达差异最大的基因之一。与对照组相比,星形胶质细胞中APOE蛋白表达更高。免疫印迹法也证实了TLE参与者样本中APOE表达的升高。与患者的结果相似,KA诱导的癫痫小鼠海马星形胶质细胞中APOE的表达也显著上调。
综上所述,这些数据表明癫痫患者的大脑中与疾病相关的星形细胞脂质代谢功能障碍,并确定APOE是参与这一过程的关键基因。
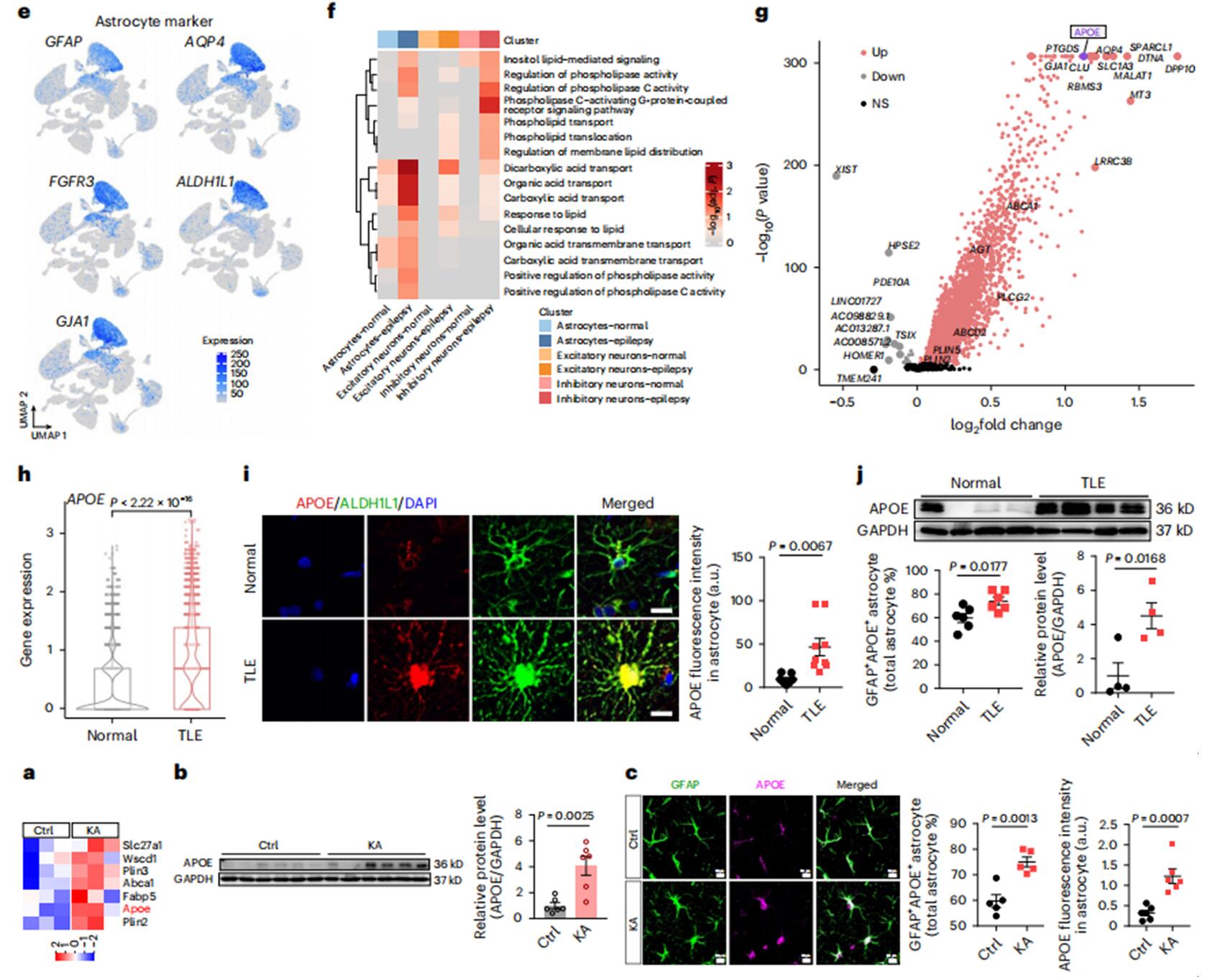
图3 癫痫患者和癫痫小鼠模型的星形胶质细胞脂质代谢异常和APOE上调
4. APOE介导脂质从神经元转移到星形胶质细胞
在大脑中,APOE蛋白主要由星形胶质细胞产生,是脂质运输的主要载体。为了揭示APOE在癫痫中的作用,研究者首先用KA(i.p.)诱导癫痫。并评价APOE敲除(KO)对KA刺激21 d后小鼠海马脂质积累的影响。与野生型癫痫小鼠相比,APOE敲除对KA刺激小鼠海马神经元LD形成的影响较小;然而,APOE−/−癫痫小鼠海马星形胶质细胞中的脂质积累被阻断,表明APOE是星形胶质细胞中脂质积累所必需的,而在神经元中不是。因此,研究者假设,在慢性癫痫条件下,脂质最初在神经元中积累,然后通过APOE依赖的机制不断转移到星形胶质细胞中。为了进一步证明这一点,研究者比较了野生型癫痫小鼠(静脉注射后21d)中APOE不同表达水平的星形胶质细胞中的脂质积累情况;APOE阳性(APOE+)星形胶质细胞比APOE阴性(APOE−)星形胶质细胞显示出更高的脂质积累水平。
然后,研究者通过将ALDH1L1- CreERT2小鼠与APOE-floxP小鼠杂交,生成了APOE的星形细胞特异性条件敲除(cKO)。与APOE−/−小鼠类似,星形细胞在KA刺激下,特异性APOE细胞cKO小鼠在星形胶质细胞中LD积累显著减少,但在神经元中没有。总之,这些数据表明,星形胶质细胞APOE介导了癫痫条件下脂质从神经元到星形胶质细胞的主动运输。
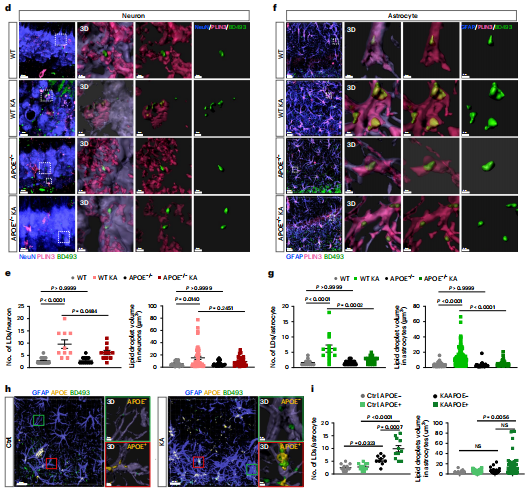
图4 星形胶质细胞的脂质积累需要APOE介导
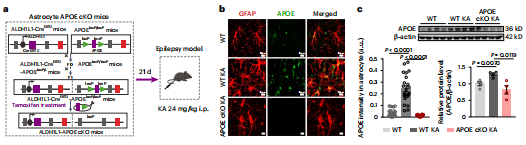
图5 生成APOE的星形细胞特异性条件敲除(cKO)小鼠
5. 颞叶癫痫患者反应性星形胶质细胞的分子图谱分析
研究者接下来探讨星形胶质细胞中异常的脂质积累是否与癫痫中的星形胶质细胞反应性有关。为了准确定义TLE参与者的反应性星形胶质细胞亚型,研究者使用snRNA-seq数据对星形胶质细胞簇进行了亚群分析。进一步将星形胶质细胞群体划分为6个亚聚类(A1-A6)。GO通路分析显示,脂质转运相关通路主要富集在A4亚簇中,APOE表达水平很高。APOEhi A4亚簇显示出一个独特的上调基因亚集,其中许多与脂质转移和代谢有关,如CLU、PTGDS和PLCG2,这是一个转录组特征,与以前报道的反应性星形胶质细胞亚型不同的转录组特征。因此,研究者将A4亚群指定为LARAs。

图6 反应性星形胶质细胞的分子图谱分析
6. APOE是小鼠模型中脂质积累的反应性星形胶质细胞形成所必需的
为了检测LARA的形成是否需要APOE,研究者在野生型和APOE−/−小鼠的海马中进行了转录组分析,分别检测了对照组和KA组75个LARA相关基因的表达。基因聚类分析显示,大多数被检测的基因都有明显的逆转模式。统计分析显示,75个基因中有65个(86.7%)在KA刺激下发生了显著变化,并被APOE-KO恢复。这些数据表明,APOE介导的星形胶质细胞中的脂质积累导致了小鼠癫痫模型中LARA的形成。
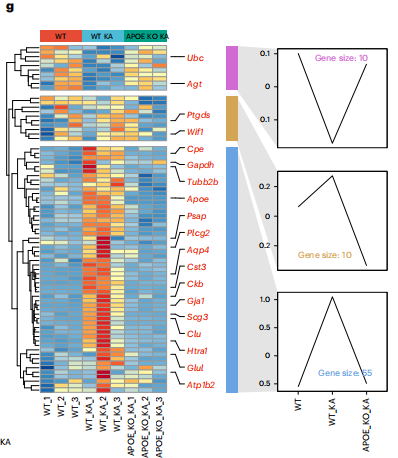
图7 APOE介导脂质积聚反应性星形胶质细胞的形成
7. 脂质积累的反应性星形胶质细胞与癫痫小鼠的癫痫发作活动有关
在功能上,反应性星形胶质细胞已被证明可促进AD和MS患者的神经炎症或神经元丢失。研究者假设,TLE相关的LARAs可以促进神经元放电,并加剧癫痫的持续病程。为了证明这一点,研究者首先比较了野生型和APOE cKO小鼠之间的KA诱导的癫痫症状。与KA刺激的野生型小鼠相比,APOE cKO小鼠的Racine评分较低,发作频率降低,发作持续时间较短。由于LARA的形成依赖于APOE,这些结果表明LARAs具有促癫痫作用,并证明了APOE介导的脂质转运在癫痫中的病理影响。与此相一致的是,用CDP-胆碱治疗癫痫小鼠,有效地降低了KA刺激的野生型小鼠的癫痫发作活动。然而,在APOE−/−小鼠中,CDP-胆碱对KA诱导的癫痫发作的保护作用完全被消除。因此,通过脂质转运或代谢干预靶向LARA可以有效缓解癫痫症状,预防疾病进展。
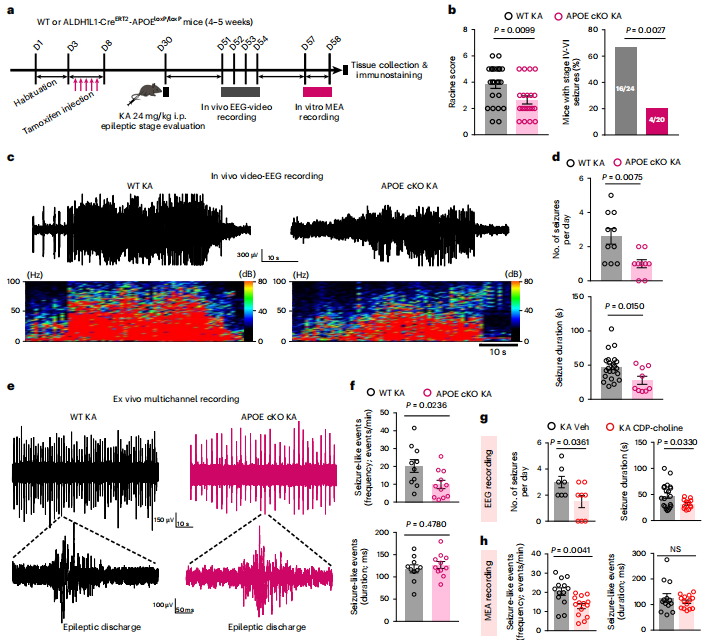
图8 脂质积聚的反应性星形胶质细胞与癫痫小鼠的发作活动有关
8. 脂质积累的反应性星形胶质细胞通过星形胶质细胞A2AR促进癫痫发作活动
为了探索LARA介导的神经元毒性的分子机制,研究者在体外使用游离FAs治疗野生型或APOE−/−小鼠的原代星形胶质细胞,模拟LARA的形成。采用RNA-seq分析,探索FAs处理和APOE KO诱导的差异表达基因。这些显著改变的星形胶质细胞基因中有77.5%(404/521)在FAs处理的野生型和APOE−/−星形胶质细胞之间表现出相反的模式。这些基因中有许多在神经元传递相关的通路中富集。值得注意的是,腺苷2A受体(A2AR)存在于两种途径中,并在FAs处理下上调,但被APOE KO阻断。这与A2AR KO小鼠对乙醇诱导的癫痫有抵抗力的观察结果相一致。在星形胶质细胞(GFAP+)和神经元(MAP2+)表面均观察到A2AR的表达。此外,与野生型对照组相比,KA刺激的APOE−/−小鼠的星形胶质细胞A2AR显著降低。这些结果表明,LARAs表达高水平的A2AR,至少部分原因是APOE介导的脂质积累。
为了检测LARA的促癫痫作用是否需要A2AR,研究者使用AAV2/9-gfaABC1D-A2AR-shRNA-eGFP结构选择性地敲低小鼠海马星形胶质细胞中A2AR的表达。这种敲低只针对星形胶质细胞,而不影响神经元中A2AR的表达。在KA刺激小鼠的脑切片中使用全细胞膜片钳记录,研究者发现与A2AR敲低的星形胶质细胞(eGFP+)相邻的海马锥体神经元表现出明显的神经元兴奋性和神经传递降低。此外,通过对来自TLE参与者的新鲜皮层样本的体外MEA记录,研究者发现A2AR拮抗剂ZM241385治疗显著降低了人脑切片中癫痫样放电的频率和持续时间。这些结果表明,A2AR表达的升高在LARA介导的神经毒性中起着核心作用。星形胶质细胞中A2AR的过表达已被证明降低了星形胶质细胞对兴奋性氨基酸转运体(EAATs)的表达和对谷氨酸的摄取,导致神经元兴奋异常。总之,这些数据表明,LARA可以通过效应蛋白A2AR促进神经元放电。

图9 脂质积累的反应性星形胶质细胞通过星形胶质细胞A2AR促进癫痫发作活动
研究者的工作确定了一种以前未知的反应性星形胶质细胞亚型。在本研究中,研究者报道了一种新的亚型-LARA的存在,其特征是LD过度积累和脂质代谢异常。研究者的研究结果表明,在耐药TLE参与者和癫痫小鼠中,星形胶质细胞中异常的脂质积累导致LARAs的形成,促进神经元反复放电,最终导致神经元丢失;而APOE KO阻止星形胶质细胞中的脂质积累,抑制LARA的形成,减轻癫痫发作和疾病进展。因此,靶向LARAs可能为耐药癫痫提供替代治疗选择。

查看更多

查看更多

查看更多

联系我们

返回顶部