查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
间质基质/干细胞(MSCs)是一种多能细胞群,是治疗急性和慢性肝脏疾病最具有应用前景的选择之一,并已逐渐进入临床实践。由于MSC在不利环境中的滞留性差,目前依然存在植入损伤组织后细胞损失或治疗效果不佳等问题。调节性细胞死亡(RCD)的多种形式,如坏死、焦亡、铁死亡等均被认为与MSC的病理应激相关,然而导致MSC在肝脏环境中过度损失的具体RCD形式依然不清楚。近日,空军军医大学西京医院张富洋/陶凌教授研究团队在Advanced Science(IF=17.521)上发表了名为“Suppressing Mesenchymal Stromal Cell Ferroptosis Via Targeting a Metabolism-Epigenetics Axis Corrects their Poor Retention and Insufficient Healing Benefits in the Injured Liver Milieu”的研究论文,旨在探讨何种形式的RCD导致MSCs在植入受损肝脏早期或ROS刺激下死亡,并探讨了优化间充质干细胞治疗的基本机制和临床前策略。值得注意的是,该文章使用汉恒生物腺病毒在MSCs中过表达Bcat1、Gpx4以及沉默Bcat、Egr1等基因。

首先,作者在脂肪衍生间充质干细胞(ADSCs)中加入过氧化氢(H2O2)模拟受损肝脏中的ROS风暴,发现ADSCs存活率显著下降;H2O2刺激6小时后的细胞显示出线粒体萎缩、嵴消失、线粒体膜破裂等铁死亡超微结构特征,以及Fe2+在ADSCs的线粒体中明显累积。使用铁死亡相关RCD抑制剂Fer-1和Lip-1处理细胞后,显著抑制了这些变化。作者在加入PBS、Fer-1和Lip-1的溶剂中将等量EGFP标记的ADSCs递送至肝脏,发现Fer-1和Lip-1提高了ADSCs的存活率。而ADSCs移植CCl4诱导肝损伤大鼠模型后的病理结果同样显示多数RCD抑制剂中,只有Fer-1和Lip-1提高了ADSCs的治疗效果,包括肝脏坏死病变明显减少、炎症细胞浸润减少、血清ALT和AST水平降低。

图1 过度铁死亡导致植入受伤肝脏或ROS应激后MSC迅速损失
为了探索驱动MSC铁死亡的机制,作者对Erastin(一种铁质化诱导剂)处理6小时的ADSCs进行蛋白组学分析,对差异前十的下调蛋白进行相应基因的siRNA筛选,结果显示BCAT1的沉默显著促进Erastin诱导的ADSCs死亡。BCAT1为支链氨基酸(BCAA)分解代谢酶,将BCAA的氨基转移至α-酮戊二酸(α-KG),其蛋白水平在Erastin和另一种铁死亡诱导剂RSL3处理的ADSCs中均显著下降。沉默BCAT1后,ADSCs对Erastin和RSL3呈现剂量依赖性死亡,铁死亡核心过程脂质过氧化进一步增加,而Fer-1可抑制这种细胞死亡和脂质过氧化的加剧。
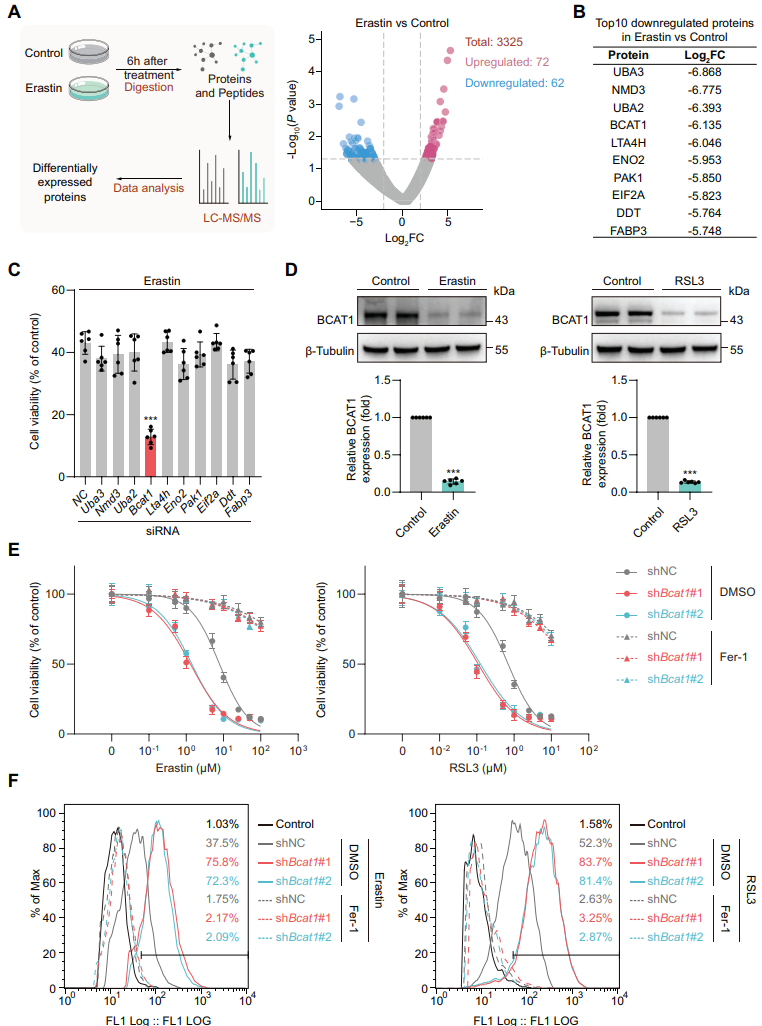
图2 BCAT1下调使MSC对铁死亡敏感
接下来,作者将感染了shBact1或shNC腺病毒的ADSCs移植至肝脏损伤大鼠,探究BCAT1下调引起的铁死亡易感性是否会影响MSC植入受损肝脏时的存活和治疗效果。BCAT1沉默明显抑制了ADSCs在受伤肝脏环境中的存活,ADSCs对肝脏坏死、炎症细胞浸润、促炎症细胞因子的缓解作用。而Fer-1联合处理则可抑制对照组和BCAT1沉默所带来的负面作用。
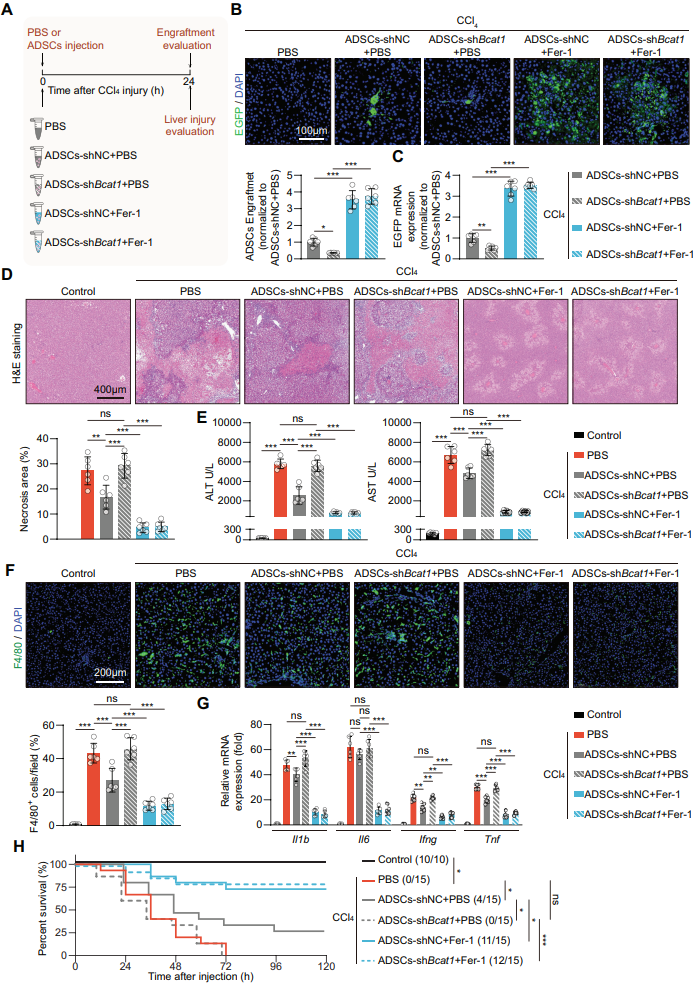
图3 BCAT1下调限制了MSC在受伤肝脏中的存活和治疗效果
随后,作者探讨了BCAT1对MSCs铁死亡的调控机制。铁死亡PCR阵列结果显示沉默BCAT1的ADSCs在Erastin刺激后铁死亡相关基因Gpx4、Hspb1和Hsf1的mRNA水平明显下降,WB结果显示GPX4蛋白存在显著下调。随后,使用过表达GPX4腺病毒处理ADSCs,作者发现GPX4的表达挽救了BCAT1沉默ADSCs的异常Erastin诱导性铁死亡和脂质过氧化。另一方面,BCAT1酶活性抑制剂加巴喷丁和ERG240显著加剧ADSCs的Erastin剂量依赖性铁死亡反应,并抑制GPX4蛋白表达。DM-α-KG(一种细胞可渗透的α-KG的衍生物)以剂量依赖的方式增加了Erastin诱导的铁死亡,而D-2-HG(一种α-KG依赖性双加氧酶的竞争性拮抗剂)挽救BCAT1沉默的ADSCs在Erastin诱导下的GPX4表达抑制和铁死亡。
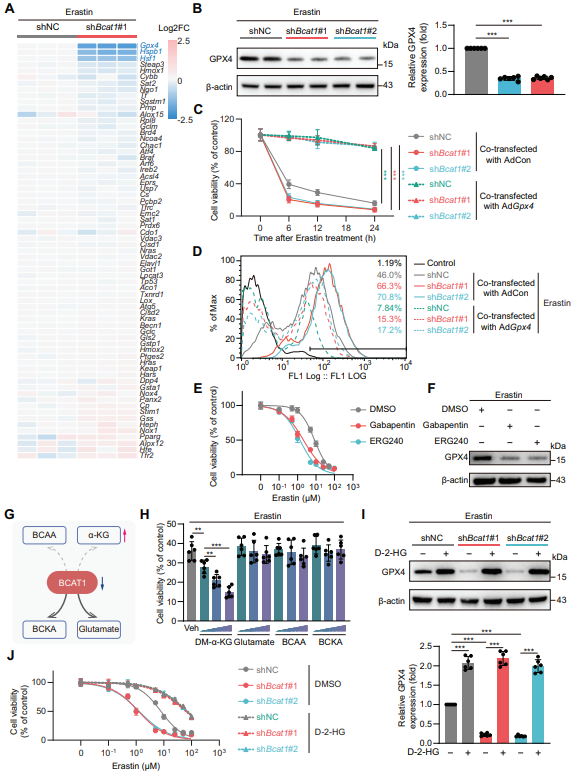
图4 BCAT1下调通过增加细胞内α-KG水平来抑制GPX4表达
基于以上研究,作者推测α-KG依赖的双加氧酶调节的表观遗传变化可能与ADSCs的GPX4和铁死亡相关。在分析Erastin处理的BCAT1沉默ADSCs的RNA-seq、免疫荧光和WB数据后,作者发现组蛋白3赖氨酸9三甲基化(H3K9me3)丰度存在显著变化。D-2-HG则抑制了BCAT1沉默导致的ADSCs中与铁死亡相关的H3K9me3蛋白表达量降低。KDM4A/4B(α-KG依赖性脱甲基酶)在Erastin诱导下被其特异性抑制剂NSC 636819所抑制,这显著改善了NC和shBCAST1组的H3K9me3和GPX4下调。然而H3K9me3在Gpx4启动子区域的占有率无明显改变,于是作者通过RNA-seq数据确定早期生长反应蛋白-1(EGR1)为BCAT1沉默的ADSCs中唯一显著变化的可调控Gpx4的转录因子。通过NSC 636819诱导抑制H3K9me3的丢失,明显阻断了ERG1蛋白表达在对照组和BCAT1沉默的ADSC中的上调。染色质免疫沉淀(ChIP)实验证实Egr1启动子区域的H3K9me3的占有率在BCAT1沉默后降低,而NSC 636819的共同处理则完全阻止这一抑制效果。EGR1的沉默显著挽救了在Erastin存在时、BCAT1沉默导致的GPX4下调。
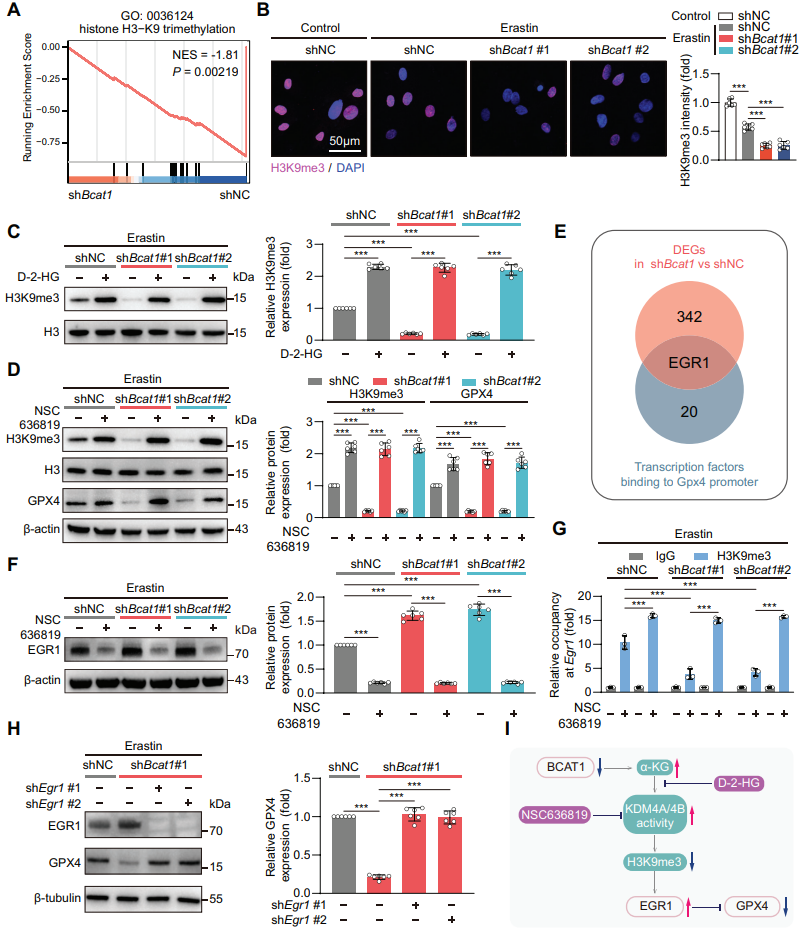
图5 BCAT1通过代谢-表观遗传学协调机制调节GPX4转录
接下来,作者使用腺病毒介导的BCAT1过表达和GPX4沉默ADSCs探究了BCAT1过表达能否增强MSCs对铁死亡的抵抗和治疗效果。BCAT1的过表达明显改善了在受伤肝脏环境中的存活率以及治疗效果,而GPX4沉默则完全抑制了BCAT1过表达所带来的坏死病变、血清ALT和AST水平、炎症细胞浸润、促炎症细胞因子等方面的肝脏保护作用。
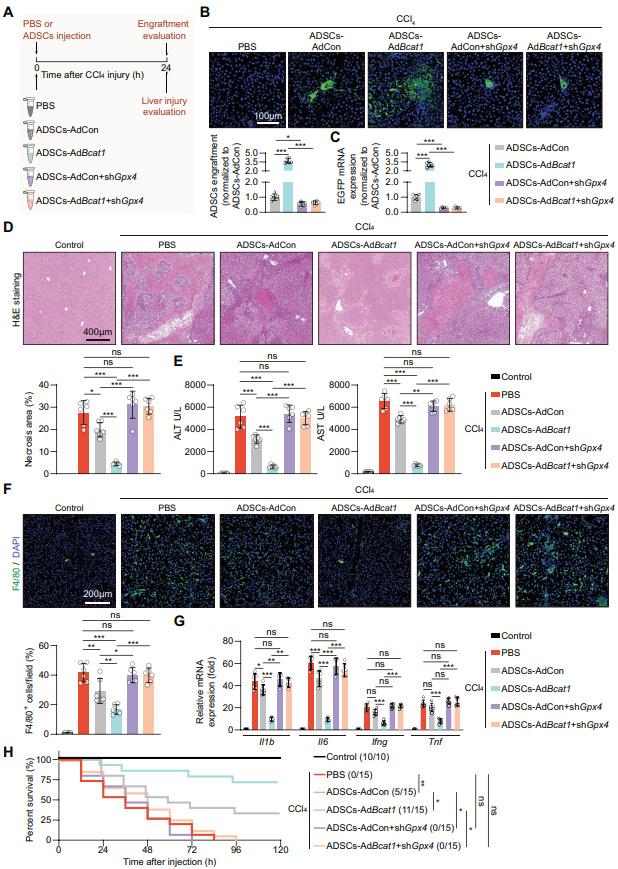
图6 BCAT1过表达以GPX4依赖性方式增加MSC的存活和治疗效果
最后,作者使用人类ADSCs测试了抑制铁死亡的治疗策略是否具有临床转化潜力。在hADSCs上观察到H2O2或Erastin刺激所导致的分子变化与大鼠ADSCs相似,包括BCAT1、H3K9me3、GPX4下调、和ERG1上调。Erastin诱导的铁死亡和铁死亡相关的脂质过氧化在过表达BCAT1后明显减弱,而GPX4沉默则抑制了BCAT1过表达所介导的这些抗铁死亡作用。在肝损伤大鼠模型中同样观察到抑制hADSCs的铁死亡过程显著增加了植入肝脏后的存活率,并降低了坏死性病变和血清ALT和AST水平。

图7 BCAT1过表达或铁死亡抑制可增强人MSC在受损肝脏中的存活和治疗效果
在本研究中,作者利用大鼠和人ADSCs进行肝损伤大鼠模型移植和体外基因调控研究,揭示了MSC在植入受损肝脏后铁死亡敏感性的代谢-表观遗传学机制:BCAT1作为调节MSC铁死亡敏感性的关键分子,其表达下调通过α-KG的积累增强α-KG依赖的KDM4A/B活性,并减少EGR1启动子的H3K9me3修饰,这导致EGR1的快速上调并抑制了GPX4的转录,从而使MSC对铁死亡敏感。作者的研究首次提出了过度铁死亡是MSCs移植入受损肝脏或ROS刺激后损失的主要原因,以此为靶点实施有效策略将有利于优化基于间充质干细胞的治疗。

查看更多

查看更多

查看更多

联系我们

返回顶部