查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
腹泻型肠易激综合征 (IBS-D)
肠易激综合征(Irritable bowel syndrome,IBS)是一种慢性功能性消化道疾病,常持续性或间歇性地发作,其临床症状通常表现为结肠痉挛、慢性腹痛、腹胀和排便习惯的改变,包括腹泻、便秘或两者兼具,其中腹泻型肠易激综合征(Diarrheal irritable bowel syndrome,IBS-D)发病率较高。目前普遍认为IBS-D患者的发病与心理应激、家族遗传、胃肠道感染及饮食等因素密切相关,但上述因素之间对IBS-D发生的调控逻辑关系仍然缺乏系统全面的分析。在本研究中,作者阐明了免疫代谢紊乱、精神应激、菌群紊乱与结肠平滑肌收缩功能障碍之间的内在联系,为应激性内脏高敏感及平滑肌收缩亢进的个性化治疗提供了新思路。

研究内容概述
2024年10月,中山大学靳津教授与东南大学李异媛副研究员作为共同通讯作者在Cell Metabolism(IF=27.7)期刊在线发表题为“Stress triggers irritable bowel syndrome with diarrhea through a spermidine-mediated decline in type I interferon”的研究论文。作者首先通过对小鼠的粪便进行宏基因组测序分析,发现应激会诱导黄嘌呤(Xan)的过度产生,并直接改变肠道中鼠乳杆菌(L. murinus)的丰度和代谢特征,而扩增的L. murinus会产生大量的亚精胺,直接诱导了IBS-D的发生。据研究,肿瘤坏死因子受体相关因子3(Tumor necrosis factor receptor associated factor 3, TRAF3)的K63链式多聚泛素化被认为是多种模式识别受体诱导IFN-I表达的中枢介质。本研究结果明确了亚精胺可以抑制浆细胞样树突状细胞(Plasmacytoid dendritic cell,pDC)中TRAF3的K63链式多聚泛素化,进而抑制I型干扰素(IFN)-α的基础表达,而IFN-α的降低直接促进了结肠平滑肌细胞的收缩,从而导致排便增加。本研究解析了应激诱导腹泻型肠易激综合征的详细分子机制,为应激性IBS-D的病理机制和新的药物靶点提供了理论基础。
在本研究中,汉恒生物有幸为作者提供了AAV2/9-Sm22a-cre-ZsGreen和AAV2/9-Syn-cre-EGFP,成功建立了平滑肌细胞和结肠神经细胞特异性Ⅰ型干扰素受体IFNAR 敲除(IFNAR-KO)小鼠。
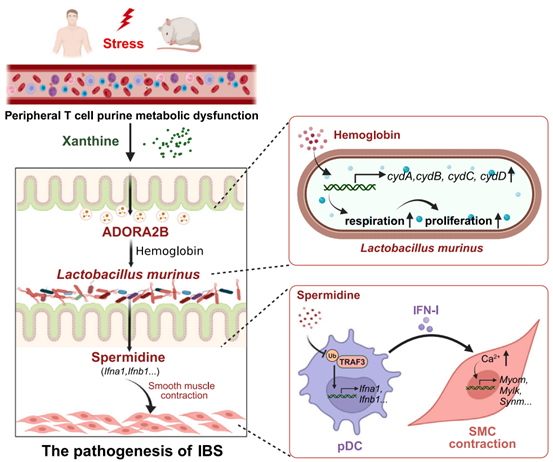
图1. 应激导致IBS-D的分子机制概述图
下面,我们一起来了解具体的研究内容:
研究结果解读
1.CD4+ T细胞源性Xan促进应激性IBS-D样症状的发生
研究表明应激会促进CD4+ T细胞转化为“嘌呤合成工厂”并导致焦虑症状的发生,且临床数据显示血清中Xan浓度与IBS-D严重程度呈正相关。作者通过血清代谢组学分析发现同时患有IBS-D及焦虑症状的个体中Xan水平显著高于健康个体。通过建立不同的应激模型发现,应激处理不仅会导致血清中Xan浓度的上升,还会导致与IBS-D症状相似的结直肠内脏疼痛反应和粪便含水量的增加,直接腹腔注射Xan则会得到类似的表型。而去除应激小鼠的CD4+ T细胞则可有效降低内脏敏感性和Xan的过量产生,缓解应激带来的行为障碍。这些结果表明,心理应激通过CD4+ T细胞源性Xan促进IBS-D样症状的发生。
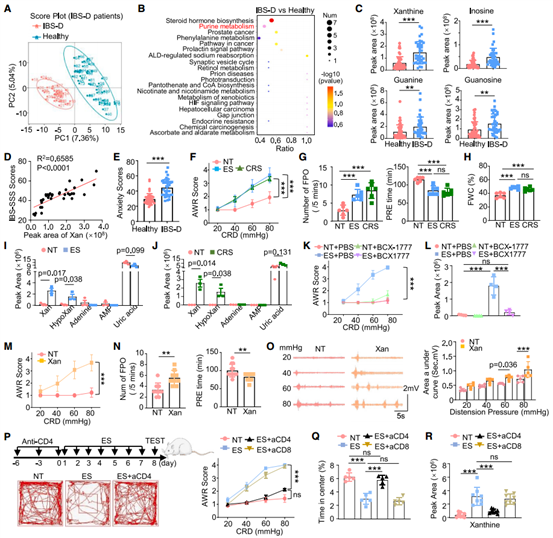
图2. 应激状态下CD4+ T细胞源性Xan引发IBS-D样症状
2.Xan增加平滑肌收缩并降低干扰素刺激基因(ISGs)的表达
作者使用Xan处理小鼠结肠细胞并通过转录图谱分析了Xan诱导的IBS-D样症状的潜在分子机制,结果显示Xan处理小鼠的部分平滑肌细胞(SMCs)亚群中与肌肉收缩相关的基因表达均显著增加,总体表现为肠平滑肌蠕动收缩失调导致胃肠道转运加速,最终导致IBS-D的高内脏敏感性。差异表达基因(DEGs)通路富集分析发现,Xan处理组结肠细胞中包括I型IFN(IFN-I)相关通路、病毒应答通路、细胞运动介导的信号通路和先天免疫应答通路在内的多条通路下调,尤其是在上皮细胞(ETCs)和SMCs的各个亚群中。数据显示Xan处理小鼠结肠细胞中的ISGs表达广泛降低。这些结果提示IFN-I下游信号通路的抑制可能参与了IBS-D的发生。
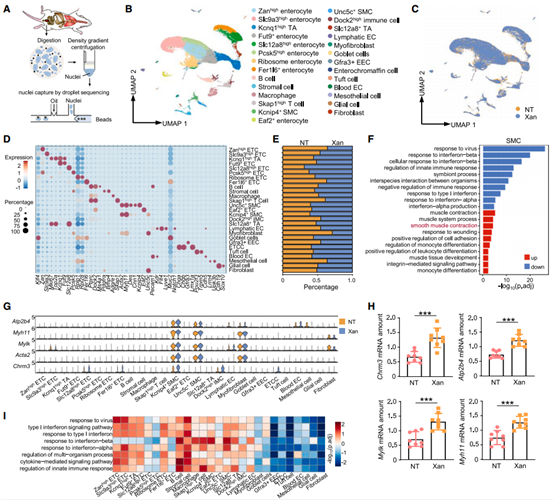
图3. Xan处理小鼠的结肠平滑肌细胞出现收缩功能障碍和IFN-I信号抑制
3.Xan通过抑制pDC产生IFN-α使结肠平滑肌不断收缩
为了研究IFN-Ⅰ信号通路在IBS-D样症状发作中的作用,作者分别建立了肠道神经元和SMC特异性IFNAR-KO小鼠。SMC特异性IFNAR-KO小鼠表现出内脏敏感性和收缩相关基因表达量的增加,而神经元KO小鼠则没有显著变化,表明响应IFN-I途径对于控制SMCs的收缩至关重要。另外,作者发现经应激或Xan处理后IFN-I(包括IFN-α和IFN-β)显著减少,而通过IFN-α治疗可以抑制应激和Xan引起的高内脏敏感性和收缩表型。随后,作者发现全身性pDC(IFN-α的主要来源)耗竭模型同样会引起内脏高敏感性,同时IFN-α表达量降低。综上所述,pDC来源的IFN和ISG的正常表达对于维持SMC的生理功能至关重要,其下调可导致高内脏敏感性的发生。
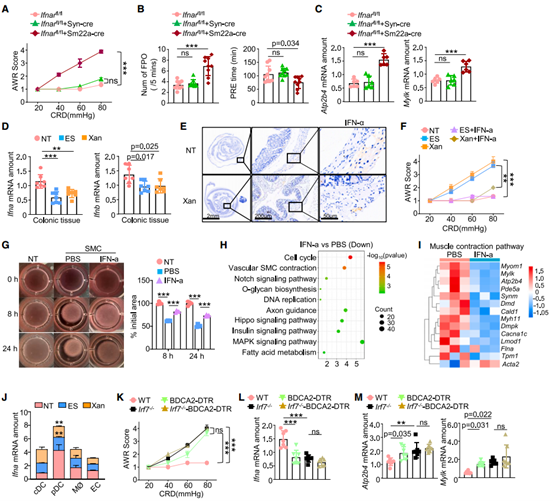
图4. pDC源性IFN-α的减少使IBS-D样症状小鼠的SMC收缩功能增强
4.Xan通过AdorA2B诱发IBS-D样症状
为了研究Xan驱动IFN-α下调的机制,作者分析了结肠中四种腺苷受体亚型的表达情况,发现其中AdorA2B(A2B)在处理后表达水平明显升高,而耗竭CD4+ T细胞或抑制嘌呤合成可以抑制上调水平。另外,作者构建的A2B-/-小鼠在Xan处理后表现出对内脏高敏感性的抵抗力,表明过量Xan通过作用于A2B进而导致内脏敏感性升高。作者通过转录组差异分析发现Xan促进了囊泡外壳和多种物质的运输,且检测发现Xan处理和应激小鼠的粘液中含有高水平的A2B。这些结果表明Xan通过作用于A2B促进外泌体的合成和分泌,由于肠腔中有大量细菌定植,因此这些外泌体可能通过作用于肠腔中的细菌发挥作用。
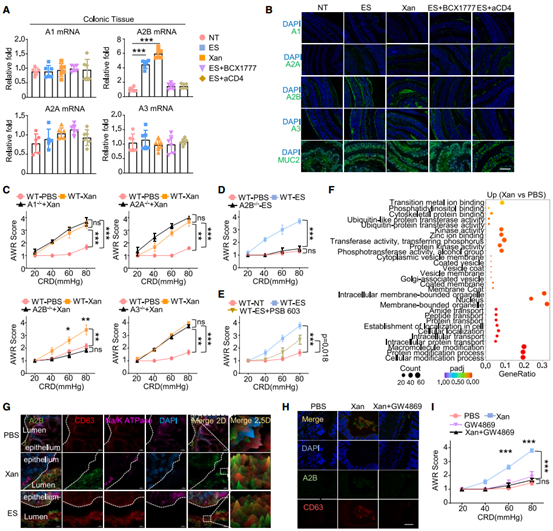
图5. A2B参与应激性内脏高敏感性的发生
5.应激和Xan处理均会引起结肠菌群失调,尤其是L. murinus异常增加
临床研究表明与健康个体相比,IBS-D患者的肠道菌群表现为失调。使用抗生素去除肠道细菌后,应激或Xan处理均未引发内脏高敏感性。此外,作者还发现在所有内脏高敏感性小鼠中L. murinus的表达丰度均明显上调。而经处理的A2B-/-小鼠粪便中L. murinus没有增加到与对照组相同的程度,表明Xan诱导的L. murinus异常增加依赖于A2B。另外IFN-α治疗可以调节L. murinus灌胃导致的内脏敏感性。临床数据显示在重度IBS-D患者的肠道内,与L. murinus进化密切相关的内格尔氏液体乳杆菌(L. nagelii)比例也异常增加,而对健康小鼠进行L. nagelii灌胃也可诱发重度IBS-D。以上结果表明,部分乳酸杆菌菌株可能是诱发小鼠内脏敏感性和临床IBS-D的危险因素。
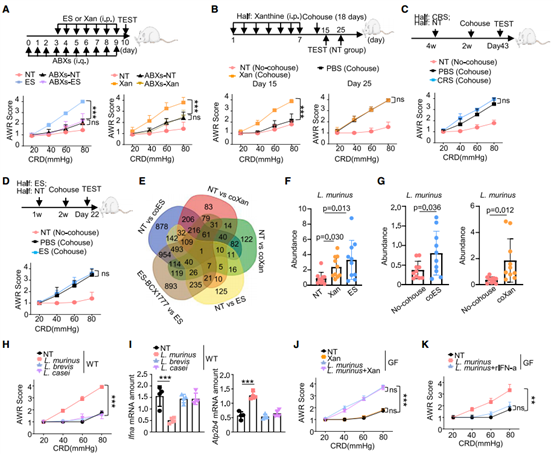
图6. L. murinus对于应激引起内脏高敏感性的过程至关重要
6.粘液中的血红蛋白诱发L. murinus的扩增
为了研究A2B诱导性外泌体调节L. murinus扩增的潜在机制,作者收集了未处理对照、Xan处理和应激小鼠的肠粘液,在经过无菌处理后加入L. murinus进行体外孵育。结果显示,来源于Xan处理或应激小鼠的无菌粘液显著增加了L. murinus的增殖。通过蛋白质组学分析显示在Xan处理或应激小鼠肠粘液中,血红蛋白亚基 β(β-globin)显著上调。随后,作者使用抗血红蛋白的中和抗体证实了L. murinus的增殖依赖于血红蛋白。转录组分析发现Xan处理和对照组的DEGs主要富集在氧化磷酸化和氧化还原反应中,表明该细菌中的氧化呼吸链被激活。以上结果表明,结肠中携带血红素的外泌体通过促进L. murinus氧化呼吸代谢从而导致L. murinus过度增殖。
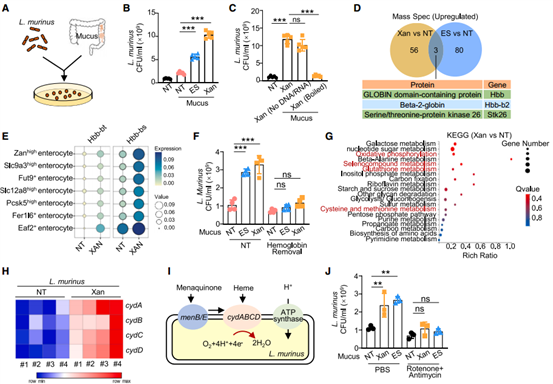
图7. 粘液中的血红蛋白促进了L. murinus的扩增
7.L. murinus源性亚精胺直接引起内脏高敏感性
据报道,肠道微生物群产生的代谢物是IBS的致病诱因之一。通过代谢组学和质谱成像分析发现Xan处理或L. murinus移植小鼠的粪便中观察到更高的亚精胺浓度,而腹膜内注射亚精胺直接导致WT和无菌小鼠结肠敏感性升高和IFN-α表达降低。随后,作者构建了亚精胺合成关键酶的编码基因Spec缺陷型L. murinus菌株(L. murinusΔSpeC)。L. murinusΔSpeC移植后,并未引起健康小鼠的内脏过敏和IFN-α的表达减少,体外实验也证明亚精胺能够抑制活化pDC细胞中IFN-α的表达。通过机制研究发现,亚精胺可以减弱活化pDC细胞中TRAF3的K63链式多聚泛素化水平,且荧光素酶实验检测发现TRAF3的K63链式多聚泛素化显著增强了IFN-α的启动子活性,表明亚精胺通过调节TRAF3的K63链式多聚泛素化介导IFN-I的诱导表达。综上所述,亚精胺调节的IFN水平对于维持SMCs的生理功能至关重要,其下调会导致类似IBS-D的症状。
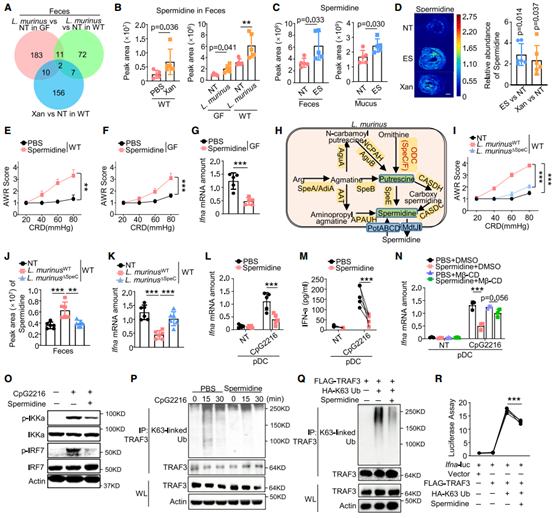
图8. L. murinus源性亚精胺抑制IFN-α的表达并促进内脏高敏感性的发生
研究结果总述
综上所述,本研究阐明了IBS-D发病过程中神经、免疫、代谢、肠道菌群等多种因素之间的相互关系,为全面揭示IBS-D的发病机制奠定了基础;为应激性疾病的病理机制提供了前沿解释;为IBS-D的治疗提供了新的分子靶点作为精准研究切入点。

查看更多

查看更多

查看更多

联系我们

返回顶部