查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2024年5月28日,中山大学附属第三医院的林炳亮团队、黄月华团队和练一帆团队联合在《Molecular Cancer》上发表了题为“CircPIAS1 promotes hepatocellular carcinoma progression by inhibiting ferroptosis via the miR-455-3p/NUPR1/FTH1 axis”的研究论文。值得注意的是,在本研究中,作者使用了汉恒生物提供的慢病毒pHBLV-h-miR-455-3p和pHBLV-h-sh-miR-455-3p,成功实现了miR-455-3p在肝细胞癌细胞系(Huh7和PLC/PFR/5)中的过表达和沉默。

肝细胞癌(HCC)是全球最常见的原发性肝癌类型,占所有肝癌病例的75%-85%,并且是导致癌症相关死亡的主要原因之一。尽管治疗手段不断进步,但受限于肿瘤转移和药物耐受性,HCC患者的五年生存率仍不理想。因此,迫切需要探索新的诊疗标志物并开发相应的治疗策略。
本研究发现CircPIAS1在HCC组织和细胞中的表达上调,在体内外实验中,沉默CircPIAS1可抑制HCC细胞的增殖和迁移。机制上,CircPIAS1的高表达通过竞争性结合miR-455-3p抑制铁死亡,导致核蛋白1 (NUPR1)表达上调。此外,NUPR1促进FTH1转录,增强HCC细胞中的铁储存并赋予其铁死亡抗性。用NUPR1抑制剂ZZW-115治疗,逆转了CircPIAS1的促瘤作用,并使HCC细胞对lenvatinib(仑伐替尼,肝癌治疗药物)敏感。该研究强调了CircPIAS1通过调节铁死亡在HCC进展中的关键作用,靶向CircPIAS1/miR-455-3p/NUPR1/FTH1调节轴可能是治疗HCC的潜在策略。
下面,我们一起来了解具体的研究内容:
1.环状RNA CircPIAS1在肝癌组织和细胞系中表达上调
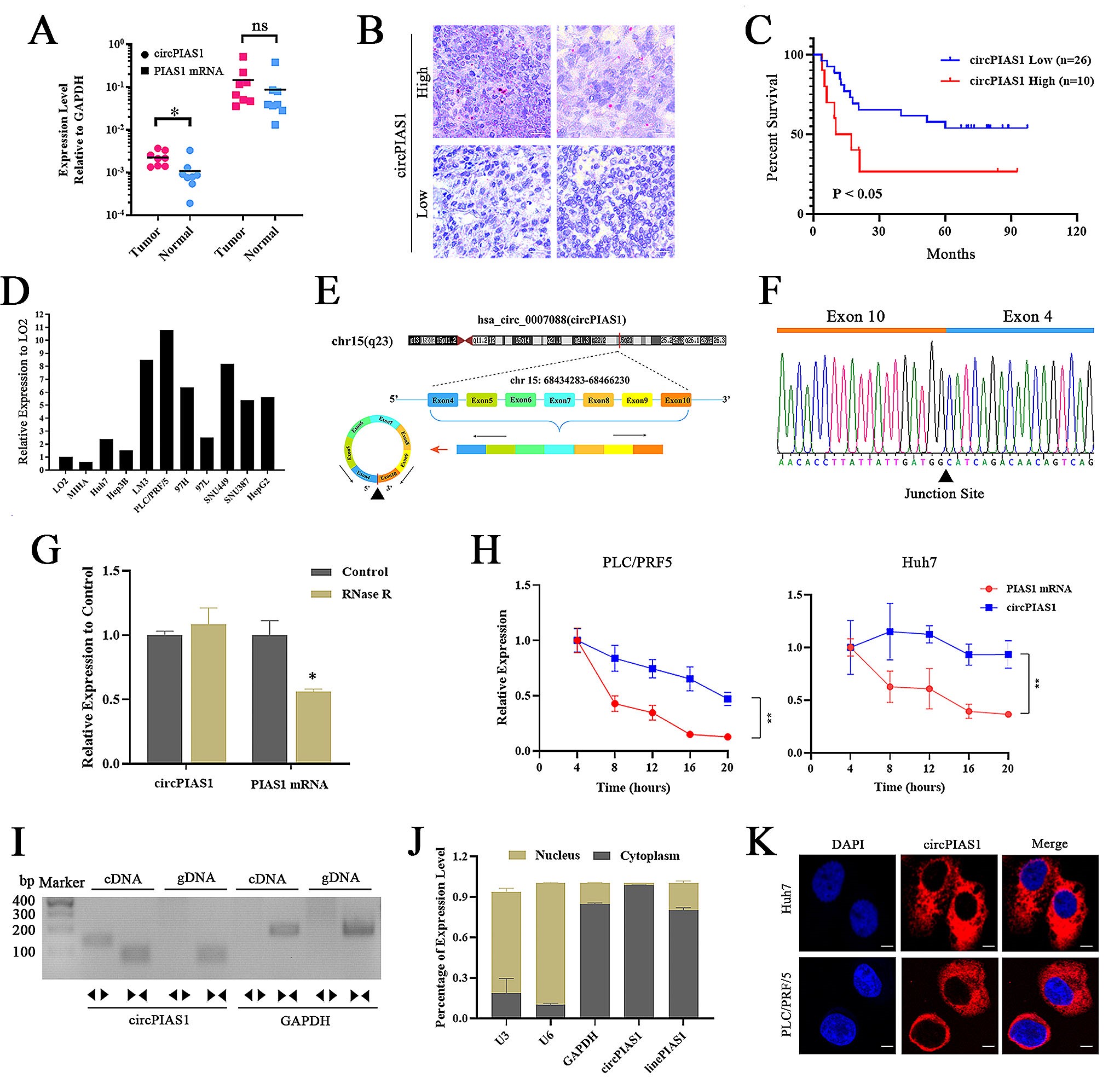
图1. CircPIAS1在HCC中的表达和特征
2.在体内外实验中下调CircPIAS1可抑制HCC细胞的增殖和迁移
为了探究CircPIAS1在HCC发生发展中的作用,作者在PLC/PRF/5细胞中敲低CircPIAS1的表达,在Huh7细胞中上调CircPIAS1的表达,研究结果显示:下调CircPIAS1的表达,可以抑制PLC/PRF/5细胞的增殖和迁移,过表达CircPIAS1可以促进Huh7细胞的增殖和迁移。在异种移植肿瘤模型中CircPIAS1过表达组肿瘤生长速率和肿瘤重量显著增加;CircPIAS1敲低组肿瘤生长速率和肿瘤重量显著下降。另外,在肺转移模型中, CircPIAS1敲低组肺转移灶面积显著减少。以上实验结果表明:CircPIAS1的高表达在体内和体外均有助于HCC细胞的侵袭性表型。
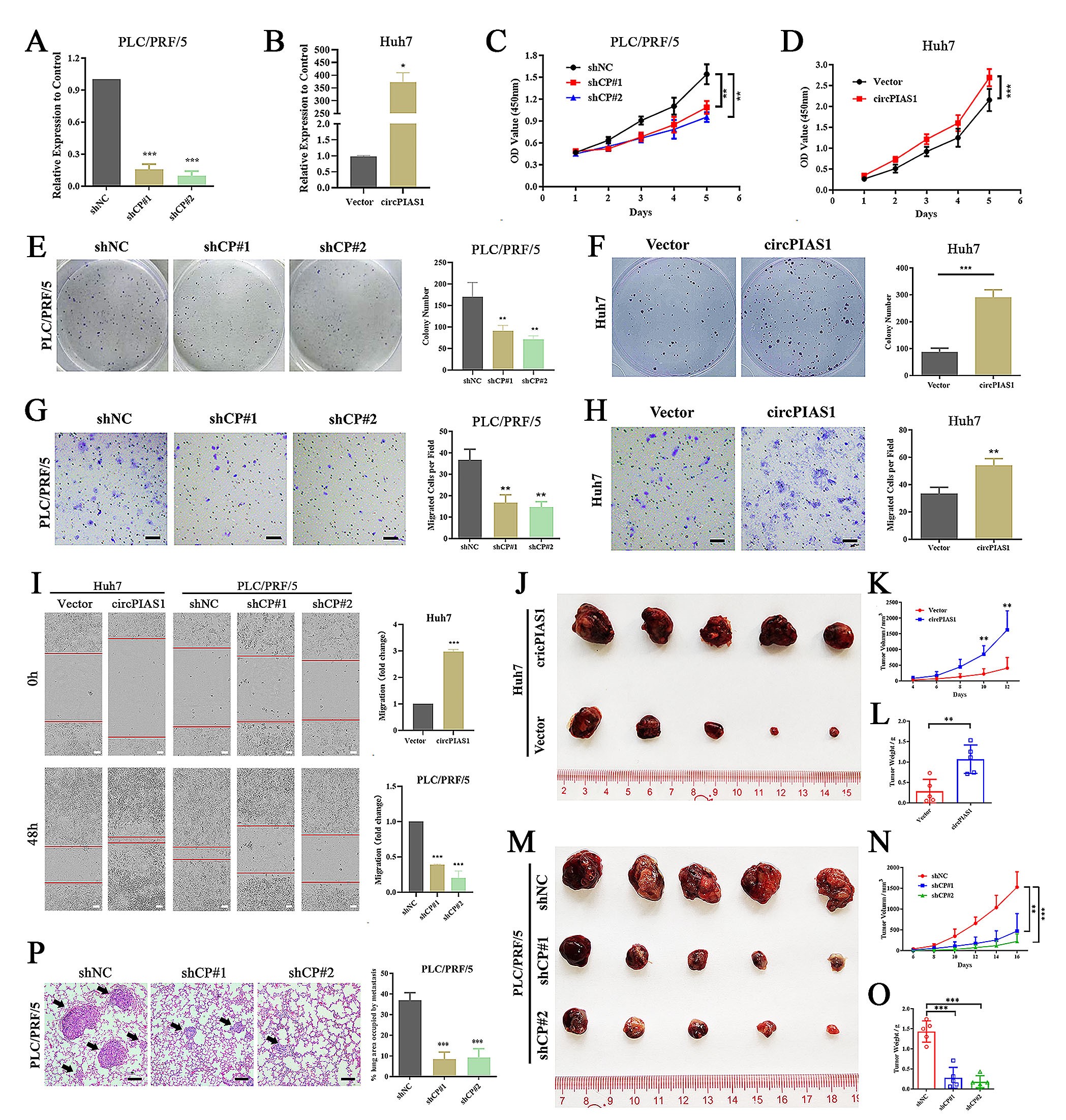
图2. CircPIAS1在体内体外促进肝癌细胞增殖和迁移
3.CircPIAS1抑制HCC细胞铁死亡
为了探究CircPIAS1促进HCC肿瘤生长的分子机制,作者对CircPIAS1敲低的PLC/PRF/5细胞进行转录组测序,基因富集分析(GSEA)结果显示:当CircPIAS1被敲低时,PLC/PRF/5细胞中的差异表达基因显著富集在氧化还原过程、氧化还原酶活性、脂肪酸代谢过程和NFE2L2.V2途径相关的信号通路,由此提示敲低CircPIAS1可能参与氧化代谢相关的细胞死亡的信号通路。为了确定敲低CircPIAS1诱导的细胞死亡类型,作者使用细胞凋亡抑制剂(Z-VAD-FMK)、细胞坏死抑制剂(Nec-1)以及铁死亡抑制剂(Fer-1和Lipro-1)处理CircPIAS1敲低的PLC/PRF/5细胞,研究结果显示:铁死亡抑制剂能够显著逆转CircPIAS1敲低引起的细胞生长抑制,表明CircPIAS1敲低可能诱导了HCC细胞的铁死亡。在Huh7细胞中过表达CircPIAS1能显著降低Fe2+和脂质ROS(活性氧)的表达水平,并且升高GSH(谷胱甘肽)的水平;反之,敲低CircPIAS1后,PLC/PRF/5细胞中Fe2+和脂质ROS水平显著升高,而GSH水平显著降低。同时,作者检测了铁死亡相关蛋白的表达水平,结果显示:CircPIAS1敲低组细胞中SLC7A11、FTH1和GPX4等铁死亡相关蛋白的表达水平显著降低,而CircPIAS1过表达组细胞中这些蛋白的表达水平显著升高。由此表明CircPIAS1的表达可以抑制HCC细胞的铁死亡。
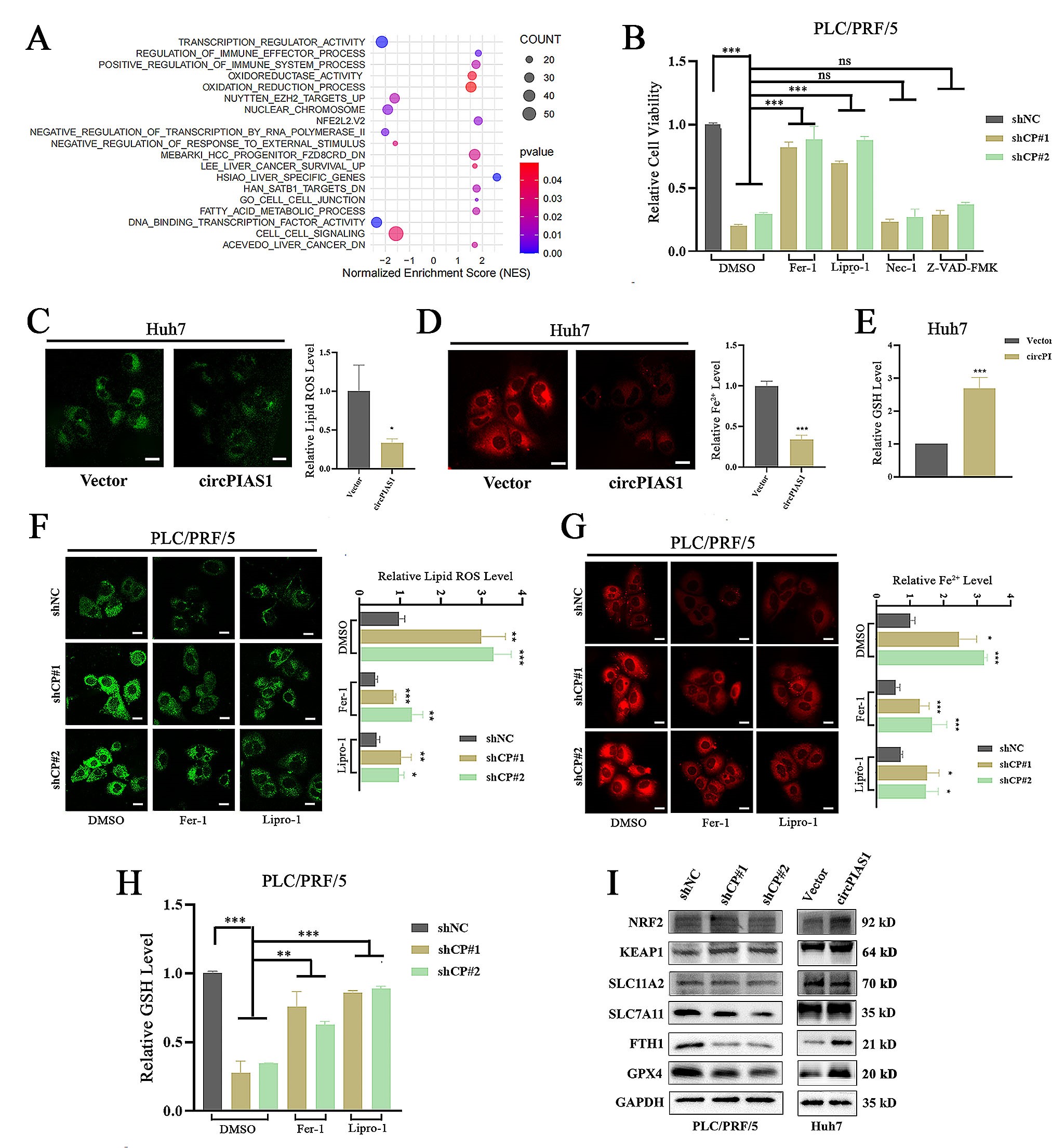
图3 .CircPIAS1抑制HCC细胞铁死亡
4.NUPR1是CircPIAS1调节铁死亡的下游因子
作者通过对转录组数据分析,发现CircPIAS1敲低后NUPR1(已被证实与铁死亡密切相关)的表达水平下降,表明NUPR1可能是CircPIAS1的下游靶基因。接着,作者在HCC细胞中过表达或敲低CircPIAS1,通过qPCR和WB检测NUPR1的表达水平,结果显示,敲低CircPIAS1能显著抑制NUPR1的表达,反之,过表达CircPIAS1能促进NUPR1的表达。并且,在CircPIAS1敲低的HCC细胞中,细胞内Fe2+和脂质ROS水平上升,GSH水平下降,这种变化可被NUPR1过表达逆转,由此表明NUPR1能抑制由CircPIAS1敲低引起的铁死亡。相反,CircPIAS1过表达会降低Fe2+和脂质ROS水平,提高GSH水平,这种效应会被NUPR1抑制剂ZZW-115所抵消。此外,NUPR1过表达能恢复因CircPIAS1敲低而减弱的肝癌细胞增殖和迁移能力,而ZZW-115则能部分抑制因CircPIAS1过表达而增强的肝癌细胞增殖和迁移。这些实验结果表明CircPIAS1通过调节NUPR1的表达来调节HCC细胞的铁死亡。
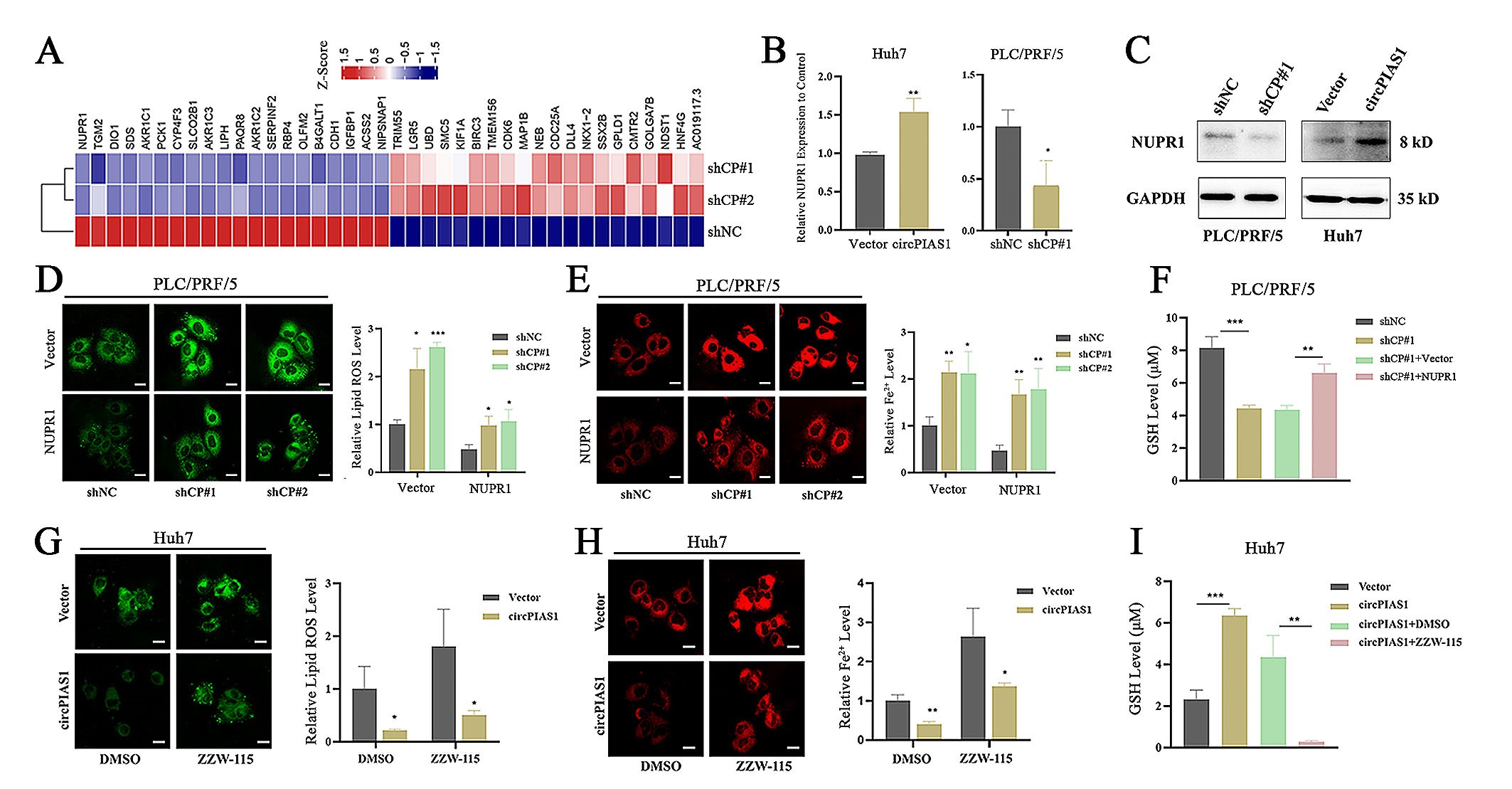
图4. CircPIAS1通过NUPR1调节HCC细胞对铁死亡的敏感性
5.CircPIAS1通过ceRNA机制吸附miR-455-3p上调NUPR1的表达
由于CircPIAS1定位于细胞质,由此作者推测CircPIAS1有可能通过ceRNA机制调节NUPR1的表达。作者利用3个数据库(ENCORI、Targetscan和miRDB)预测了与CircPIAS1和NUPR1结合的miRNA,筛选到了miR-455-3p作为候选基因。TCGA数据库显示miR-455-3p在肝癌组织中的表达显著低于癌旁组织,与CircPIAS1的表达相反。接着,作者通过双荧光素酶实验和RIP实验,验证了miR-455-3p与CircPIAS1的结合。并且,在表达水平上,过表达miR-455-3p有效降低了CircPIAS1过表达而引起的NUPR1水平的增加,而抑制miR-455-3p显著抵消了敲低HCC细胞中CircPIAS1表达而引起的NUPR1的表达降低。这些实验结果表明在HCC细胞中CircPIAS1通过其海绵(sponge)效应结合miR-455-3p,进而上调NUPR1的表达。
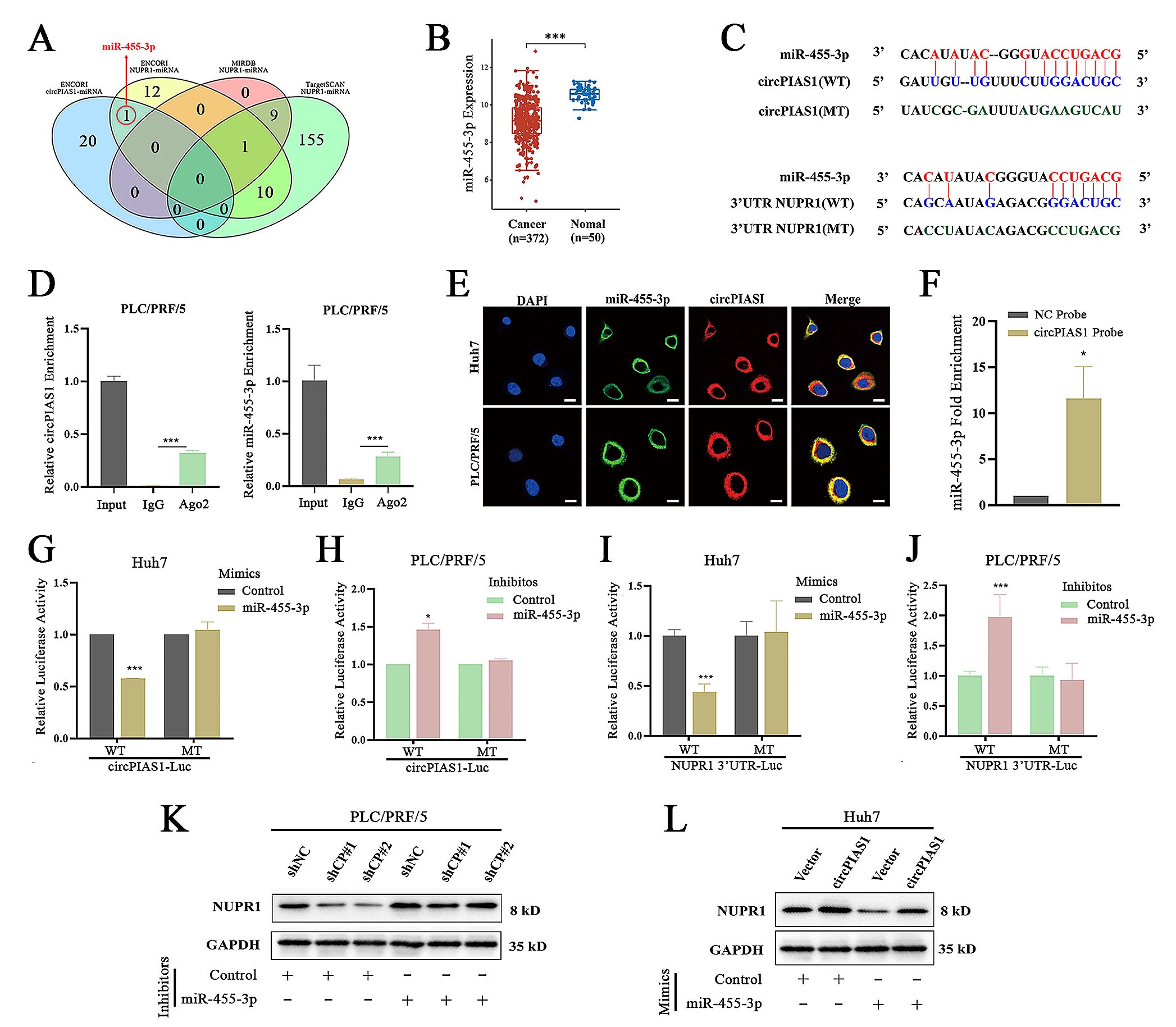
图5. 在HCC细胞中CircPIAS1通过其海绵效应结合miR-455-3p,进而上调NUPR1的表达
6.CircPIAS1通过吸附miR-455-3p促进HCC细胞的侵袭性表型
为了探讨CircPIAS1的促肿瘤作用是否通过其对miR-455-3p的海绵效应而介导,作者在HCC细胞中进行了挽救实验。研究结果显示CircPIAS1过表达诱导的细胞内Fe2+和脂质ROS的减少和GSH水平的增加可以被miR-455-3p模拟物逆转;相同地,CircPIAS1敲低诱导的细胞内Fe2+和脂质ROS的积累以及GSH水平的降低可以被miR-455-3p抑制剂抵消。此外,研究结果显示:miR-455-3p模拟物能消除由过表达CircPIAS1引起的Huh7细胞增殖和迁移的增加;miR-455-3p抑制剂能逆转由敲低CircPIAS1引起的PLC/PRF/5细胞增殖和迁移的抑制。这些实验数据表明CircPIAS1能通过miR-455-3p的分子海绵促进HCC细胞的侵袭性。
接着,为了探究miR-455-3p在HCC细胞中的功能,作者构建了miR-455-3p稳定过表达和沉默的HCC细胞系,研究结果显示:过表达miR-455-3p显著增强HCC细胞的铁死亡,并且这种现象可以被过表达NUPR1逆转。相反,沉默miR-455-3p显著抑制HCC细胞的铁死亡,这种现象可以被NUPR1抑制剂ZZW-115消除。过表达NUPR1能挽救由过表达miR-455-3p引起的HCC细胞的增殖和迁移的抑制;ZZW-115能逆转由沉默miR-455-3p引起的HCC细胞的增殖和迁移的增加。另外,qPCR和WB实验结果显示过表达miR-455-3p抑制NUPR1的表达,沉默miR-455-3p可以促进NUPR1的表达。以上实验结果表明miR-455-3p确实通过抑制靶基因NUPR1的表达来发挥功能。
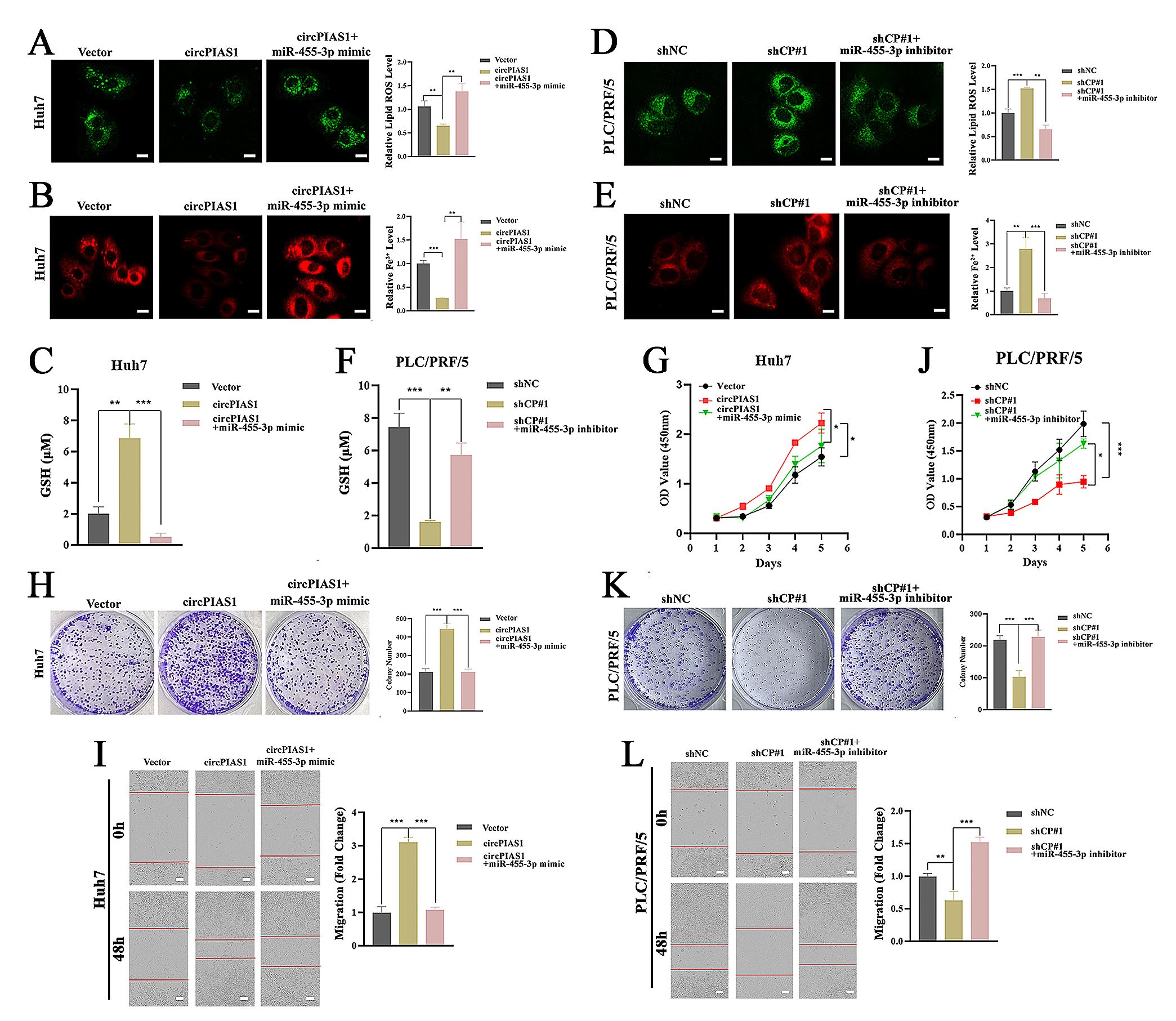
图6. miR-455-3p逆转CircPIAS1诱导的HCC细胞铁死亡抑制和侵袭性表型
7.NUPR1通过与FTH1的启动子区域结合来促进FTH1的转录
为了探究NUPR1调节铁死亡相关蛋白的分子机制,作者检测了过表达NUPR1对铁死亡相关蛋白的影响,研究结果显示,过表达NUPR1能促进FTH1的表达,ZZW-115可以抑制FTH1的表达。为了进一步探讨NUPR1调节FTH1的分子机制,作者对FTH1的启动子进行分析,并通过Chip-qPCR和双荧光素酶实验验证了NUPR1与FTH1的启动子结合:NUPR1过表达可以增强FTH1启动子的荧光素酶活性,而ZZW-115可以抑制FTH1启动子的荧光素酶活性。此外,ZZW-115可以抑制CircPIAS1过表达引起的FTH1启动子的荧光素酶活性的增强,而过表达NUPR1可以逆转敲低CircPIAS1引起的FTH1启动子荧光素酶活性的抑制作用。与前面的研究结果一张,敲低CircPIAS1导致FTH1的表达减少可以被过表达NUPR1逆转,过表达CircPIAS1导致FTH1的表达增加可以被ZZW-115消除。此外,公共数据库显示FTH1和NUPR1在HCC组织中的表达均高于癌旁组织,并且FTH1和NUPR1的表达呈正相关。CircPIAS1在癌旁组织中的表达水平和NUPR1、FTH1的表达也呈正相关,此外,NUPR1或FTH1的高表达与HCC患者总生存率降低有关。这些研究结果表明NUPR1通过激活HCC细胞中FTH1的表达抑制铁死亡。
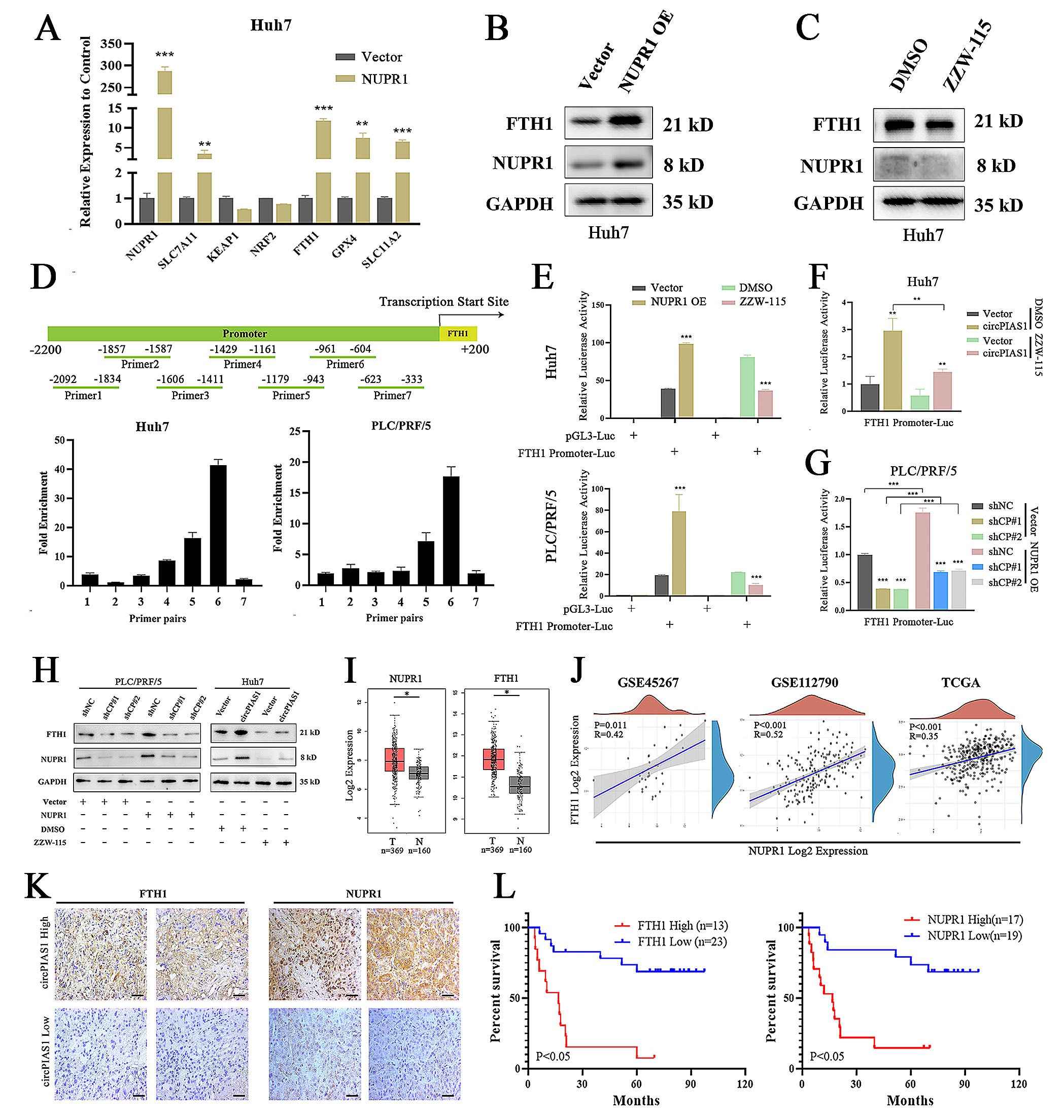
图7. NUPR1通过与FTH1的启动子区域结合来促进FTH1的转录
8.ZZW-115在体内诱导铁死亡,并提高HCC对lenvatinib的敏感性
为了研究抑制NUPR1表达是否可以增加HCC细胞对lenvatinib的敏感性。作者通过体内外单独给与ZZW-115、lenvatinib或ZZW115和lenvatinib联合用药后检测细胞存活率和肿瘤生长。研究结果显示:在细胞水平上,ZZW-115和lenvatinib联合用药对过表达CircPIAS1的HCC细胞的抑制作用比单独使用两种药物更明显;在动物水平上,ZZW-115和lenvatinib的联合用药可以有效抑制肿瘤生长,并降低肿瘤重量,与单独使用药物相比,联合治疗组的肿瘤生长抑制效果最为显著,肿瘤组织坏死区域更大,并且NUPR1和FTH1蛋白表达水平降低。这些研究数据表明ZZW-115和lenvatinib联合用药可能会增强lenvatinib对肝癌的治疗效果。
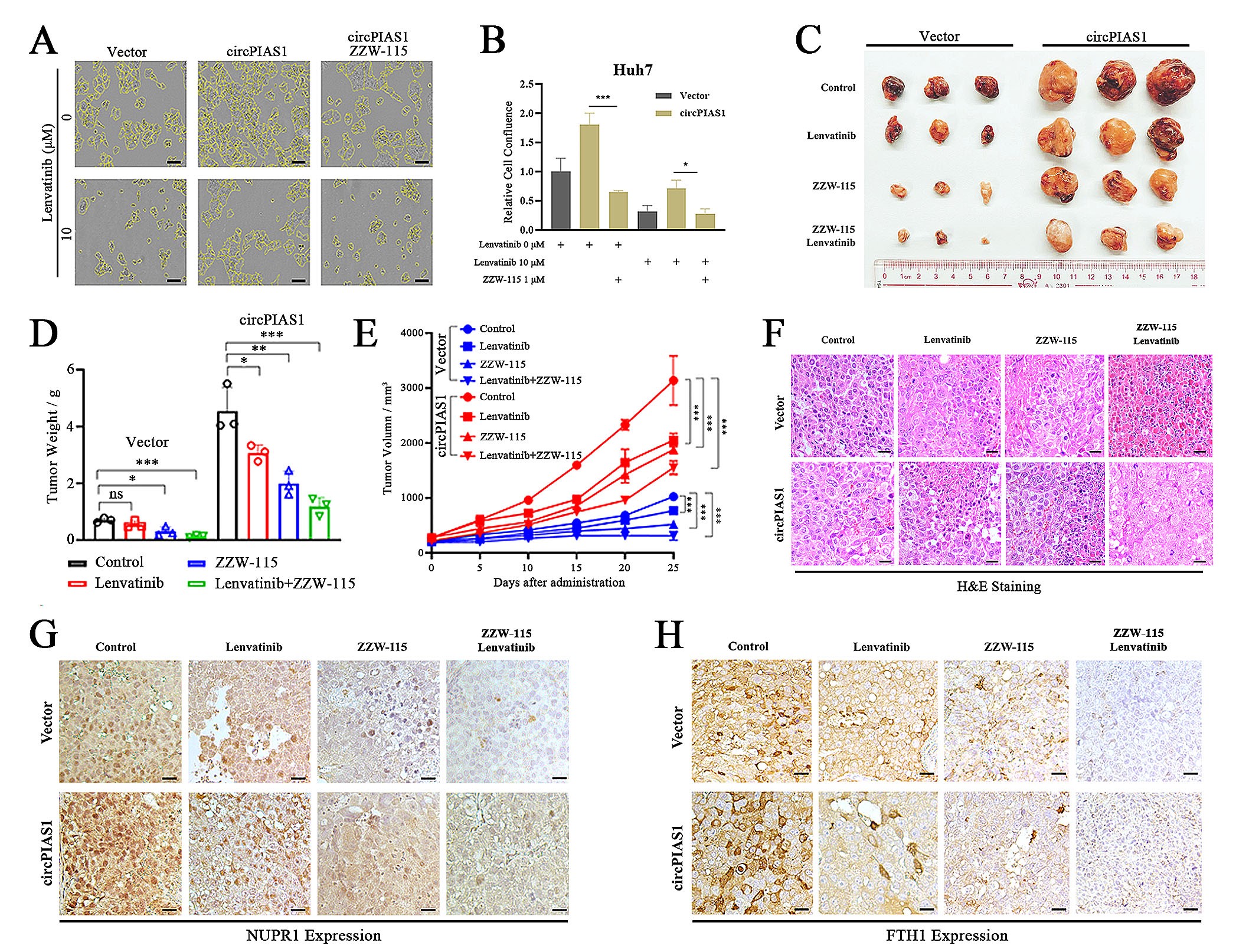
图8. ZZW-115在体内诱导铁死亡,并提高HCC对lenvatinib的敏感性
综上所述,本研究不仅揭示了CircPIAS1通过miR-455-3p/NUPR1/FTH1调控轴调节HCC细胞的铁死亡进而调控HCC的进展,为HCC的诊断和治疗提供了新的分子标志物和潜在靶点,而且研究发现ZZW-115能够逆转CircPIAS1介导的促癌效应,并增强对现有靶向药lenvatinib的敏感性,为HCC联合治疗策略提供了新思路,具有重要的临床应用前景。
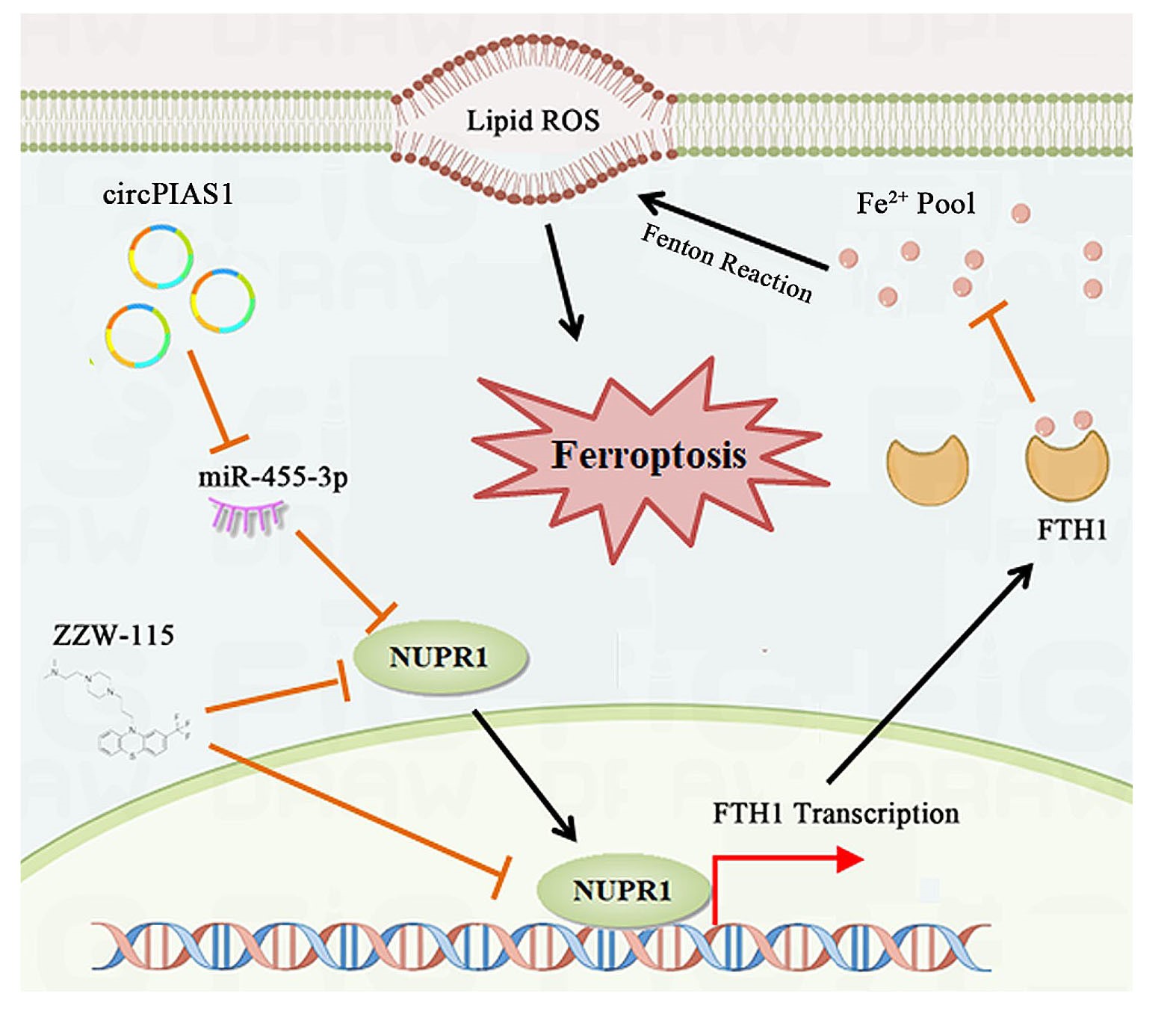
图9. CircPIAS1在HCC中的促癌机制示意图

查看更多

查看更多

查看更多

联系我们

返回顶部