查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

2024年5月20日大连医科大学肿瘤干细胞研究院刘强和崔柏团队在国际知名期刊Cell Metabolism( IF: 27.7)上发表了题为《Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis》的重要研究成果。研究发现脂肪酸氧化(FAO,fatty acid oxidation)可作为昼夜节律“感应器”,感知节律紊乱并传递致癌代谢信号,提高睡眠不足(SD,sleep deficiency)人群的肺肿瘤发生率。
文章所用汉恒产品如下:
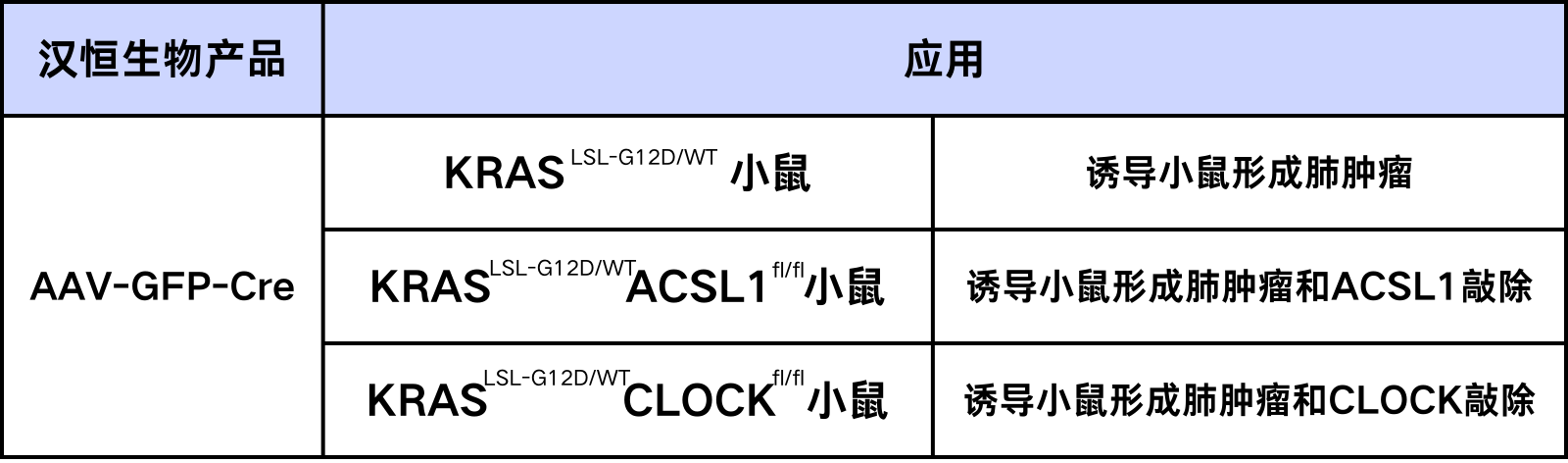
昼夜节律紊乱是现代生活方式的一个显著特点。睡眠不足会打乱昼夜节律,导致免疫功能障碍、代谢紊乱、甚至过早死亡等。已有研究表明睡眠不足会刺激癌症转移、肿瘤生长和癌症免疫逃逸。哺乳动物的新陈代谢也具有昼夜节律性,在癌症发展过程中,昼夜节律紊乱改变了许多代谢过程,包括葡萄糖、谷氨酸、胆汁酸和脂质代谢。然而,代谢重组感知节律紊乱如何影响SD促进的癌症发展仍不清楚。
在本研究中发现:SD扰乱CLOCK节律振荡,从而超激活ACSL1,加速FAO以增强肿瘤干性和生长;反过来,ACSL1合成的PA-CoA诱导ZDHHC5介导的CLOCK Cys194位点的棕榈酰化,可以抑制泛素-蛋白酶体降解而稳定CLOCK蛋白。进一步发现恢复β-内啡肽节律可以恢复CLOCK和ACSL1的节律,从而逆转SD促进的FAO紊乱和肿瘤干性。总之,作者的研究结果表明,FAO作为昼夜节律“感应器”将SD与肺肿瘤发生联系起来,并提出了β-内啡肽时间疗法策略为SD相关癌症患者提供了一种潜在治疗方法。
下面,我们一起来了解具体的研究内容吧:
1.FAO感知SD条件下的昼夜节律紊乱
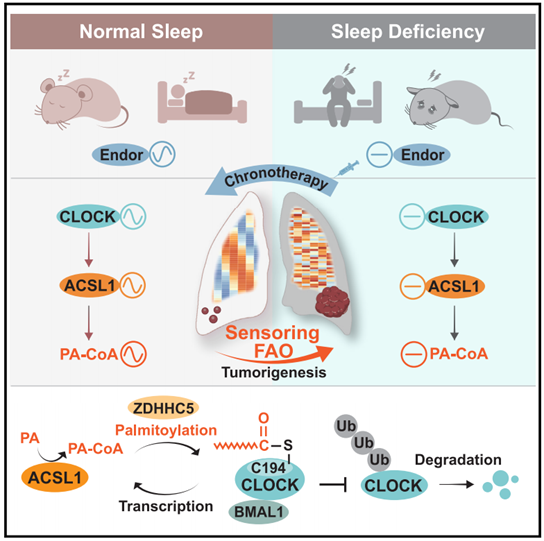
为了研究SD对肺生理节律的影响,作者对野生型C57BL/6J小鼠进行SD处理4周(图1A),与对照组相比,SD小鼠睡眠模式显著不同,表现为觉醒时间延长,而在非快速眼动(NREM)和快速眼动(REM)睡眠中的时间变短(图1B),证明成功建立了SD小鼠模型。之后对其肺组织进行转录组和代谢组相关分析,RNA-seq数据分析发现3284个基因在SD小鼠中失去了昼夜节律,GO分析发现这些基因主要富集于脂质代谢相关生物过程,尤其是FAO(图1C和D)。为了进一步研究SD处理对FAO节律的影响,作者进行了UHPLC-MS分析,发现SD小鼠肺中节律性脂质代谢物数量显著减少,与对照组相比,有47种节律性紊乱的脂质代谢物,其中游离脂肪酸FFAs占比最高(图1E-G)。峰值位相分布分析显示在对照组和SD小鼠中代谢物的震荡模式也不相同(图1H和I)。以上数据表明FAO在基因表达水平和代谢功能上感知生理状态下SD诱导的节律紊乱(图1J)。
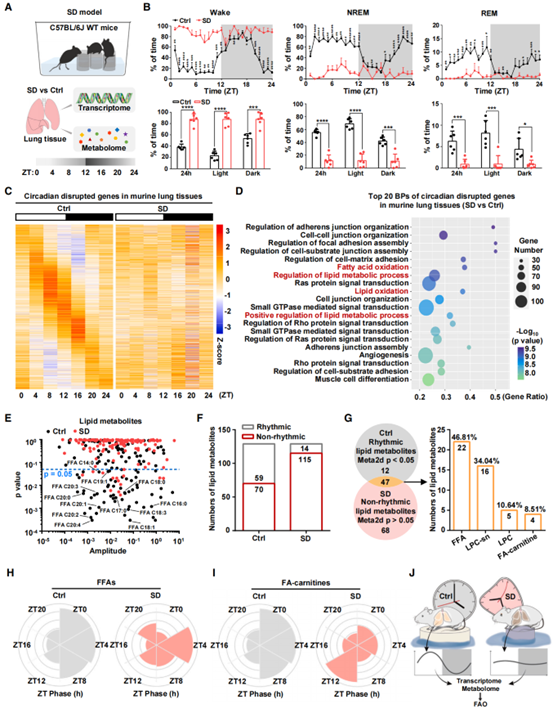
图1. SD条件下,FAO感知昼夜节律紊乱
2.FAO节律紊乱维持SD诱导的肺癌干性
昼夜节律紊乱可以促进肺癌发展,但其潜在机制仍不清楚。因此,作者进一步研究SD诱导的FAO节律紊乱是否在肺癌发展中存在作用。首先作者利用汉恒生物提供的AAV-GFP-Cre病毒对KRASLSL-G12D/WT小鼠进行气管内注射表达Cre,诱导小鼠形成肺肿瘤。病毒注射2天后进行SD造模,并分别在注射后第2/3/5/7周进行CT成像,CT成像显示SD处理加速了肺肿瘤的发生发展(图2A)。且在第7周进行的HE、IHC和表达分析显示(图2B和C),SD处理促进了Ki-67及干性标记物MYC、SOX2、CD166和NANOG基因的表达。为了进一步验证SD对人源性肺癌的促进作用,作者在NOD/SCID小鼠构建了病人来源的异种移植PDX模型,同样的,SD处理增加了PDX肿瘤体积(图2D和2E),降低了荷瘤小鼠的存活率(图2F),并提高了肿瘤组织中干性标志物的表达(图2G)。为了确定SD处理促进肿瘤发生的机制,作者对KRASLSL-G12D/WT小鼠肺肿瘤样本进行了RNA-seq分析。与对照组相比,SD组有827个基因显著上调,GO分析显示,这些上调的基因大部分属于脂肪酸代谢过程,特别是FAO(图2H),与图1D结果一致。肺肿瘤的脂质代谢组学分析显示,SD处理后FA-carnitines增加,FFAs减少(图2I)。此外,FAO的终产物乙酰辅酶A和ATP在KRASLSL-G12D/WT小鼠肺肿瘤中增加,且在SD处理的LLC1同源移植肿瘤中表现出节律紊乱(图2J和K)。以上数据表明在多种肺癌模型中FAO感知SD诱导的基因表达和代谢物的节律紊乱。为了证实FAO介导SD诱导的肿瘤发生和癌变,作者给予KRASLSL-G12D/WT 小鼠FAO抑制剂乙莫克舍(ETO)处理。ETO逆转SD所诱导的肿瘤(图2L)及Ki-67和CD166的高表达(图2M)。此外,对LLC1同源移植肿瘤来源的原代细胞的极限稀释分析(ELDA)和成球实验表明,ETO处理抑制了SD诱导的成球能力(图2N)。综上所述,这些数据表明FAO感知昼夜节律紊乱是SD促进肺癌干性的基础(图2O)。
图2. FAO节律紊乱维持SD诱导的肺癌干性
3.ACSL1合成的PA-CoA有助于SD促进肺癌干性
进一步作者通过比较野生型C57BL/6J小鼠肺组织中昼夜节律紊乱的FAO基因和KRASLSL-G12D/WT小鼠肺肿瘤中上调的FAO基因来确定SD诱导FAO节律紊乱促进肺癌干性的关键分子,发现了13个可能与SD引起的致癌FAO节律紊乱有关的基因(图3A)。其中,ACSL1 表达水平在SD处理的KRASLSL-G12D/WT小鼠肺肿瘤和PDX模型中显著升高(图3B和C)。此外,与对照相比,SD处理的LLC1同源移植肿瘤中ACSL1 mRNA的节律性表达紊乱(图3D)。为了证实ACSL1在SD促进的肺肿瘤发生和肿瘤干性中的作用,作者建立了KRASLSL-G12D/WTACSL1fl/fl小鼠,并通过气管内注射汉恒生物提供的AAV-GFP-Cre病毒诱导肺癌和ACSL1敲除(图3E)。可以看到ACSL1敲除逆转SD促进的肺癌进展(图3F)。同样的,PDX模型中ACSL1的敲除(KO-A1)也可阻断SD的促肿瘤作用(图3G、H),并验证了PDX模型中,SD需要ACSL1来促进肿瘤干性(图3I)。为了确定ACSL1在SD下促进肺癌干性所利用的代谢物,作者分析了可能作为ACSL1底物和产物的长链(12-20碳)FAO代谢物。数据表明,SD条件下ACSL1敲除的KRASLSL-G12D/WT小鼠肿瘤中各种FFAs向FA-carnitines的转化被阻断(图3J)。由于棕榈酸(PA,FFA 16:0)是最主要的饱和脂肪酸(占人体脂肪酸的20%-30%),ACSL1可将PA转化为PA-CoA,并进一步以PA-carnitine的形式转运到线粒体中促进FAO过程,作者结合实验数据表明,PA-CoA回复了ACSL1敲低所导致的肿瘤干性(图3K和L)和肿瘤生长(图3M和N)的抑制。以上结果表明,SD破坏ACSL1节律,过度激活其将PA转化为PA-CoA的能力,进而刺激FAO促进肺肿瘤生长和干性(图3O)。
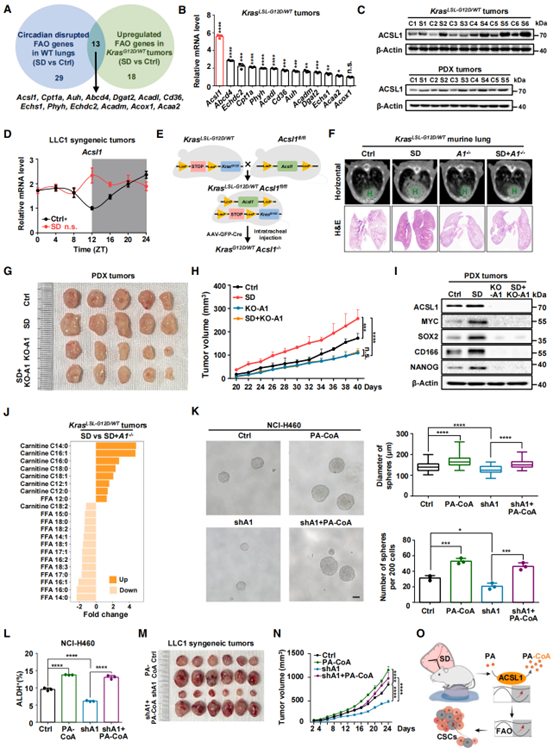
图3. ACSL1合成的PA-CoA有助于SD促进肺癌干性
4.ACSL1感知SD诱导的CLOCK节律紊乱,促进肺肿瘤发生
接下来,作者通过进一步实验来确定SD破坏ACSL1节律以促进肺肿瘤发生的机制。通过沉默可能调控ACSL1表达的核心时钟基因(CCGs),作者筛选出CLOCK和BMAL1与ACSL1 mRNA的表达呈正相关(图4A)。此外,在LLC1同源移植肿瘤中,SD打乱了CLOCK mRNA和蛋白的昼夜节律,且处于高表达水平,但对BMAL1 mRNA的表达没有显著影响(图4B和C)。同样,在KRASLSL-G12D/WT肿瘤中,SD也上调CLOCK蛋白水平(图4D)。为了研究CLOCK和BMAL1是否通过转录调节ACSL1的表达,作者分析了cstrome data Browse的数据,证实了在U2OS和LoVo细胞中,CLOCK和BMAL1与ACSL1的启动子区域都有结合(图4E),且ChIP-qPCR(OLFML3组为阳性对照)和荧光素酶报告实验鉴定出ACSL1启动子上的E-box2元件是CLOCK-BMAL1介导ACSL1反式激活的结合位点(图4F和G)。接着,作者构建KRASLSL-G12D/WTCLOCKfl/fl小鼠,并通过气管内注射汉恒生物提供的AAV-GFP-Cre病毒诱导肺癌和CLOCK敲除。CLOCK敲除抑制SD引起的肿瘤(图4H和I),且在PDX模型和LLC1同源移植肿瘤中,敲除CLOCK逆转SD的促肿瘤生长和肿瘤干性作用(图4J和K)。总之,以上结果表明SD诱导的CLOCK节律紊乱通过转录调控ACSL1的表达来促进肺肿瘤发生过程中的肿瘤干性(图4L)。
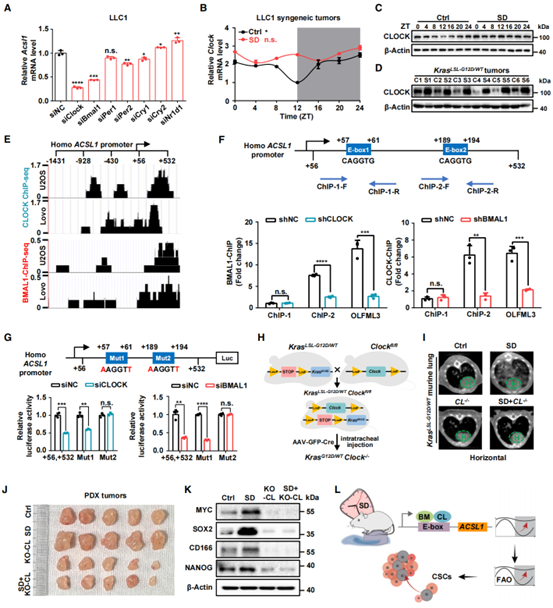
图4. ACSL1感知SD诱导的CLOCK节律紊乱,促进肺肿瘤发生
5.ACSL1诱导ZDHHC5介导的CLOCK Cys194棕榈酰化,抑制泛素化降解稳定CLOCK蛋白
作者进一步探究了SD诱导的昼夜节律紊乱下维持高水平CLOCK的机制,发现敲低ACSL1降低了CLOCK的蛋白水平,但不影响其mRNA水平。由于ACSL1催化的PA-CoA可作为蛋白棕榈酰化的底物,作者探索了棕榈酰化在ACSL1-CLOCK相互作用中的角色。利用棕榈酰化抑制剂2-BP或棕榈酰化增强剂PB处理证实了CLOCK中存在棕榈酰化(图5A和B)。敲低ACSL1抑制CLOCK的棕榈酰化和蛋白水平,但PA-CoA处理可以逆转ACSL1敲低的作用(图5C)。为了确定调节CLOCK棕榈酰化和蛋白水平的棕榈酰转移酶,作者通过siRNA筛选出ZDHHC5介导了CLOCK的棕榈酰化(图5D),而ACSL1敲低可阻断ZDHHC5以及SD处理诱导的CLOCK棕榈酰化(图5E和F),且SD可打乱CLOCK棕榈酰化的节律(图5G)。结合在线网站预测显示CLOCK中第7和194位半胱氨酸残基是其潜在的棕榈酰化位点,并在各物种中保守(图5H)。通过表达半胱氨酸突变体筛选出Cys194是CLOCK主要的棕榈酰化位点(图5I),且C194S突变阻断了ACSL1敲低诱导的CLOCK棕榈酰化抑制(图5J)。为了进一步研究CLOCK棕榈酰化是否通过抑制其蛋白降解来维持其稳定性,作者利用蛋白质合成抑制剂CHX和蛋白酶体抑制剂MG132验证了ACSL1介导的CLOCK Cys194棕榈酰化通过抑制泛素-蛋白酶体降解途径来稳定CLOCK(图5K-M)。综上所述,ACSL1以依赖于ZDHHC5的方式介导CLOCK Cys194位点棕榈酰化,CLOCK的棕榈酰化通过抑制泛素-蛋白酶体降解途径来维持CLOCK稳定性(图5N)。
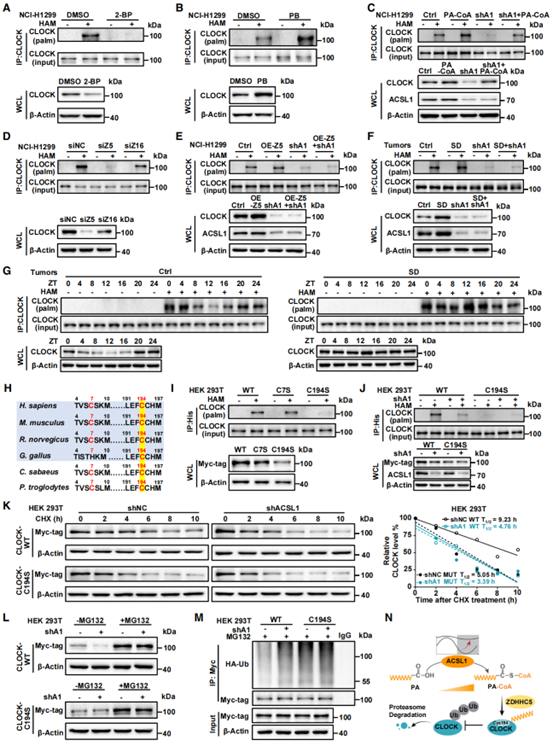
图5. ACSL1诱导ZDHHC5介导的CLOCK Cys194棕榈酰化可通过抑制泛素化降解来稳定CLOCK蛋白
6.恢复β-内啡肽节律可恢复SD打乱的CLOCK/ACSL1节律,减轻肺癌干性
由于睡眠失调会扰乱内分泌,激素的节律异常在SD相关癌症中起重要作用。作者从14种睡眠相关激素中,发现β-内啡肽(Endor)可显著下调CLOCK和ACSL1 mRNA的表达(图6A)。为了研究Endor的时间治疗法,作者对SD处理的LLC1同源移植肿瘤小鼠进行每日(ZT8/ZT20,ZT:Zeitgeber time,授时因子)或渗透压泵持续给药(图6B),发现ZT8-Endor可明显逆转SD促进的肿瘤生长(图6C)。通过ELISA实验对血清Endor水平评估及检测CLOCK和ACSL1的表达发现,ZT8-Endor可成功将SD组Endor及CLOCK和ACSL1的表达节律恢复到与对照组一致的模式(图6D-F),且可以抑制肿瘤干性标记物的表达(图6G-I)。此外,为了确定ACSL1在Endor时间治疗法中的作用,作者利用ACSL1敲低的LLC1肿瘤小鼠进行验证发现Endor时间治疗作用由ACSL1介导(图6J-N)。以上结果表明Endor的时间治疗法可重置被SD打乱的Endor、CLOCK和ACSL1的节律,具有良好的抗肿瘤效果(图6O)。
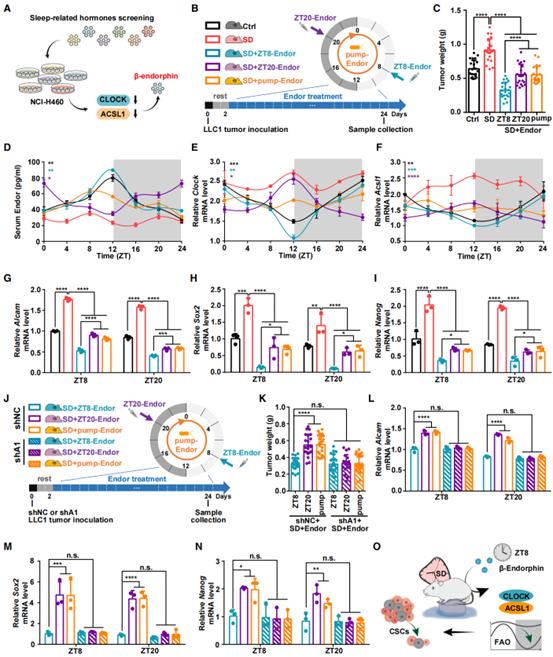
图6. 恢复β-内啡肽节律可恢复SD打乱的CLOCK/ACSL1节律,从而减轻肺癌干性
7.睡眠质量和β内啡肽水平与肺癌患者的CLOCK/ACSL1表达和不良预后呈负相关
为了评估研究结果的转化潜力,作者进行了前瞻性和回顾性研究(图7A)。前瞻性研究记录肺癌患者的血清Endor水平和睡眠质量与肺癌发展之间的临床相关性。对66位患者的睡眠质量评估显示血清Endor水平与清醒次数负相关,与深度睡眠和快速眼动睡眠REM的比例正相关(图7B-D)。其次,采用匹兹堡睡眠质量指数(PSQI)问卷对60位患者进行睡眠质量评估,数据显示血清Endor浓度与睡眠评分呈负相关(评分越高,睡眠质量越差)(图7E)。因此,SD与低血清Endor水平和较晚期癌症阶段相关。以上临床数据证明了Endor与睡眠质量正相关,并表明血清Endor水平是癌症发展的潜在预测因子。为了评估肺癌患者血清Endor、生化参数和预后因素之间的相关性,作者对62例既往肺癌患者进行了回顾性研究。证明了血清Endor水平与免疫组化分析评估的CLOCK、ACSL1、CD166和Ki-67评分呈负相关(图7F-7I),且ACSL1表达与CLOCK、CD166和Ki-67的表达呈正相关(图7J)。KM总生存期(OS)分析显示,高Endor血清水平具有正向预后价值(图7K),CLOCK、ACSL1、CD166或Ki-67的高表达具有负向预后价值(图7L-N)。此外,手术采集的肺癌组织中CLOCK和ACSL1的蛋白水平高于邻近正常组织(图7O)。综上表明SD、Endor、CLOCK和ACSL1可能是肺癌的独立预后因素。
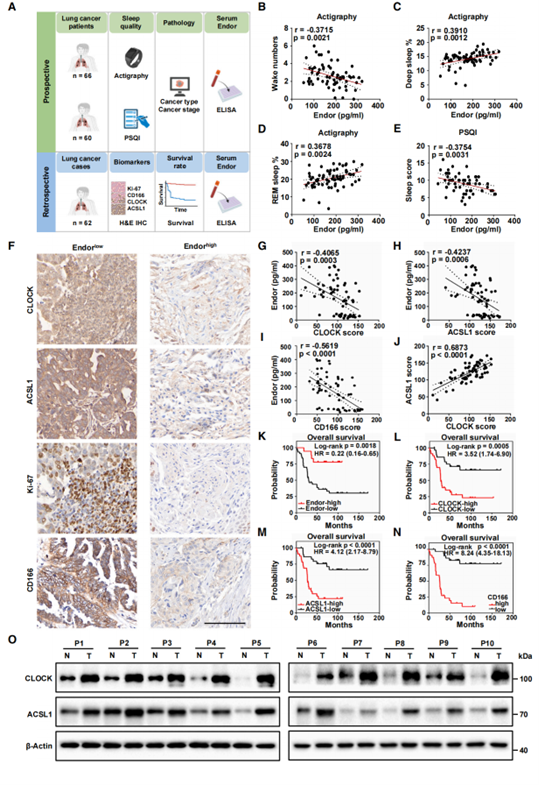
图7.睡眠质量和β内啡肽水平与肺癌患者的CLOCK/ACSL1表达和不良预后呈负相关
综上所述,文章研究结果表明FAO感知昼夜节律紊乱与SD和肿瘤发生相协调。对于SD的癌症患者,使用β-内啡肽进行时间疗法是一种潜在策略。该研究提示了可对肿瘤发展过程中持续的昼夜节律紊乱进行了解并干预,同时也为癌症治疗带来了新的挑战和机遇。
文章链接: https://doi.org/10.1016/j.cmet.2024.04.018

查看更多

查看更多

查看更多

联系我们

返回顶部