查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
类鼻疽的病原体为类鼻疽伯克霍尔德菌(Burkholderia pseudomallei),通常由身体损伤、食用或吸入气溶胶细菌引起,雨季发病率较高。目前全球类鼻疽诊断不足的主要原因是临床症状的非特异性和专业微生物实验室的匮乏,致使该病的死亡率高达40%。大量研究表明,包括病毒、细菌等在内的多种病原体及其成分可操纵宿主细胞的线粒体自噬,以提高其细胞内存活率或逃避宿主免疫。目前B. pseudomallei在细胞内的存活策略尚未完全被揭露,针对类鼻疽尚未开发出有效疫苗,因此针对其发病机制进行深入研究迫在眉睫。

2024年6月,陆军军医大学李茜、邹全明、毛旭虎和北京大学刘晓云作为共同通讯作者在《Nature Communications》上发表题为“Burkholderia pseudomallei BipD modulates host mitophagy to evade killing”的研究论文。在本研究中,作者使用B. pseudomallei模型系统来证实细胞内的细菌病原体是否会促使宿主免疫细胞进行线粒体自噬以促进细菌存活。结果显示,B. pseudomallei通过Ⅲ型分泌系统针尖蛋白BipD操纵宿主线粒体自噬以实现其细胞内存活,同时进一步揭示了其中的分子机制:BipD通过与Kelch样家族成员KLHL9和KLHL13的Back的Kelch结构域结合,以募集泛素连接酶CUL3应答B. pseudomallei感染。虽然KLHL9/KLHL13/CUL3复合物不参与感染性疾病的调控,但对于小鼠巨噬细胞中线粒体的BipD依赖性泛素化却至关重要。从机制上讲,通过宿主泛素组分析发现线粒体内膜蛋白IMMT是KLHL9/KLHL13/CUL3复合物的底物,而IMMT K211位点的K63链式泛素化是启动宿主线粒体自噬的必要条件,可减少线粒体ROS的产生。本研究剖析了细菌病原体为生存而操控宿主线粒体自噬的独特机制,这一机制的发现揭示了在先天免疫中病原体和宿主之间复杂互作的一个“新奇角度”。
该研究团队使用了汉恒生物提供的线粒体自噬工具腺病毒mt-Keima,对线粒体自噬的变化情况进行了具体的观察。
下面,我们一起来了解具体的研究内容:
1. B. pseudomallei诱导巨噬细胞中线粒体自噬的发生
为探讨B. pseudomallei感染后细胞线粒体的质量控制机制,作者首先测量了线粒体膜电位(MMP,Δψm)的变化,发现B. pseudomallei感染会导致Δψm的显著损失。接着发现RAW264.7和小鼠腹膜巨噬细胞(PMs)在感染后,细胞中的线粒体DNA(mtDNA)和蛋白质(HSP60和TIM23)的水平随感染时间和感染复数(MOI)的升高而显著降低,且观察到线粒体与LC3及溶酶体共定位均显著增加,通过透射电镜可以观察到细胞内出现更多由自噬体/自噬酶体包围的线粒体。这些结果证实了B. pseudomallei感染具有诱导小鼠巨噬细胞发生线粒体自噬的能力,且这种自噬依赖于传统的自噬。
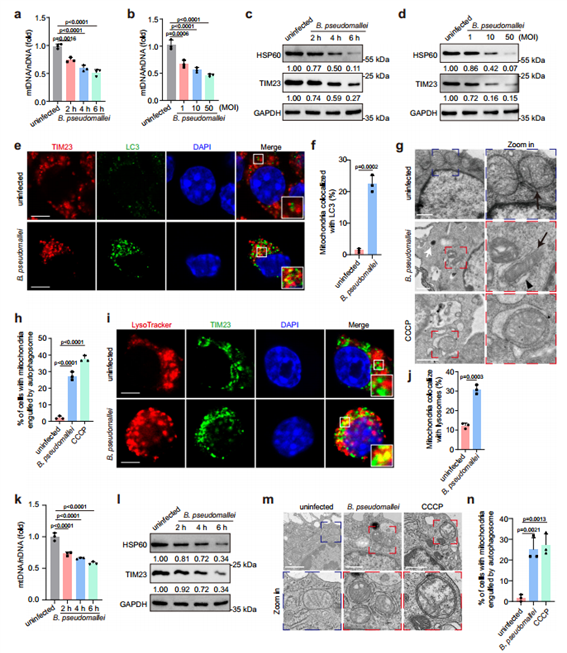
图1. B. pseudomallei感染诱导小鼠巨噬细胞的线粒体自噬
2. B. pseudomallei通过降低线粒体活性氧(mtROS)劫持宿主的自噬来维持其生存
在证实B. pseudomallei感染会诱导巨噬细胞发生自噬后,作者开始研究线粒体自噬对B. pseudomallei在细胞内存活的影响。结果发现刺激线粒体自噬可以提高B. pseudomallei在体内外细胞内的存活率。随后,作者进一步解析线粒体自噬有助于B. pseudomallei存活的机制。mtROS可作为促炎信号或产生过氧化氢来促进细胞内细菌的杀伤,在既往细菌感染的研究中mtROS被认为在细胞内免疫反应中发挥着重要作用。基于此,作者继续探索了巨噬细胞中mtROS的产生对B. pseudomallei的有效清除的影响。通过免疫荧光染色对细菌定量,作者发现当RAW264.7细胞内保持较低的mtROS水平时,细胞内具有较高的细菌滴度。随后作者利用mtROS清除剂MitoTEMPO处理细胞以验证mtROS对细胞内B. pseudomallei清除的影响。结果发现这一处理显著促进了巨噬细胞内B. pseudomallei的存活。在体外实验中也得到了验证。综上,作者确认B. pseudomallei通过诱导线粒体自噬,降低宿主细胞中mtROS的水平,来提高其细胞内的存活率。
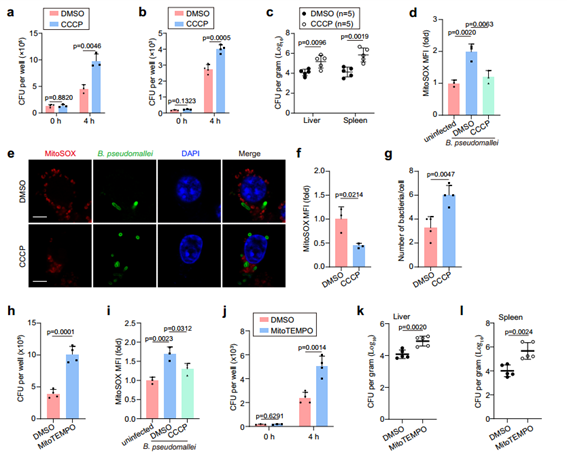
图2. B. pseudomallei在体内和体外启动线粒体自噬以降低mtROS细胞内存活
3. B. pseudomallei感染后BipD诱导宿主自噬
为了进一步研究B. pseudomallei诱导宿主线粒体自噬所涉及的分子途径,基于前期研究,作者锁定了8种作为B. pseudomallei关键毒力因子的Ⅲ型分泌蛋白进行过表达,发现BipD在调节线粒体自噬方面的作用最为显著。随后为验证BipD介导的线粒体自噬是否会降解解偶联剂CCCP诱导的受损线粒体,作者使用CCCP处理过表达BipD的细胞,发现BipD过表达细胞中Δψm的恢复比对照细胞强,表明BipD可调节线粒体自噬,但不足以诱导线粒体自噬。随后,作者通过野生型和ΔBipD缺失型B. pseudomallei感染PMs,发现两者均可引起线粒体的结构变化,且ΔbipD型感染导致的线粒体结构损伤现象更明显,而ΔBipD型在PMs中的生长效率低于WT菌株,并且这种表型可以通过补足BipD恢复。这些结果表明,BipD在B. pseudomallei感染后诱导宿主线粒体自噬中起重要作用。
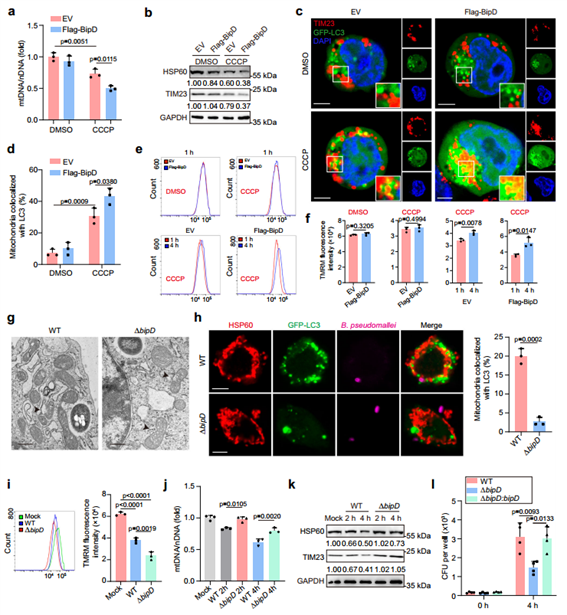
图3. B. pseudomallei感染诱导宿主线粒体自噬依赖于BipD
4. BipD与含BTB的KLHL9和KLHL13复合物进行结合
确定BipD在诱导宿主细胞线粒体自噬中的作用后,作者通过质谱(MS)分析可以与BipD结合的蛋白质,进一步探索BipD的底物。最终成功鉴定出与BipD相互作用的前3个靶点,分别为KIF11、KLHL9和KLHL13,而KLHL家族蛋白是E3连接酶CUL3介导的泛素化的重要参与者。因此,作者推测BipD可能与KLHL9和KLHL13相互作用,随后通过co-IP实验和GST pulldown实验均证实了这一猜测。随后,为了确认BipD在KLHL9或KLHL13上的结合位点,作者通过构建KLHL9和KLHL13的不同缺失突变体,确定了KLHL9和KLHL13的Back和6个Kelch重复结构域的结构是与BipD结合的核心区域。
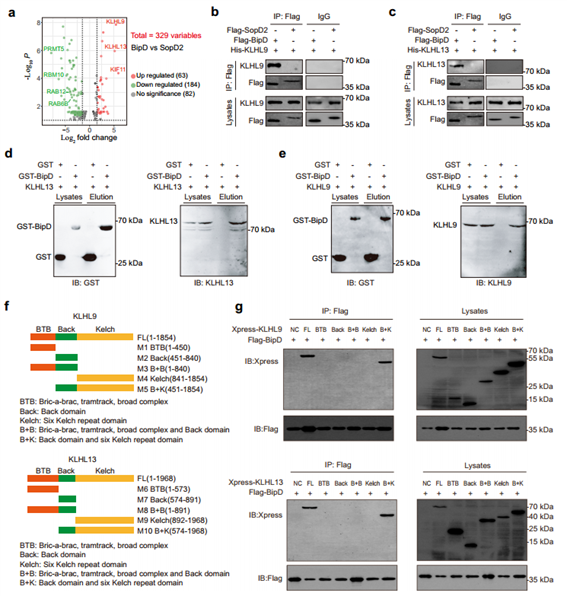
图4. BipD与KLHL9和KLHL13相互作用
5. BipD和KLHL9/KLHL13/CUL3复合物通过靶向IMMT协同作用于泛素化线粒体
线粒体泛素化是线粒体自噬过程中的关键步骤,上述提到KLHL9和KLHL13通过CUL3参与泛素化,作者通过co-IP分析发现BipD可以与KLHL9/KLHL13/CUL3复合物相互作用,且当分别敲低Klhl9、Klhl13或CUL3时,会导致线粒体的泛素化水平降低,同时验证了B. pseudomallei感染后线粒体膜蛋白IMMT的泛素化水平升高,因而推断IMMT是BipD介导的线粒体泛素化底物。为了探究CUL3、KLHL9和KLHL13在BipD依赖性线粒体底物降解中的作用,作者使用野生型B. pseudomallei感染细胞后,发现无论敲低CUL3、KLHL9或KLHL13均会导致IMMT蛋白水平升高,但其mRNA水平不受影响。为了进一步证实泛素化修饰后基于CUL3的降解对IMMT的影响,作者通过抑制细胞泛素化或过表达CUL3可引起感染后的RAW264.7细胞中IMMT水平的上调或下降,CUL3敲低则可延长IMMT的半衰期。事实上,泛素化蛋白一般通过泛素蛋白酶体系统或自噬溶酶体途径进行降解。因此,作者通过相应试剂分别处理感染后的RAW264.7细胞,最终确定溶酶体抑制剂Baf A1可以提高感染细胞中IMMT的表达水平。综上作者推断,BipD与KLHL9/KLHL13/CUL3复合物相互作用,使线粒体底物IMMT泛素化,并在B. pseudomallei感染后通过自噬—溶酶体途径促进其降解。
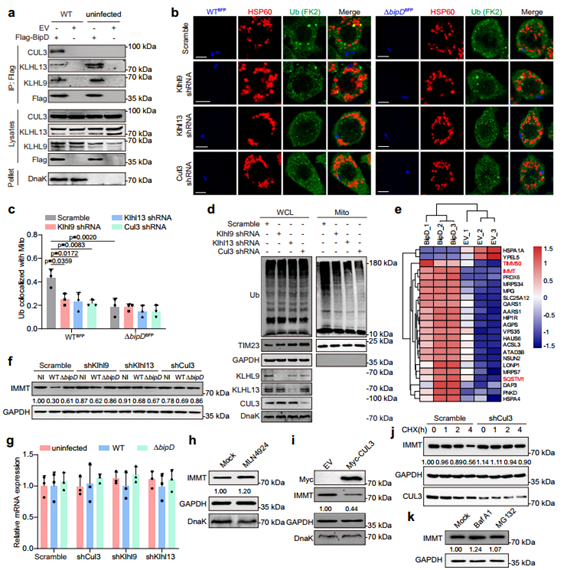
图5. BipD通过靶向IMMT招募KLHL9/KLHL13/CUL3复合体使线粒体泛素化
6. CUL3促进IMMT的K63链式泛素化
为了进一步确认KLHL9/KLHL13/CUL3复合物在IMMT泛素化中的作用。作者使用不同的去泛素酶进一步确定IMMT的泛素化方式——K63链式泛素化;最后通过IP分析确定了CUL3介导的IMMT K63链式泛素化关键位点——IMMT的K211;揭示了CUL3介导IMMT在K211赖氨酸残基上发生K63链式泛素化,从而通过自噬-溶酶体途径促进IMMT的降解。
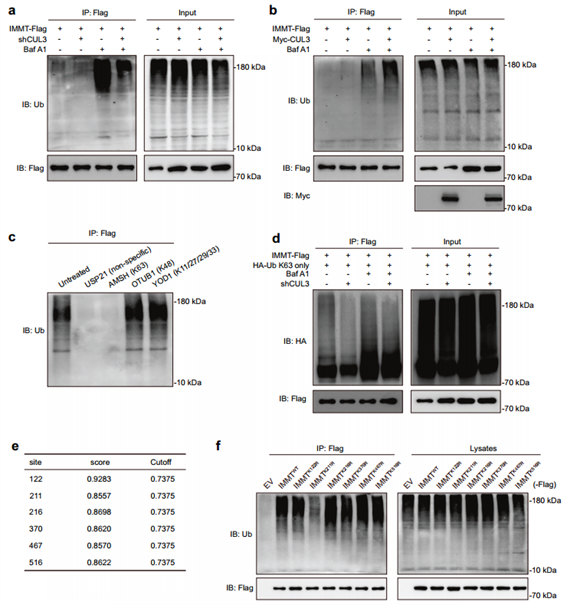
图6. CUL3通过k63连接的泛素链泛素化IMMT
7. B. pseudomallei感染时BipD介导的线粒体自噬需要CUL3和IMMT的参与
为了检测B. pseudomallei感染后,基于CUL3的IMMT泛素化是否能诱导线粒体自噬,作者分别构建了CUL3和IMMT敲除的RAW264.7细胞。作者评估了B. pseudomallei感染介导的线粒体自噬对IMMT K211的需求,结果显示B. pseudomallei感染诱导了IMMT野生型过表达细胞中明显的线粒体自噬信号,而在IMMT K211突变体过表达细胞中则没有这一现象,说明K211是B. pseudomallei诱导的线粒体自噬发生的关键位点。而对于感染后细胞mtROS的产生情况,结果显示CUL3和IMMT的缺失可以中和ΔBipD型感染导致的高mtROS水平。最后,作者验证了IMMT泛素化对B. pseudomallei在体内的毒力和细胞内活力的影响,结果显示泛素化抑制剂MLN4924处理明显降低了野生型B. pseudomallei的毒力和细胞内的存活力,对于ΔBipD型细菌感染的小鼠则没有影响。表明BipD介导的IMMT泛素化对于B. pseudomallei在细胞内的存活发挥了至关重要的作用。
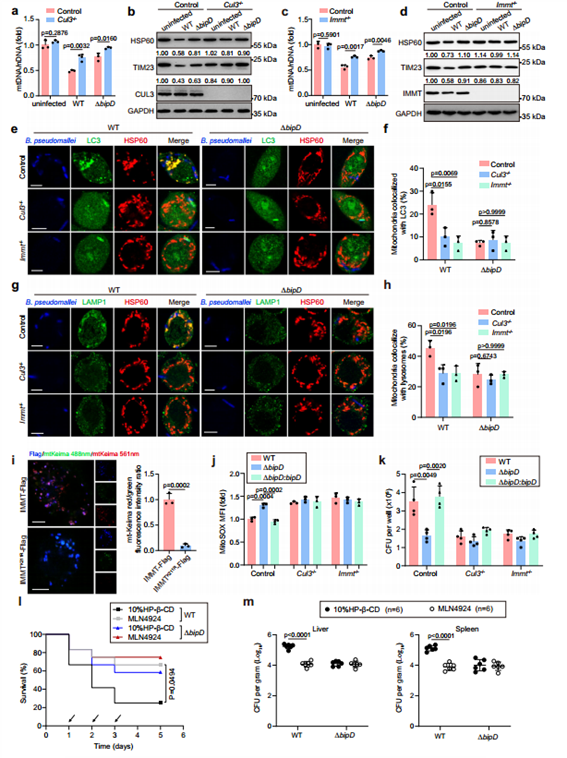
图7. CUL3和IMMT对BipD介导的B. pseudomallei感染后线粒体自噬的功能起重要作用
本研究鉴定了BipD作为B. pseudomallei感染后诱导线粒体自噬的关键分子,以泛素依赖的方式操纵KLHL9/KLHL13/CUL3 E3连接酶复合物来介导宿主细胞中的线粒体自噬,从而逃避宿主免疫,增强自身在细胞内的存活,揭示了细菌破坏宿主先天免疫反应的一种新型机制。

查看更多

查看更多

查看更多

联系我们

返回顶部