查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
骨骼作为人体主要的承重组织,持续承受机械力的作用,但当正常的机械负荷模式被破坏,例如长期卧床或太空飞行等,可能会导致骨骼重建失衡,从而引起骨质疏松等病症。最新研究表明,破骨细胞可以独立于骨细胞直接感知机械负荷并激活下游通路,进而影响破骨细胞的发生,但是破骨细胞生理机械传感器的特性以及控制破骨细胞生成的细胞机制尚不清楚。接下来,我们要介绍的这篇文献针对性研究了PC1(Polycystin-1,由Pkd1基因编码,骨形成中的关键蛋白)在破骨细胞发生和骨吸收中的调节机制,为骨质疏松药物新靶点的开发提供了重要支撑。在此研究中,作者使用了汉恒生物提供的AAV2/2-F4/80-Cre-ZsGreen以构建骨髓巨噬细胞特异性敲除TAZ(Transcriptional coactivator with a PDZ-binding motif,带有PDZ结合基序的转录共激活因子)的小鼠模型。

2024年4月23日,中南大学湘雅医院李长俊教授、雷光华教授、罗湘杭教授、曾超教授作为共同通讯作者在Science Bulletin(IF=18.9)上发表题为“Mechanical protein polycystin-1 directly regulates osteoclastogenesis and bone resorption”的研究论文。据报道,PC1是一种典型的应力传感蛋白,广泛表达于肾脏和其他组织中,在成骨细胞介导的骨形成中起着至关重要的作用。在本研究中,作者发现PC1可以调节破骨细胞的发生和骨吸收。作者通过CO-IP实验证实,PC1与转录共激活因子TAZ在破骨细胞中有强烈的相互作用关系,并发现PC1通过C端尾部(cytoplasmic C-terminal tail ,CTT)显著结合TAZ,PC1能够促进TAZ向细胞核内转移,而敲低PC1或使用抑制剂阻断PC1-CTT的释放则会抑制这一过程,这些结果表明,PC1通过影响TAZ的核定位间接调节破骨细胞分化相关基因的表达,从而促进破骨细胞的分化。另外,作者通过对TAZ的敲低和过表达调控分别观察到破骨细胞分化的减少和增多,以及骨片吸收能力的变化,证实了TAZ直接调控破骨细胞的形成和功能。鉴于PC1-TAZ轴在破骨细胞相关的骨质疏松症中的关键作用,文章提出通过药理学手段来抑制PC1-TAZ轴可抑制骨吸收,由此可能成为治疗由机械负荷减少或雌激素缺乏引起的骨质疏松的新策略。
下面,我们一起来了解下本文的主要研究结果:
为了研究PC1在破骨细胞发生中的作用,作者首先分析了PC1在破骨细胞中的表达水平,发现在破骨细胞分化的过程中,Pkd1的mRNA水平升高。为了阐明PC1在破骨细胞和生理性骨重塑中的作用,作者在不同的破骨细胞谱系中建立了3种(骨髓巨噬细胞、TRAP阳性破骨细胞和CSTK阳性破骨细胞)Pkd1特异性缺失的转基因小鼠模型。结果发现,与对照相比,这三种Pkd1特异性缺失的转基因小鼠的骨小梁数量和体积均有所增加,皮质骨厚度增加,骨表面的破骨细胞数量减少,骨间隙减小,这些数据表明,破骨细胞中PC1的缺失会抑制破骨细胞介导的骨吸收。
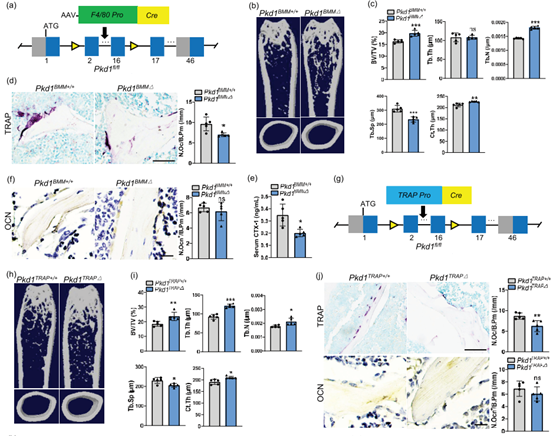
图1. 破骨细胞谱系中Pkd1缺失的小鼠表现出骨量增加和骨吸收减少
随后,作者研究了PC1在破骨细胞发生中的直接作用。首先,作者对敲低Pkd1的破骨细胞进行了转录组测序以及GO分析,发现差异表达基因在破骨细胞分化和骨吸收相关途径中显著富集。由于CTT被报道为PC1的关键功能组分,参与其生理和病理功能,因此,作者研究了PC1-CTT是否介导了PC1对破骨细胞发生的影响,通过在骨髓巨噬细胞(Bone marrow macrophages,BMMs)中进行PC1-CTT的过表达调控,发现可以导致破骨细胞相关基因表达、大破骨细胞数量和骨片吸收活性均增加。随后,作者使用了限制PC1-CTT裂解和释放的抑制剂—DAPT(γ-分泌酶抑制剂,文中使用浓度10μmol/L)处理BMMs,发现经DAPT处理后破骨细胞相关基因的表达下降,TRAP(抗酒石酸酸性磷酸酶,tartrate resistant acid phosphatase)阳性破骨细胞形成受损。这些结果表明PC1通过裂解和释放PC1-CTT促进破骨细胞的形成。
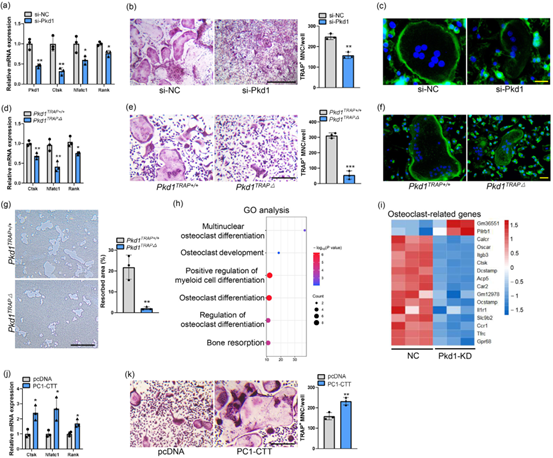
图2. PC1通过其C端尾部促进破骨细胞生成
为了确定PC1在机械负荷减少条件下对破骨细胞的作用,作者利用小鼠尾部悬吊模型模拟机械负荷减少状态,两周后收集小鼠的BMMs并观察到其中TRAP阳性破骨细胞数量、破骨细胞特异性基因和Pkd1的表达均增加。随后,在模拟微重力的条件下培养BMMs,并进行RNA-seq。GO分析显示,微重力处理的细胞中,与响应机械负荷和破骨细胞融合相关的基因以及Pkd1的表达均上调。接下来,作者利用破骨细胞谱系Pkd1特异性缺失的转基因小鼠模型探究了在机械负荷减少状态下PC1缺失对破骨细胞功能和骨吸收的影响,发现尾悬干预会导致WT小鼠的骨量减少、破骨细胞的数量增加,但是在破骨细胞谱系Pkd1特异性缺失的小鼠中没有发生显著变化。另外,为探究PC1是否也介导了雌激素缺乏所致的骨质流失,作者对TRAP阳性破骨细胞特异性缺失Pkd1的小鼠(Pkd1TRAP△)进行OVX(卵巢摘除)处理,结果也发现WT小鼠骨表面的骨小梁骨量减少、TRAP阳性破骨细胞数量增加,但Pkd1TRAP△小鼠中这种效应减弱。综上所述,这些数据表明破骨细胞可能对机械负荷减少做出反应,并通过PC1增加骨吸收。
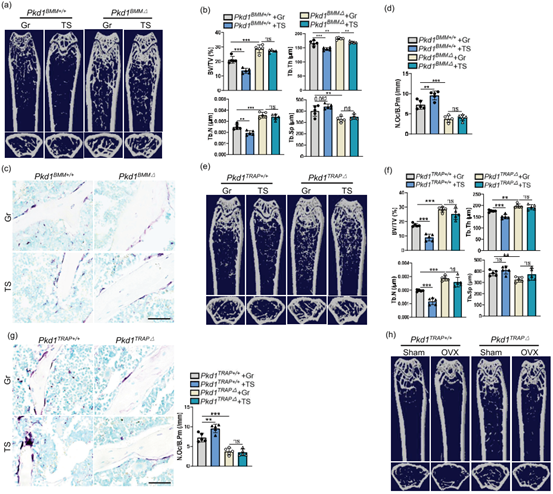
图3. 破骨细胞中Pkd1的缺失可防止由机械负荷减少和OVX引起的骨质流失
接着,作者研究了PC1促进破骨细胞发生的潜在分子机制。此前研究表明,PC1与转录辅激活因子TAZ相互作用,调节成骨细胞分化。所以作者研究了PC1是否与TAZ相互作用以调节破骨细胞分化。首先,作者通过CO-IP实验证实了PC1-CTT与TAZ存在相互结合,而且在破骨细胞分化过程中使用DAPT会抑制TAZ的核易位,但对TAZ本身的转录和翻译没有影响,表明PC1-CTT促进TAZ转运至细胞核。通过对TAZ的表达进行干预并结合RNA-seq和KEGG通路富集分析发现,在Taz敲低组中,破骨细胞分化相关通路被抑制,CTT对破骨细胞形成的促进作用被减弱。上述结果表明,TAZ促进破骨细胞分化,并可能介导PC1-CTT对破骨细胞形成的影响。为了进一步分析TAZ对体内破骨细胞发生和骨吸收的影响,作者在Tazfl/fl小鼠骨髓内注射AAV2-F4/80-Cre-ZsGreen,建立骨髓巨噬细胞特异性敲除Taz的小鼠模型(TazBMM△),发现与WT相比,TazBMM△的骨小梁体积、数量和厚度更高,骨表面的TRAP阳性破骨细胞更少。这些结果表明,TAZ可以促进破骨细胞的发生和骨吸收。
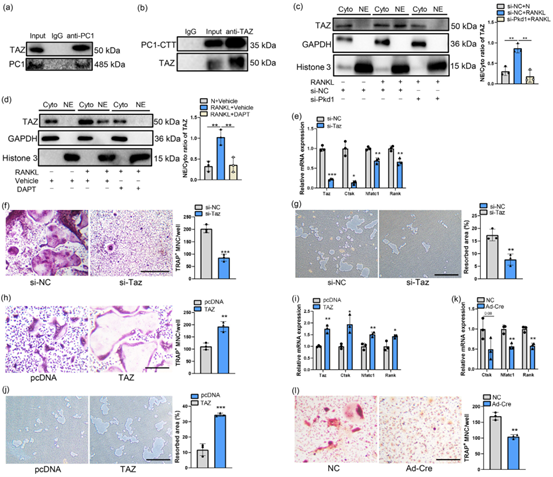
图4. PC1与TAZ相互作用并促进破骨细胞的分化
随后,作者深入探究了PC1-TAZ轴在激活破骨细胞相关基因转录中的作用机制。为了阐明作为转录共激活因子的TAZ如何调节破骨细胞相关基因的表达,作者用ChIP-seq技术对破骨细胞内的TAZ结合位点进行了全面分析,结果显示TAZ结合基因与多种生物学过程紧密相关,特别是髓样细胞分化、破骨细胞分化和骨吸收等。通过筛选,作者鉴定了63个受到PC1和TAZ共同调节的候选基因,其中12个与破骨细胞功能直接相关。ChIP-seq和ChIP-PCR实验证实,TAZ能够直接结合到Siglec15、Oscar和Acp5等基因的启动子区,这些基因参与破骨细胞的多核化和骨吸收过程,研究还发现TAZ能够结合到Pkd1的启动子,且TAZ的敲低导致Pkd1的mRNA表达水平下降。综上,这些结果揭示了一个正反馈调节机制:PC1促使TAZ进入细胞核并激活包括自身编码基因Pkd1在内的破骨细胞相关基因的转录,PC1-TAZ轴在促进破骨细胞形成和骨吸收过程中发挥着关键作用。
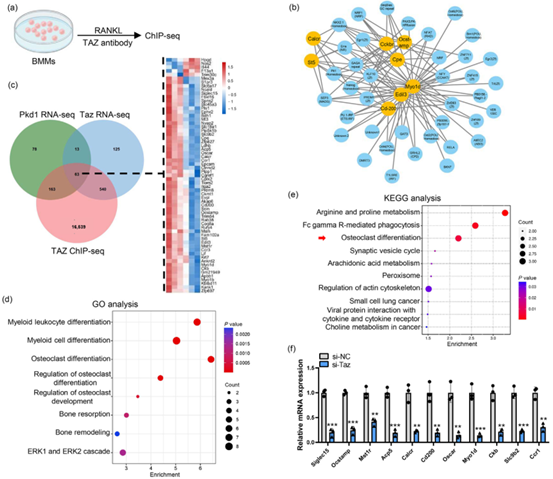
图5. PC1-TAZ轴激活破骨细胞相关基因转录
最后,作者探索了通过靶向PC1-TAZ轴来减轻因机械负荷减少或OVX导致的骨质流失的策略。基于先前的发现,小分子Zinc0144282可以抑制间充质干细胞中PC1/PC2/TAZ复合物的形成,作者将其应用于BMMs向破骨细胞分化的过程中,观察其对破骨细胞生成的影响。结果显示,Zinc01442821的处理能够抑制破骨细胞相关基因的表达和TAZ的核易位,表明它对破骨细胞的形成具有抑制作用,研究还通过动物模型验证了该小分子的治疗潜力。使用Zinc01442821干预能够减轻由机械负荷减少和雌激素缺乏引起的骨质损失。总而言之,Zinc01442821显示出治疗破骨细胞相关骨质疏松症的潜力。
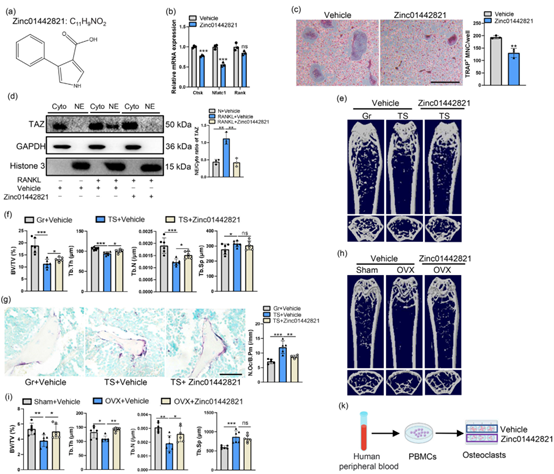
图6. Zinc01442821抑制破骨细胞生成,防止机械负荷减少和OVX诱导的骨质疏松症
综上所述,在本研究中,研究团队首次报道了应力传感蛋白PC1通过PC1-TAZ复合物直接调控破骨细胞的分化和功能。通过抑制PC1-TAZ轴可抑制骨吸收,减轻机械负荷减少或雌激素缺乏条件下的骨质流失,因此,PC1-TAZ轴可能是废用性骨质疏松症、绝经后骨质疏松症和其他类型骨吸收相关骨质流失的潜在治疗靶点,此研究成功为骨质疏松患者带来了新的治疗希望。

查看更多

查看更多

查看更多

联系我们

返回顶部