查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上期我们介绍了自噬干货分享系列之内质网自噬的研究策略,那么本期将继续进行“自噬干货分享”,本期内容主要从线粒体自噬分类、介导线粒体自噬的经典通路、线粒体自噬的诱导与抑制来进行介绍。

在ROS、营养缺乏、细胞衰老等外界刺激的作用下,细胞内的线粒体发生去极化出现损伤,损伤的线粒体被特异性包裹进自噬体中并与溶酶体融合,从而完成溶酶体的降解,这个过程称为线粒体自噬。线粒体自噬是细胞在应对氧化应激等压力条件下的生物学现象,用于清除多余的或者功能失调的线粒体,以维持线粒体数目和质量的平衡,对于整个线粒体网络的功能完整性和细胞生存来说十分关键。
1、基础线粒体自噬:细胞持续清理衰老和损伤的线粒体,确保线粒体能循环利用。线粒体自噬水平较高的器官包括:心脏、肝脏、肾脏、骨骼肌和神经系统等;
2、应激诱导型线粒体自噬:细胞外应激信号会影响线粒体的生理功能,并且会引起线粒体膜电位消耗,导致急性线粒体清除;
3、程序性线粒体自噬:程序性线粒体自噬会在不同细胞的发育过程中被激活,包括视网膜神经节细胞发育,体细胞向多能干细胞的化学重编程过程,心肌细胞的成熟,红细胞分化,受精后精子来源的线粒体清除等过程。
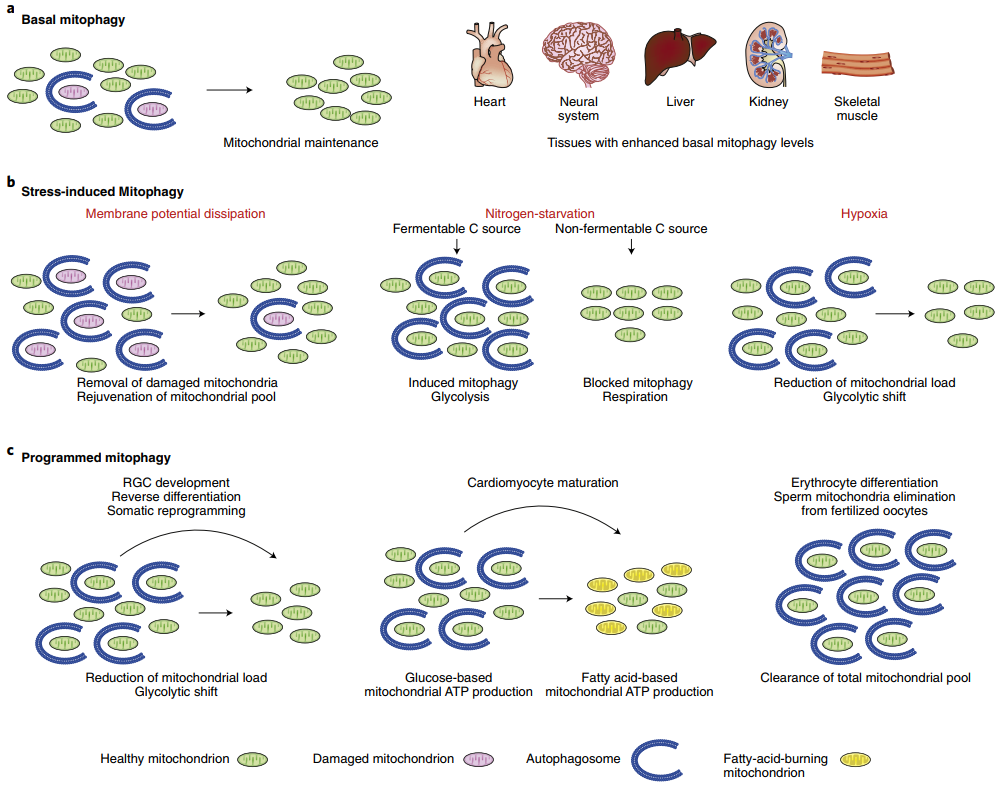
图1.线粒体自噬的分类[1]
1、 PINK1/Parkin信号通路。在健康的线粒体中,PTEN诱导激酶1(PINK1)通过线粒体靶向序列靶向线粒体,并通过TOM/TIM复合体进入到线粒体内膜,随后PINK1被线粒体内膜中的蛋白酶PARL切割,并最终被蛋白酶体降解。当线粒体受损时,线粒体膜电位下降,PINK1无法进入线粒体内膜并在线粒体外膜积累,激活并招募Parkin,Parkin介导线粒体底物泛素化,泛素化后,包括p62在内的受体蛋白在线粒体外膜积累,导致泛素化产物通过与LC3结合被招募到自噬体中,成熟的自噬体与溶酶体融合形成自噬溶酶体,包含的线粒体随后被降解。
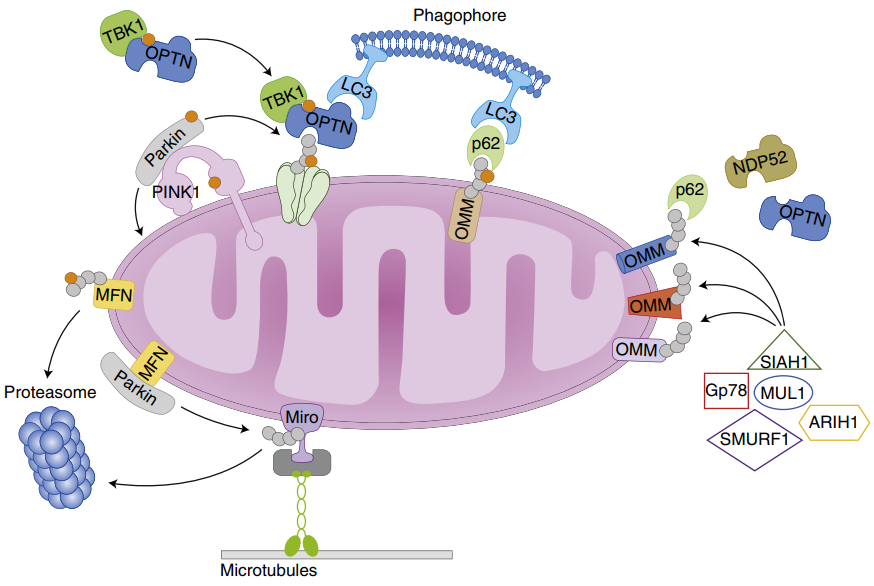
图2.PINK1-Parkin介导的线粒体自噬[1]
2、 BNIP3/NIX信号通路。BNIP3和NIX均位于线粒体的外膜,在缺血、缺氧的条件下,BNIP3 可通过以下2 种途径诱导细胞内线粒体自噬的发生:①BNIP3能通过其BH3结构域调控自噬的核心蛋白Beclin-1竞争性地与Bcl-2结合,进而诱导Beclin-1的大量释放,激活线粒体自噬的发生;②BNIP3的N端具有LIR序列,其可识别LC3,并与之直接结合,从而诱导线粒体自噬的发生。
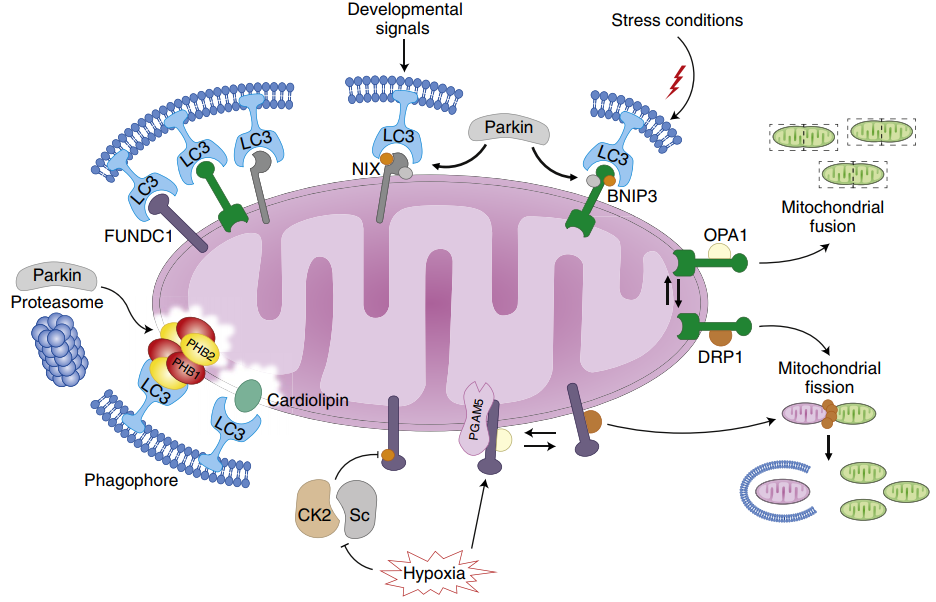
图3.受体介导的自噬[1]
3、FUNDC1信号通路。FUNDC1是调控线粒体自噬的关键受体。在正常条件下,FUNDC1被酪氨酸激酶磷酸化,此时与LC3的亲和力降低在缺血缺氧条件下酪氨酸激酶被灭活,FUNDC1与LC3的亲和力显著提升,并且FUNDC1可以被丝氨酸/苏氨酸蛋白磷酸酶通过去磷酸化的形式激活,进而诱导线粒体自噬的发生。
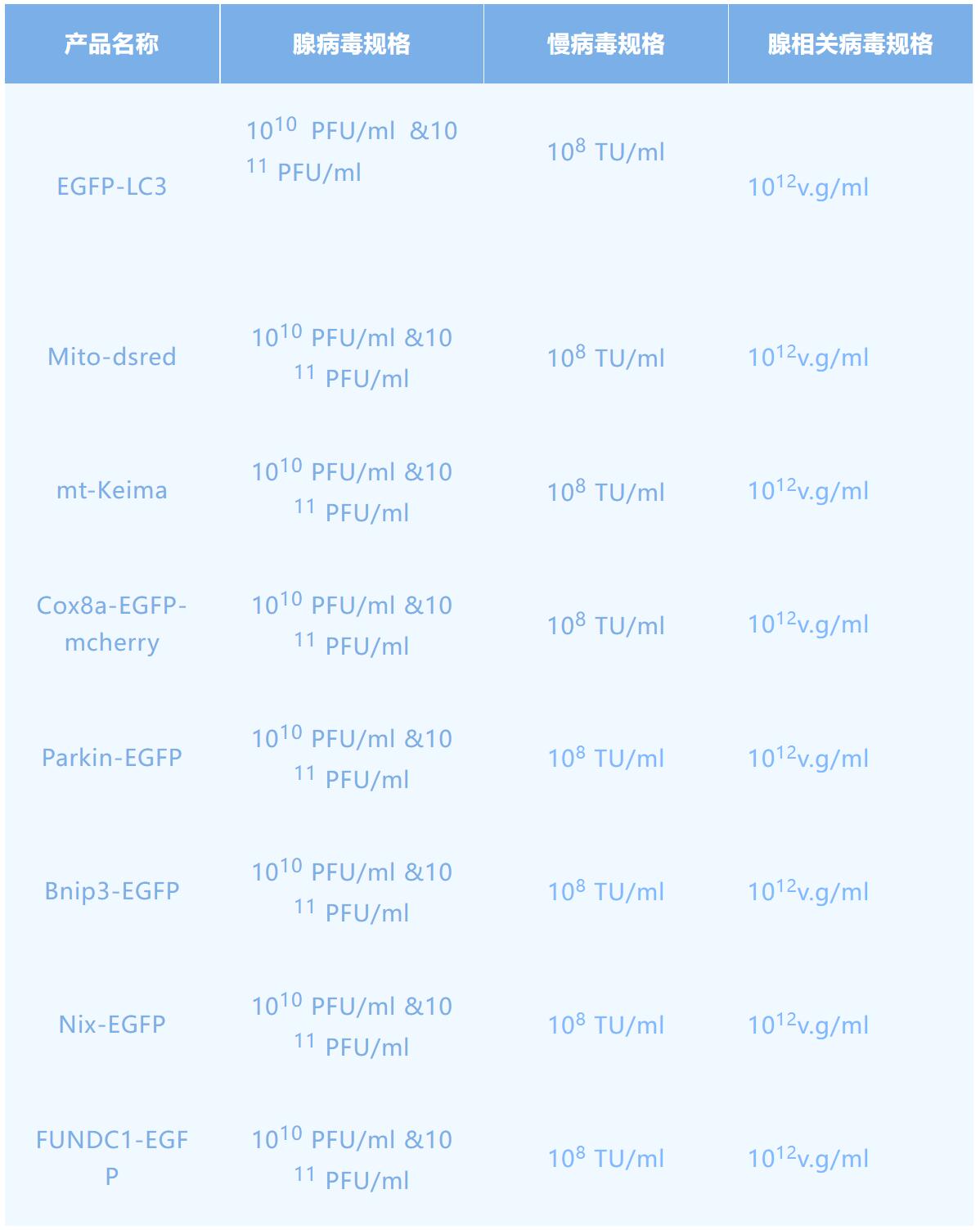
线粒体自噬受到了越来越广泛的关注,那么我们如何直观地研究线粒体自噬呢?汉恒生物提供的线粒体自噬病毒研究工具,便于感染目的细胞后直观地观察线粒体自噬的变化。EGFP-LC3单标记的荧光探针可以监测 LC3 蛋白参与自噬起始过程,Mito-dsred线粒体特异性定位荧光探针可定位线粒体,两者共转染细胞即可准确实时地追踪线粒体自噬的动态过程。另外,mt-Keima探针可独立应用于线粒体自噬的研究,Keima是一种H敏感的荧光蛋白,发射峰为620nm,在中性和酸性环境中分别于440nm和550nm处被激发,因此,随着时间的推移,递送到溶酶体的keima量可以通过在550nm处激发的信号强度和在440nm处激发的信号强度的比值来估计。鉴于发生自噬的线粒体最终会进入酸性的溶酶体中,所以将特异性定位于线粒体(mitochondrial)基质的靶向序列与keima融合形成mt-keima,可指示通过自噬途径进入溶酶体中的线粒体。另外,我们还有Cox8a基因融合绿光和红光(Cox8a-EGFP-mcherry)来研究线粒体自噬的病毒。
汉恒生物还有多种线粒体自噬通路单标研究工具Parkin-EGFP、Bnip3-EGFP、Nix-EGFP、FUNDC1-EGFP,与Mito-dsred线粒体共感染目的细胞,confocal检测共定位情况,可鉴别相关信号分子的线粒体转位。
本期“线粒体自噬研究”介绍就到此结束了,相信看到这里的小伙伴一定有所收获,对于线粒体自噬也更加了然于心。下期我们将介绍“分子伴侣介导的自噬”,我们下期再见!
参考文献:
[1] Palikaras, K., Lionaki, E. & Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nat Cell Biol 20, 1013–1022 (2018).
[2] 张迎梅,邱倩,漆永梅. 线粒体自噬的研究方法[J]. 兰州大学学报:自然科学版,2013,49(5):7
[3] Yoshii, S.R. and N. Mizushima. Monitoring and Measuring Autophagy. Int J Mol Sci.2017; 18(9): 1865.
[4] Levine, B. and G. Kroemer. Autophagy in the pathogenesis of disease. Cell. 2008 Jan 11;132(1):27-42.
[5] Choi, A. M., S. W. Ryter and B. Levine. Autophagy in human health and disease. N Engl J.2013 Feb 14;368(7):651-62.

查看更多

查看更多

查看更多

联系我们

返回顶部