查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期内容介绍了如何构建质粒,然而成功构建质粒只是踏出了基因表达调控的第一步,要成功调控基因表达,还需要将质粒高效的递送到细胞内。本期小编将向大家介绍如何将质粒转染进宿主细胞。

广义上讲,转染是利用病毒感染以外的方式人工将核酸(DNA或RNA)导入细胞的过程。经过转染后,导入的核酸游离在细胞核中,可转录表达而不进行复制,也有极小部分会整合到受体细胞的基因组中,随宿主基因组一同复制。
作为最常见的转染载体,质粒DNA含有重组基因和调控元件,可以转染到细胞中,用于基因表达调控,研究基因的功能、基因产物的突变分析和生化表征以及基因表达对细胞健康和生命周期的影响。对哺乳动物细胞转染来说,除了合适的载体,转染方法和转染试剂对转染的成功率也起到决定性作用。
一、转染方式
目前,常用的质粒转染方法可分为物理转染法和化学转染法。
1.物理转染
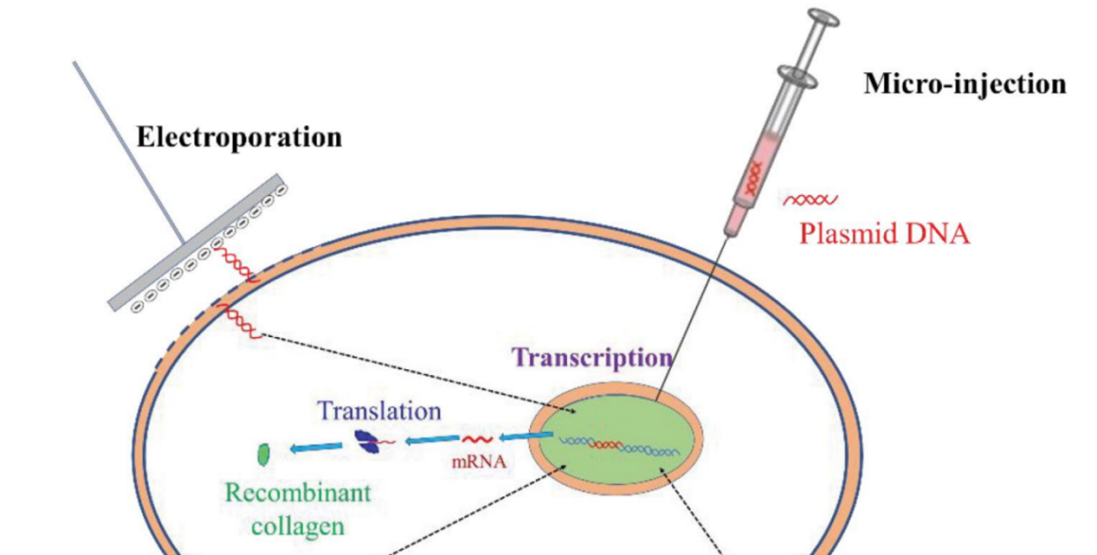
物理转染是一种高效的非病毒转染方法。包括电穿孔转染法、显微注射法等。
DOI: 10.1093/rb/rbad106
(1)电穿孔转染法
电穿孔转染法又叫电转,是利用电脉冲在细胞膜上形成临时微孔,使核酸等物质可以通过这些微孔进入细胞的方法, 这是一种将外源核酸高效导入多种类型的细胞(包括细菌和哺乳动物细胞)中的策略。转染时,将宿主细胞和质粒加入导电溶液中制成悬液,在混合物周围形成闭合电路,向细胞悬液释放电脉冲,高强度的电场作用可瞬时提高细胞膜的通透性,使细胞膜的磷脂双分子层形成临时微孔。同时,细胞膜上的电势升高,驱使带电荷的DNA以类似于电泳的方式经临时微孔穿过细胞膜进入细胞。
(2)显微注射法
显微注射法是利用管尖极细的玻璃微量注射针,将DNA直接注入到细胞中的方法。在注射的过程中,动物细胞膜也会被刺破,但因为动物细胞膜良好的弹性和流动性,在细胞膜被刺破之后,细胞膜可以恢复完整,恢复好的细胞可以继续存活,正常生长。
2.化学转染
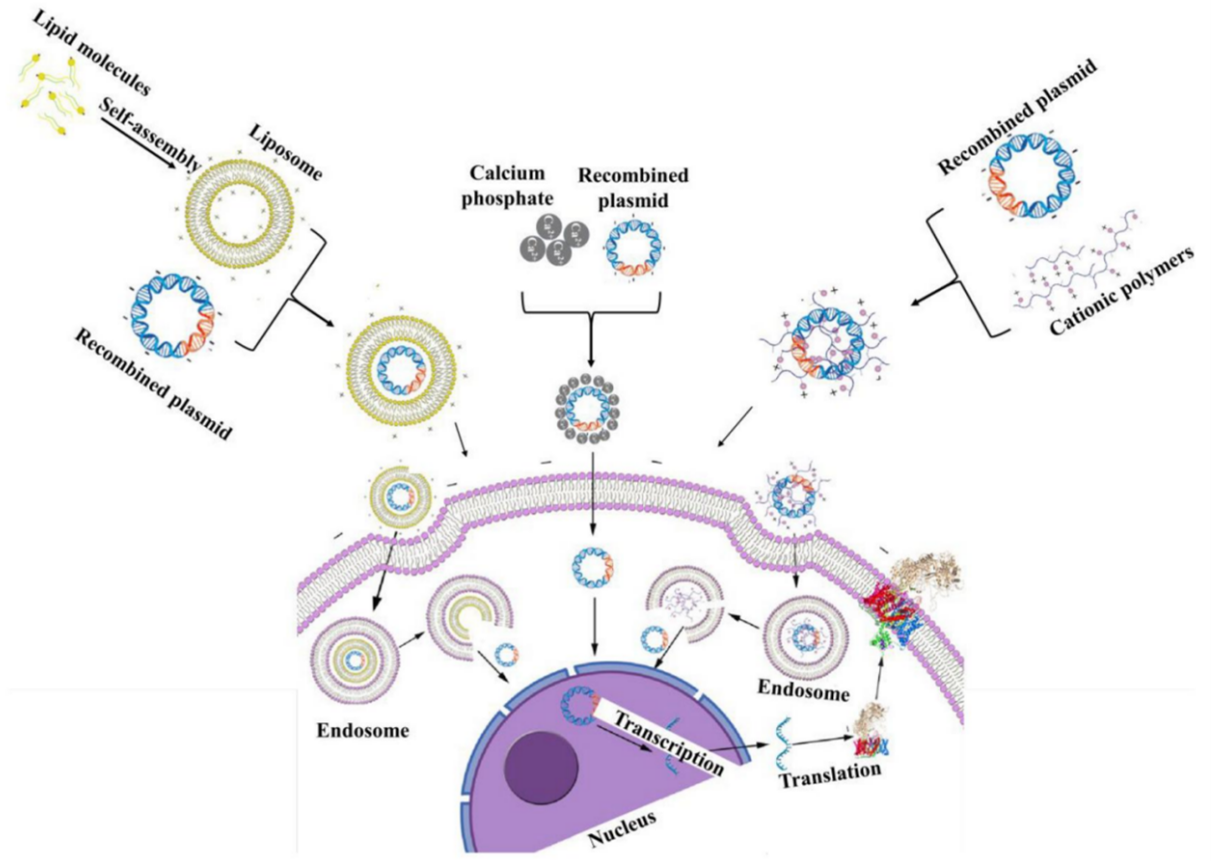
化学转染是通过一些化学物质,如PEI、脂质体等,改变细胞膜的物理和化学性质,使其对外源性DNA或RNA具有亲和力,从而实现基因转移。包括阳离子脂质体、阳离子聚合物、磷酸钙法等。
DOI: 10.1093/rb/rbad106
(1)阳离子脂质体转染法
该方法是通过带正电荷的阳离子脂质体依靠静电作用与DNA的磷酸根结合形成DNA-脂质体复合物,这些复合物可以被带负电的细胞膜吸附,随后通过融合或细胞内吞方式进入细胞。阳离子脂质体介导的转染是将外源性遗传物质导入细胞最普遍的方法之一。
(2)阳离子聚合物转染法
与阳离子脂质体转染法类似,带正电的阳离子聚合物与核酸的磷酸基团形成带正电的复合物,复合物和带负电的细胞膜接触,通过内吞作用进入细胞,也是应用非常广泛的一种转染方法。
(3)磷酸钙法
在磷酸钙法转染过程中,将DNA与CaCl2在pH=7.1的磷酸盐缓冲溶液中混合,通过静电引力作用使PO-与Ca2+形成磷酸钙,并与DNA共沉淀,细胞通过内吞作用吞噬这些DNA沉淀,从而使DNA进入细胞中实现转染目标。
3.常用转染方法的比较
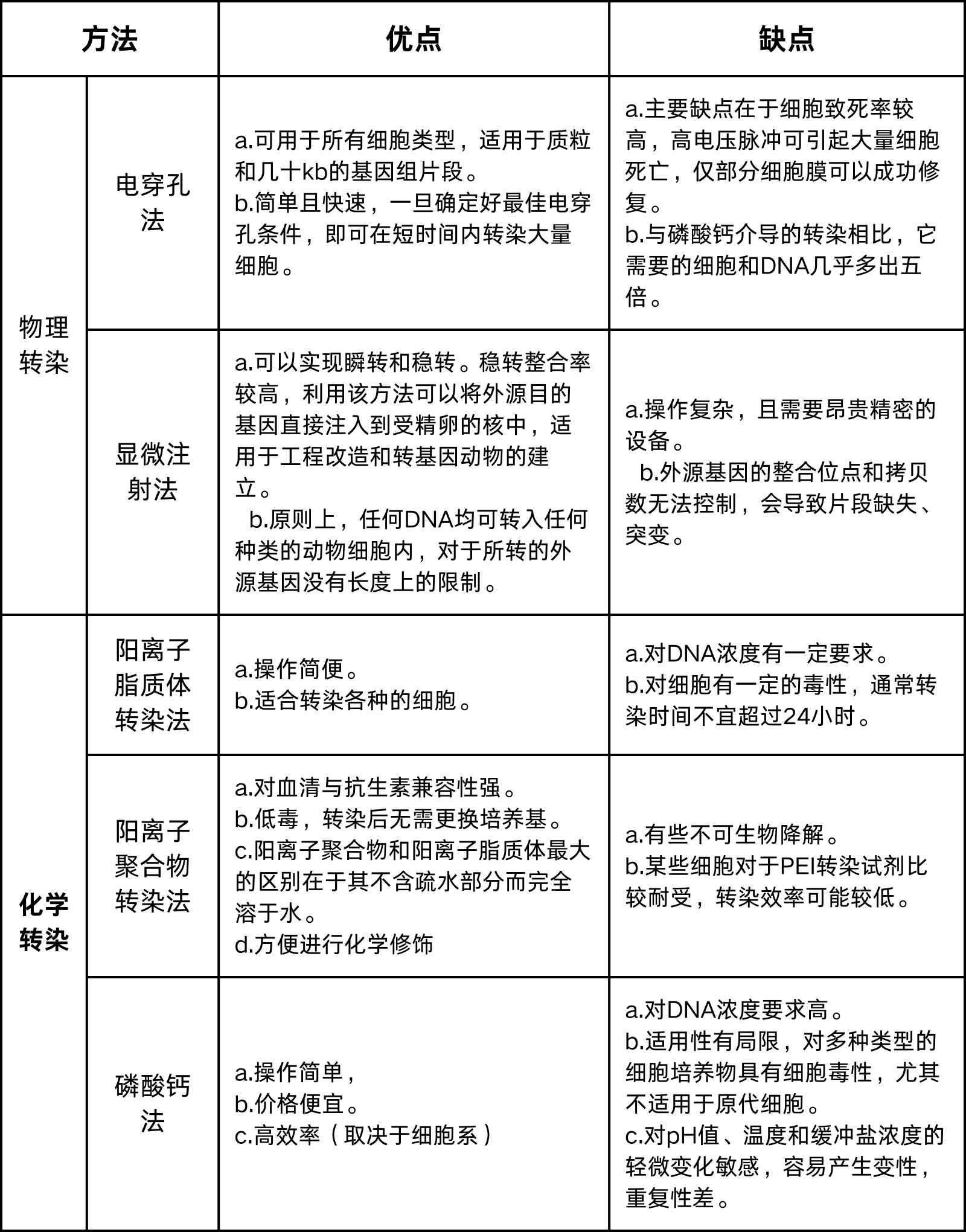
二、转染步骤
由于阳离子脂质体转染是实验室最常见、最便捷的转染方法之一,接下来以汉恒生物LipoFiterTM转染试剂为例介绍转染操作。
1.实验分组
无论选择何种转染方法,对照组的设置都至关重要,这能够验证试剂和质粒DNA的质量,也有助于区分特定实验处理的影响与非特异性变化,从而确保实验结果的准确性。通常建议设置以下对照组:
(1)空白对照组:正常培养的细胞,不做任何转染操作,用于观察细胞在无任何处理情况下的自然状态,能够检测实验中非目标因素(如溶剂或培养条件变化)对细胞的影响。
(2)载体对照:指转染空载体(不含目标基因的质粒)的细胞。主要用于评估载体本身的效应,以排除载体成分(如启动子、报告基因)对细胞的影响。
(3)阳性对照组:细胞转染易于检测的基因产物(如GFP)的质粒,可以直接反映转染效率及实验所用试剂的质量情况,还可以为转染全程非特异性毒性提供对照(带荧光标签的载体对照可以直接作为阳性对照)。
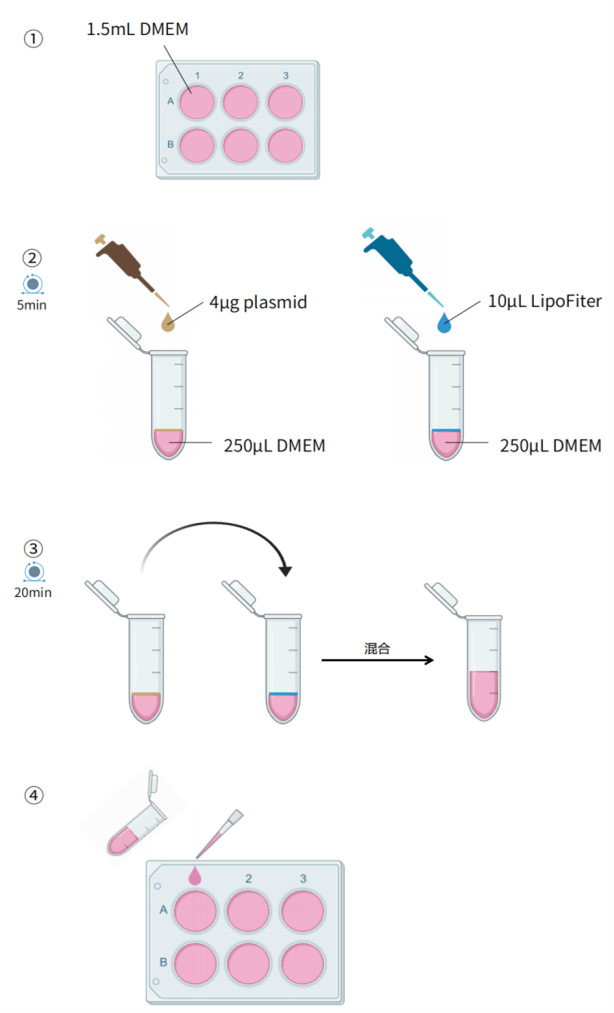
2.细胞转染
(1)细胞铺板,以6孔板转染293细胞为例,转染前一天接种0.4×106细胞,培养箱中培养,待细胞密度生长至50-80%时,准备转染。
注:转染前细胞的活力和总体健康状况是各转染之间产生变异性的重要来源。一般而言,转染前细胞应至少保持90%的活力,并在传代后有足够的时间恢复,建议使用传代少于30次的细胞。
(2)取一只洁净无菌离心管,将4ug质粒DNA加入到无血清培养基中,用枪轻轻吹打混匀。
注:血清蛋白会干扰DNA-脂质体复合物的形成,所以培养基中不应含有血清;使用高纯度的 DNA(A260/A280 比值越近 1.8 越好)有助于获得较高的转染效率。
(3)取另一只洁净无菌离心管,加入无血清培养基,再加入转染试剂4-10ul,用枪轻轻吹打混匀。
(4)将步骤(2)与(3)中的DNA溶液与转染试剂溶液混合,用枪轻轻吹打混匀。室温孵育20分钟。
注:LipoFiterTM不能 vortex 或离心,宜缓慢晃动混匀。
(5)用不含抗生素的培养基将细胞洗涤两次,在细胞中加入适量的无抗生素培养基。
注:阳离子脂质体试剂可增加细胞通透性,因此也可能增加递送到细胞内的抗生素量,从而导致细胞毒性以及较低的转染效率,在铺板细胞用于转染时,应避免使用抗生素。
(6)将步骤(4)混合得到的转染试剂-DNA复合物缓缓加入到细胞中,随后轻轻“8”字摇摆混匀。
注:针对贴壁细胞,如上述所说,只需将复合物加入细胞中,孵育6小时再换液即可。若是转染悬浮或半悬浮细胞,则推荐通过平角离心转染法,即将适量的复合物加入细胞培养皿后,封口膜封好,放入平角离心机,低速(200g)离心1.5小时,然后放入培养箱中正常培养6小时再换液。
(7)细胞培养箱内培养6-12小时后,去除含有转染试剂-DNA的培养基,加入新鲜含血清的细胞培养基继续培养。
(8)培养24-40小时后即可检测转染效果,如转染带GFP或者其他荧光基因的表达载体,可用荧光显微镜观测细胞转染效率;用于筛选稳定表达细胞株,则在转染后24小时加入适当的筛选药物,进行稳定表达细胞株的筛选。
汉恒LipoFiterTM阳离子脂质体转染试剂转染操作示意图
三、质粒转染常见问答
1.只有慢病毒感染才能构建稳转细胞株,质粒转染目的基因不会整合到染色体吗?
不管是慢病毒还是质粒,DNA都可以整合到宿主染色体。能够用来做瞬转的质粒转染方法,也可以用来做稳转细胞株构建。稳转所用的质粒含有抗性基因,后期通过一定时间的药物筛选,把没有转进目的基因的细胞杀死,保存下来的细胞都是成功转入目的基因,能够稳定遗传的细胞。
慢病毒自带整合酶系统,整合效率很高。而相比之下,质粒DNA以非常低的概率整合到宿主基因组中,每102~106个细胞中可能会有一个细胞的基因组被整合,整合效率取决于细胞类型,通常小于1%;且质粒转染方法对细胞损伤较大。所以有稳转株需求时更建议使用慢病毒。
2.如何选择合适的转染方法?
将核酸导入细胞的手段多种多样,包括各种生物、化学和物理方法。然而,并非任何方法都适用于所有类型的细胞和实验应用,不同的方法在转染效率、细胞毒性、对正常生理的影响、基因表达水平等方面均存在广泛的差异。应根据细胞类型和实验需求来选择理想的方法,且方法应具有高转染效率、低细胞毒性、对正常生理的影响尽可能小、易于使用和结果可重现。
3.影响转染效率的因素:
(1)细胞类型:每种类型的细胞对特定转染试剂或方法可能有不同的反应,只有选择了合适的细胞类型和正确的实验设计,才能将结果最大化。
(2)转染试剂:阳离子脂质体或阳离子聚合物转染法中,最重要的就是减少试剂的细胞毒性,不同细胞系使用不同转染试剂可能导致转染效率的不同,每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料可选择最适合实验设计的转染试剂,并且建议预实验摸索转染试剂与质粒的最佳使用比例。
(3)汇合度:转染的最佳细胞密度取决于具体的细胞类型、应用和转染技术,应为每个待转染的新细胞系确定相应的最佳密度。使用阳离子脂质体介导转染的情况下,转染时贴壁细胞一般达到70%-90%的汇合度,悬浮细胞达到5×105至2×106个细胞/mL的密度,即可获得良好的结果。
(4)培养基:不同的细胞或细胞类型都有非常特定的培养基、血清、补充剂要求,一些细胞系和原代细胞可能需要特殊的包被材料(如多聚赖氨酸、胶原蛋白、纤连蛋白等)以附着于培养板才能获得最佳的转染结果。
(5)质粒质量:质粒DNA纯度高,不含盐离子、内毒素和苯酚等代谢污染物时转染效果最好。污染物会杀死细胞;盐会干扰脂质络合,降低转染效率;内毒素,也称为脂多糖,它的存在会大大降低原代细胞和其他敏感细胞的转染效率。
(6)载体结构:质粒DNA是最常用的转染载体。质粒DNA载体的拓扑结构和大小会影响转染的效率,用超螺旋质粒DNA进行瞬时转染的效率最高;在稳定转染中,相对于超螺旋DNA,线性DNA会导致细胞的DNA摄取量较低,但DNA整合到宿主基因组中的效果更优。
4.通过多种转染方式均无法提高转染效率,应该怎么解决?
如果瞬转效率比较低,可以通过药物加压筛选,构建稳转细胞株,提高阳性率。
四、结语
本期干货介绍了实验室常见的几种质粒转染方法、阳离子脂质体转染的详细操作步骤以及转染的注意事项,希望对大家有所帮助。此外,汉恒生物可提供用于DNA、RNA递送的多种阳离子脂质体转染试剂,具有转染效率高、毒性低、适用于大多数细胞的优势。有试剂需求的老师可以咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。下期干货将继续为大家介绍如何用qpcr法检测转染后基因的表达变化,欢迎大家持续关注~
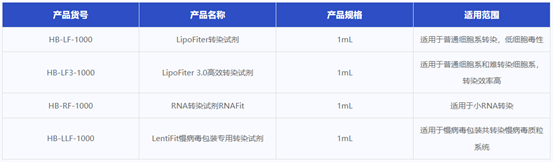
汉恒细胞转染试剂产品列表
五、参考文献
Guo X, Ma Y, Wang H, Yin H, Shi X, Chen Y, Gao G, Sun L, Wang J, Wang Y, Fan D. Status and developmental trends in recombinant collagen preparation technology. Regen Biomater. 2023 Nov 29;11:rbad106. doi: 10.1093/rb/rbad106. PMID: 38173768; PMCID: PMC10761200.

查看更多

查看更多

查看更多

联系我们

返回顶部