查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一期的AAV组织递送策略相关干货中,我们了解了泌尿系统的靶向方法,那么本期小恒将主要介绍AAV在人体最大的器官--皮肤组织中的靶向策略。

皮肤组织结构:
我们首先来了解一下位于人体最外层的皮肤组织(图1)。皮肤厚度为几毫米,可将底层的血液循环网络和感觉神经与外界环境隔离开,是抵御外部病原体、微生物亦或是物理和化学损伤的天然屏障。皮肤由三层组成:即表皮、真皮和皮下组织。表皮位于皮肤最外层,主要由角质形成细胞组成,根据其分化阶段与特点可将表皮分为五层:由外向内依次是角质层、透明层、颗粒层、棘层和基底层;表皮不含血管或淋巴管,需要通过真皮层的血管获得必需的营养和氧气。真皮是皮肤的第二层,由乳头层和网状层组成,厚度约为0.5 - 5mm,含有间充质干细胞,可分化为成纤维细胞并产生结缔组织。真皮主要由IV型胶原蛋白及成纤维细胞合成的弹性蛋白和网状结构组成,含有毛囊、汗腺和皮脂腺,并包含血管、感觉神经和淋巴管等,为无血管的表皮提供营养物质和氧气。表皮主要是对外界环境的屏障,真皮则是防止感染,充当储水库,并给予皮肤力量和灵活性。皮下组织(皮下脂肪组织)则是由胶原蛋白和脂肪小叶组成,与真皮层相似,包括血管、淋巴和神经,它的主要功能是将皮肤与骨骼和肌肉等器官分开,并可以隔热隔冷,储存能量。
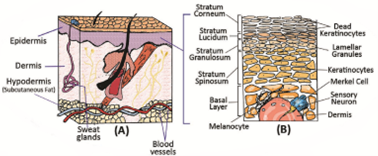
图1. 皮肤组织结构
皮肤组织相关疾病:
免疫系统减弱、受损,皮肤毛囊或毛孔中的外部物质,接触到的化学物质,如过敏原、刺激物或病毒感染等都可能引起皮肤疾病,如皮肤癌、牛皮癣(银屑病)、痤疮等(图2)。
皮肤癌是一种主要的皮肤疾病,分为三大类:黑色素瘤(恶性黑色素瘤)、基底细胞癌(BCC)和鳞状细胞癌(SCC)。黑色素瘤是一种由表皮黑色素细胞引起的恶性肿瘤,主要发生在黑色素细胞水平低的个体中。BCC和SCC通常表现为皮肤上出现凸起的斑块,但也可能在肿瘤部位形成溃疡。银屑病是由免疫功能障碍引发的自身免疫性皮肤病,是一种非常常见的疾病,主要存在于受损的表皮内,会产生红色粗糙的斑块,组织学特征主要是由于角质细胞过度增殖或异常分化而导致的表皮增厚。系统性红斑狼疮是另一种自身免疫性皮肤病,表现为结节状斑点或红色增厚斑块;其病变通常是光敏性的,常出现在身体暴露于阳光下的部位。痤疮是一种慢性炎症性疾病,主要是由身体高皮脂腺密度区域(如面部和胸部上部)皮脂腺皮脂分泌增加引起,皮脂分泌增加导致皮肤毛孔堵塞、角化异常和皮肤毛囊细菌定植等而导致痤疮的产生。
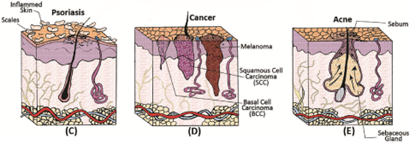
图2. 皮肤组织相关疾病
皮肤疾病多种多样且相关作用机制也有待于进一步研究以帮助我们更好的理解疾病成因亦或是开发相关治疗方法,利用有效的基因表达载体进行相关基因表达调控是目前非常有效的用于研究皮肤相关疾病的手段。那么,本文将主要介绍动物在体基因表达调控利器—AAV在皮肤组织研究应用中所涉及的AAV血清型选择、特异启动子应用及注射方法这三方面的相关问题。
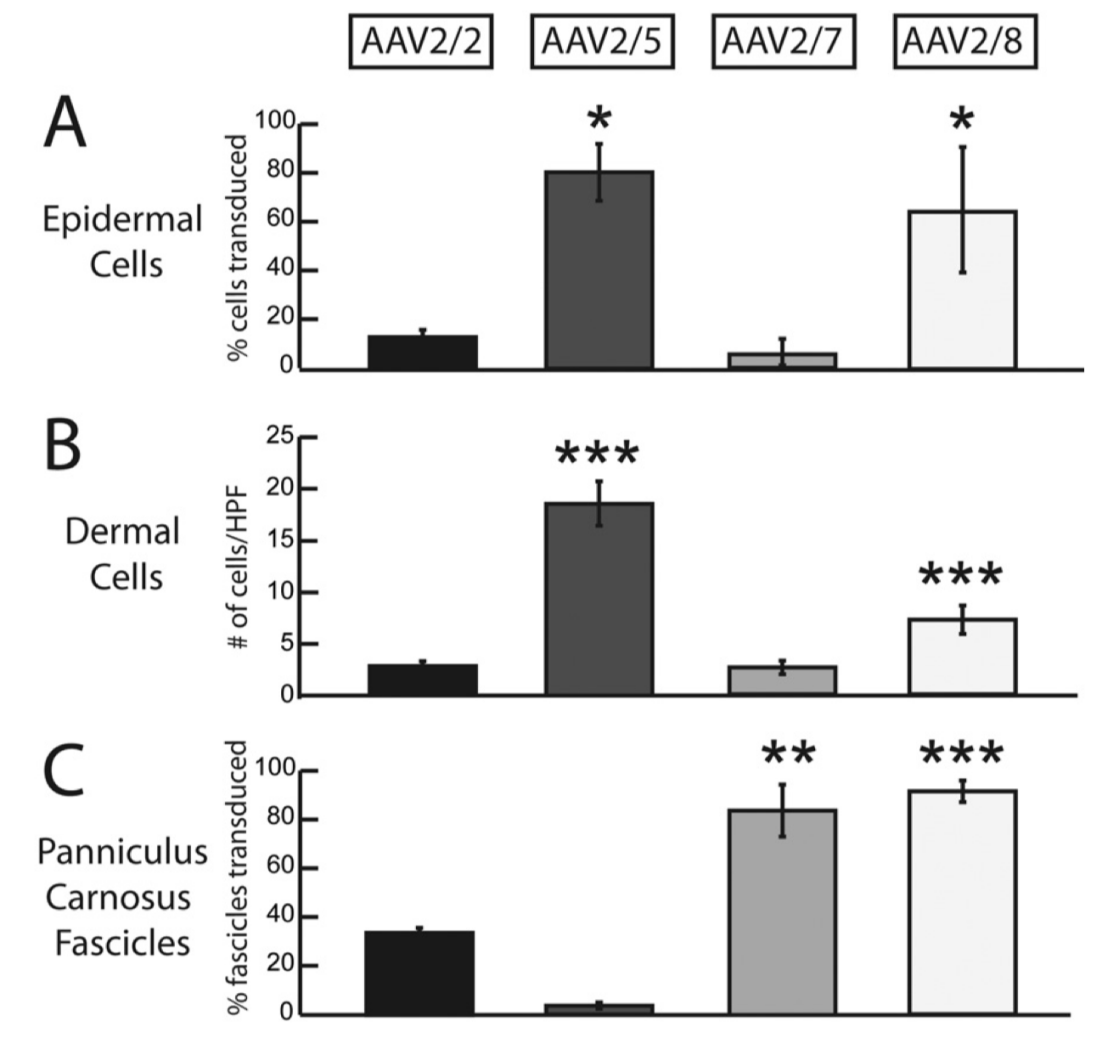
图3.不同血清型对于皮肤组织细胞的感染效率
索尔克生物研究所Izpisua Belmonte教授在2018年发表的《In vivo reprogramming of wound-resident cells generates skin epithelial tissue》文章中,为了利用AAV研究DGTM四因子(DNP63A、GRHL2、TFAP2A和MYC)在体内重编程能否诱导皮肤溃疡表面上皮组织新生,作者进行了皮下注射或直接将表达绿色荧光蛋白的AAV(GFP-AAV)注射于皮肤原位分离的溃疡来确定哪种AAV可以最高效感染。通过切片荧光效果观察(图4),发现AAVDJ可以实现皮肤组织或溃疡中组织细胞的高效感染。
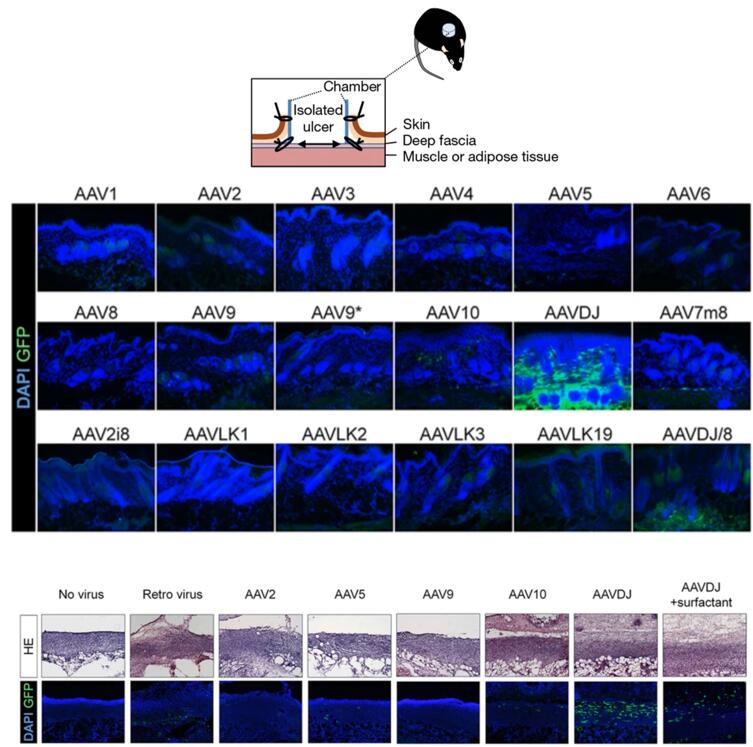
图4. 不同血清型对于皮肤组织和其表面溃疡的感染效率
二、特异性启动子
常规CMV、EF1等广谱启动子一般不具有细胞特异性,而针对皮肤组织特定细胞的靶向研究相对较少,目前仅有一些关于表皮角质形成细胞和黑色素细胞的特异表达相关研究。
角蛋白中间丝是上皮细胞的主要蛋白质成分,是一个由54个保守基因组成的大家族编码,K5/K14和K1/K10是表皮表达的4种主要角蛋白。K5/K14主要在表皮的基底角质形成细胞中表达,随着基底角质形成细胞的分化迁移到棘层出现了K1/K10的表达。2024年发表在Theranostics的中国医学科学院皮肤病研究所赵明课题组文章《Keratinocyte-to-macrophage communication exacerbate psoriasiform dermatitis via LRG1-enriched extracellular vesicles》中,作者利用汉恒生物包装的K14启动子启动的AAV9-K14-si-LRG1,实现了对皮肤表皮中LRG1的特异性敲低(图5)。最终研究发现高表达LRG1的细胞外囊泡EV以依赖于TGFβR1的方式使巨噬细胞极化。这种角化细胞与巨噬细胞之间的通讯作用促进了银屑病样皮炎。
注射参数:
病毒类型:HBAAV2/9-K14-mir30-m-LRG1
病毒滴度:1.8*10^12vg/mL
目标部位:小鼠背部皮肤
注射方法:皮内注射
注射剂量:注射面积2.5 cm x 2.5 cm,呈网格状注射,共注射5个点,每点50ul(注射器见图5),每点间隔0.5cm,注射深度1-2mm
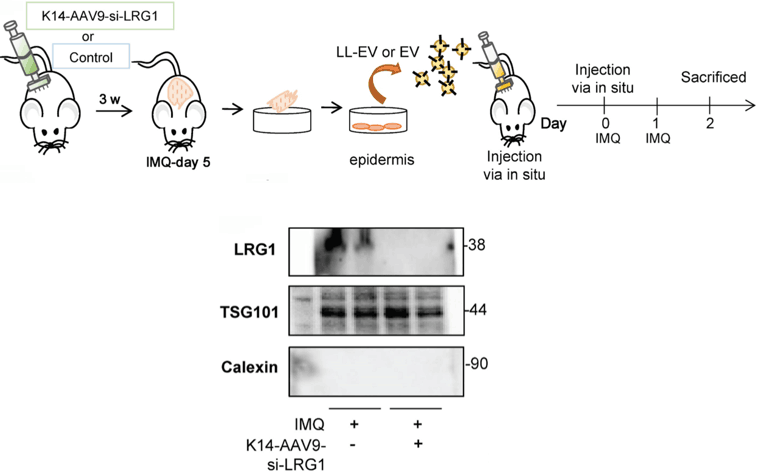
图5.K14启动子对于皮肤表皮的特异性基因表达调控
针对皮肤黑色素细胞特异性表达,2016年发表在International Journal of Molecular Sciences的题为《Dermal Delivery of Constructs Encoding Cre Recombinase to Induce Skin Tumors in PtenLoxP/LoxP;BrafCA/+ Mice》的文章中,作者利用黑色素细胞特异mTyr(小鼠酪氨酸酶基因)启动子启动表达的载体在PtenLoxP/LoxP,BrafCA/+小鼠真皮中递送表达Cre重组酶,实现了cre在黑色素细胞的特异表达并成功诱导了黑色素瘤(图6)。
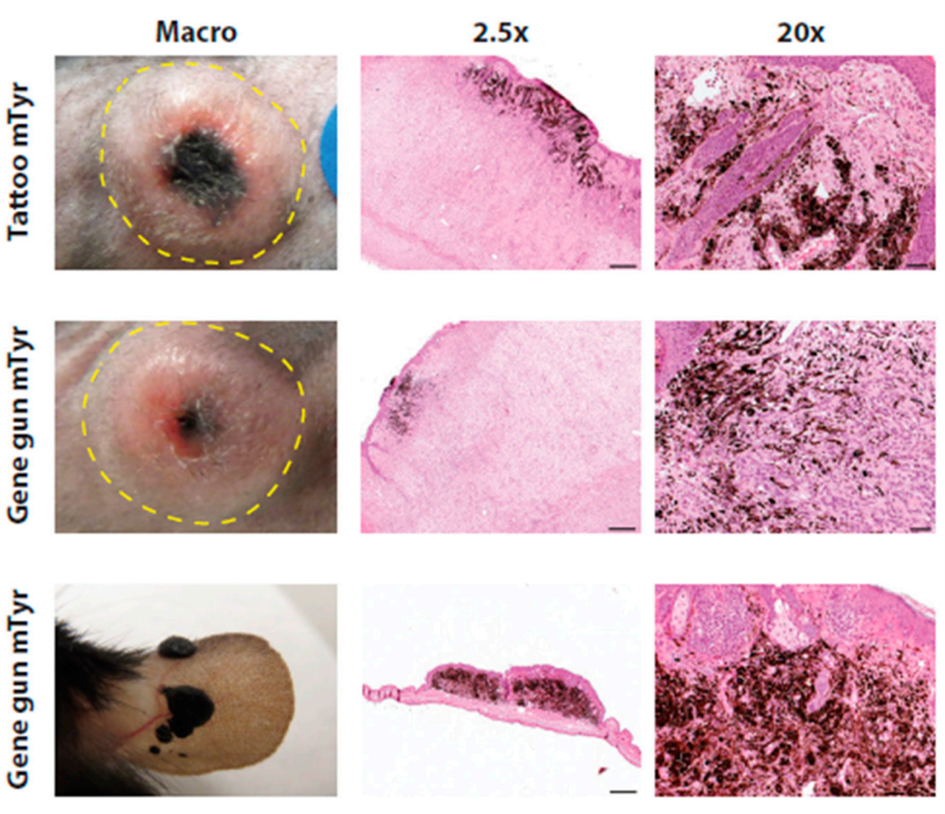
图6.黑色素细胞mTyr启动子启动表达的cre在PtenLoxP/LoxP/BrafCA/+小鼠中的成瘤作用
三、注射方法
皮肤注射方法一般可以采取皮内(表皮与真皮之间)或皮下(皮下组织)原位多点注射的方法。2002年B Deodato等在进行大鼠皮肤伤口愈合相关研究中,对直径8mm的背部皮肤创面进行AAV皮内注射,每点间隔3-4mm,注射5-7个点,每点20ul,共注射约10^11vp的病毒颗粒, 并对组织切片进行了LacZ和目的基因VEGF165的表达检测(图7)。
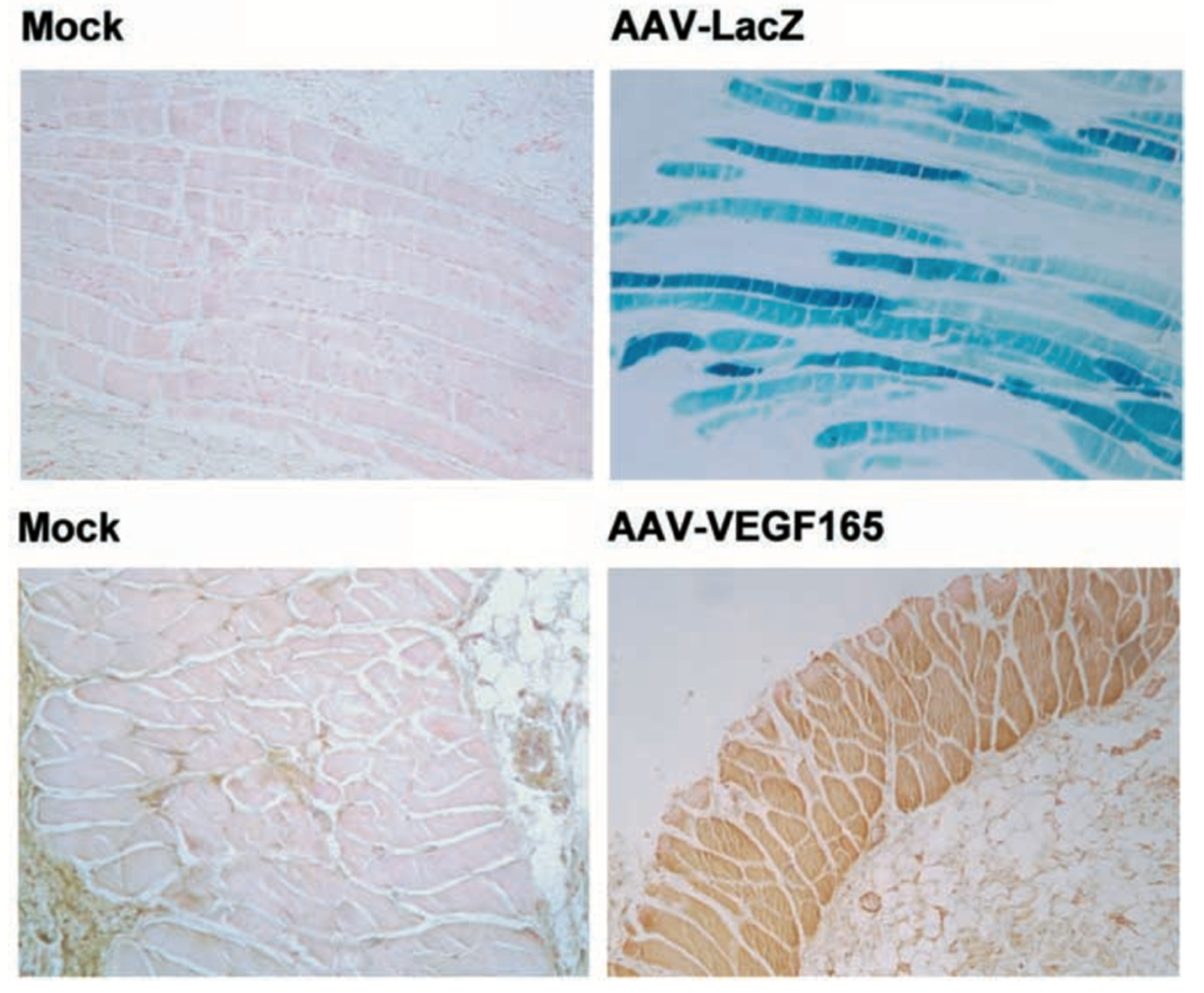
图7. AAV-LacZ/VEGF165在大鼠皮肤中的表达
2019年重庆医科大学一附院陈爱军课题组在对uvb诱导大鼠皮肤光老化影响的研究中利用汉恒生物包装的HSP27基因干扰AAV对大鼠背部皮肤进行皮内注射(图8)。文章结果表明,HSP27参与了uv照射后皮肤组织的氧化应激、衰老和凋亡等过程,为干预uv诱导的皮肤损伤提供了潜在的方法。
注射参数:
病毒类型:HBAAV2/9-r-HSP27 shRNA-GFP
病毒滴度:>1*10^12vg/mL
目标部位:大鼠背部皮肤
注射方法:皮内注射
注射剂量:呈网格状注射,共注射5个点,每点20ul,每点间隔1cm,注射深度1-2mm
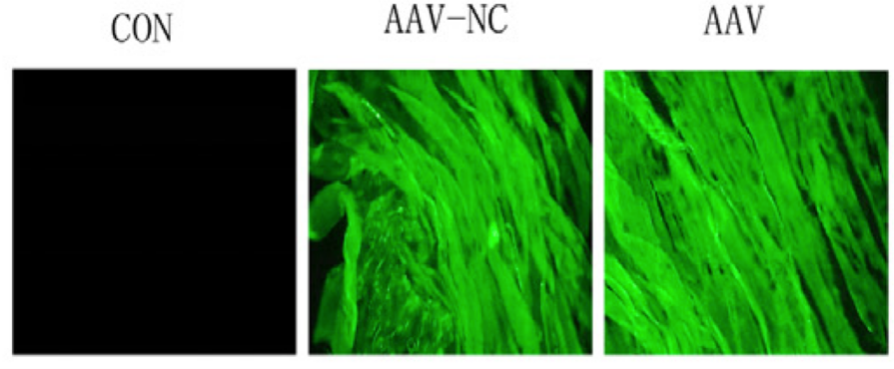
图8.大鼠背部皮肤AAV注射感染后荧光表达效果图
2024年上海交通大学医学院吕良敬课题组在对系统性硬化症的研究中利用了汉恒生物包装的IFNA2过表达AAV对小鼠进行皮肤注射(图9)。文章发现皮肤中内皮细胞的I型干扰素应答参与了血管病变和纤维化,并可预测系统性硬化症的疾病进展。
注射参数:
病毒类型:HBAAV2/9-m-IFNA2-3xflag
病毒滴度:2.7*10^12vg/mL
目标部位:小鼠背部皮肤
注射方法:皮下注射
注射剂量:注射面积1cm x 1cm,共注射1.0*10^11 vg病毒量
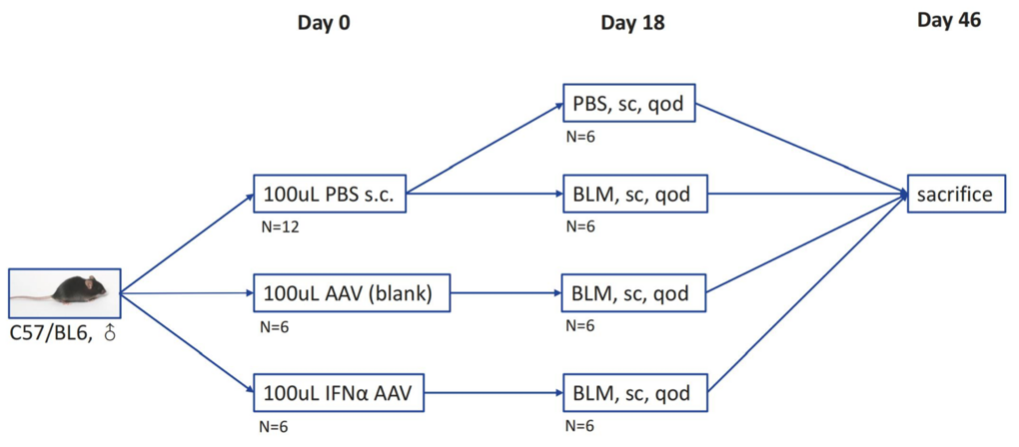
图9.小鼠背部皮肤AAV注射
表1.汉恒生物皮肤组织AAV血清型/启动子及皮肤注射方法推荐

通过以上相关介绍,大家应该对皮肤组织AAV载体应用有了相关了解,也希望可以给大家提供一定的帮助。此外,汉恒生物拥有多种不同组织/细胞特异血清型或启动子的AAV,全面助力科学研究;除了本次的干货内容外,也有不同组织特异靶向策略的相关干货文章已推送(详见汉恒生物公众号);在之后的干货分享中,将继续分享外周神经的靶向策略,欢迎大家多多关注~
参考文献:
1.Mohammadi MH, Heidary Araghi B, Beydaghi V, et al. Skin Diseases Modeling using Combined Tissue Engineering and Microfluidic Technologies. Adv Healthc Mater. 2016;5(19):2459-2480. doi:10.1002/adhm.201600439
2.Keswani SG, Balaji S, Le L, et al. Pseudotyped adeno-associated viral vector tropism and transduction efficiencies in murine wound healing. Wound Repair Regen. 2012;20(4):592-600. doi:10.1111/j.1524-475X.2012.00810.x
3.Kurita M, Araoka T, Hishida T, et al. In vivo reprogramming of wound-resident cells generates skin epithelial tissue. Nature. 2018;561(7722):243-247. doi:10.1038/s41586-018-0477-4
4. Guo Y, Redmond CJ, Leacock KA, et al. Keratin 14-dependent disulfides regulate epidermal homeostasis and barrier function via 14-3-3σ and YAP1. Elife. 2020;9:e53165. Published 2020 May 5. doi:10.7554/eLife.53165
5. Jiang W, Zhang T, Qiu Y, et al. Keratinocyte-to-macrophage communication exacerbate psoriasiform dermatitis via LRG1-enriched extracellular vesicles. Theranostics. 2024;14(3):1049-1064. Published 2024 Jan 1. doi:10.7150/thno.89180
6. Deken MA, Song JY, Gadiot J, et al. Dermal Delivery of Constructs Encoding Cre Recombinase to Induce Skin Tumors in PtenLoxP/LoxP;BrafCA/+ Mice. Int J Mol Sci. 2016;17(12):2149. Published 2016 Dec 20. doi:10.3390/ijms17122149
7. Deodato B, Arsic N, Zentilin L, et al. Recombinant AAV vector encoding human VEGF165 enhances wound healing. Gene Ther. 2002;9(12):777-785. doi:10.1038/sj.gt.3301697
8. Liu Y, Huang X, Wang P, et al. The effects of HSP27 against UVB-induced photoaging in rat skin. Biochem Biophys Res Commun. 2019;512(3):435-440. doi:10.1016/j.bbrc.2019.03.076
9. Yin H, Distler O, Shen L, et al. Endothelial Response to Type I Interferon Contributes to Vasculopathy and Fibrosis and Predicts Disease Progression of Systemic Sclerosis. Arthritis Rheumatol. 2024;76(1):78-91. doi:10.1002/art.42662

查看更多

查看更多

查看更多

联系我们

返回顶部