查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

子宫是包括人类在内的大多数雌性哺乳动物生殖系统中的一个重用器官,是胚胎和胎儿发育的场所,不同动物的子宫形态有所差异。
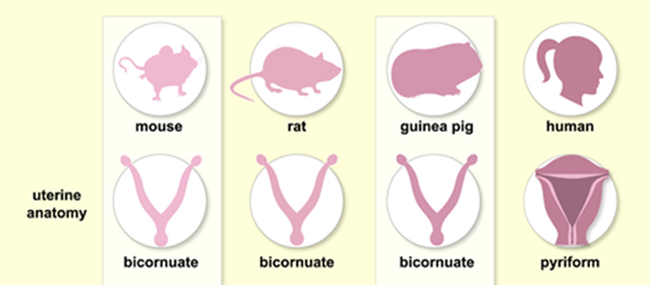
图1. 不同物种子宫类型
人类女性的子宫呈倒置梨形,位于骨盆区域,前方紧靠膀胱,后临直肠,上端宽而圆凸,称为子宫底,子宫底两侧为子宫角,与输卵管相连接,子宫底往下的中间部分为子宫体。成年子宫重约50g,长约为7~8cm,宽约4~5cm,厚2~3cm,子宫腔容量约为5ml。当卵巢排卵之后,输卵管的伞端就会把卵子输送到输卵管当中,这时精子和卵子就在一刹那结合形成受精卵。受精卵又在输卵管的蠕动下,最后进入子宫腔,然后找合适的位置着床。
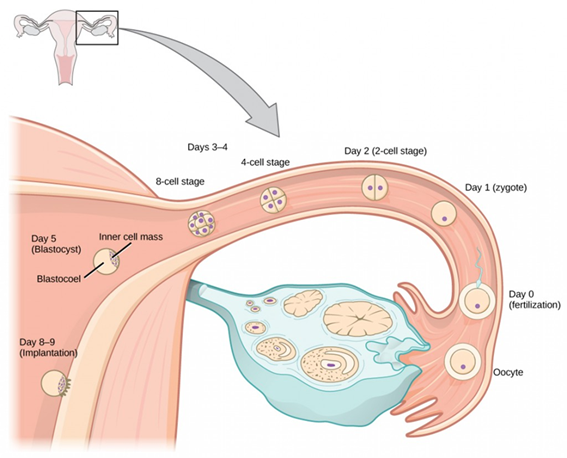
图2. 人类胚胎在子宫壁着床发育示意图
子宫为肌性器官,腔窄壁厚,分底部、体部、颈部三部分。体部和底部的子宫壁由外向内分为外膜、肌层和内膜(又称粘膜)。外膜是脏层腹膜的浆液层,覆盖子宫的外表面。子宫肌层主要由平滑肌组成,其最内层称为交界区。子宫内膜是哺乳动物子宫的内上皮层及其粘膜,有基底层和功能层。子宫是新生儿发育的重要场所,子宫健康对生产健康儿童至关重要,常见的子宫疾病有子宫颈癌、子宫腺肌病、子宫内膜癌等。
胚胎从受精卵到成熟的胎儿的不同发育阶段的过程中其细胞组成具有不同的特点:受精卵由精子与卵子融合而成,是单个细胞。受精卵通过有丝分裂形成一个由数十至数百个细胞组成的实心细胞团,此为桑椹胚阶段。桑椹胚继续发育,内部细胞聚集形成内细胞团,外部细胞形成滋养层细胞,形成囊胚。在囊胚阶段,内细胞团是胚胎干细胞的来源,将分化为所有胚胎组织和胎儿的各个器官系统,包括外胚层、中胚层和内胚层。随着胚胎的进一步发育,内胚层细胞形成原始消化道(原肠),围绕原肠周围的细胞逐渐形成胚盘,并在此基础上进一步分化和器官发生。胚胎发育过程中并不是一帆风顺的,可能会发生各种各样的疾病,比如,卵裂异常、囊胚形成困难等早期胚胎发育问题,以及唐氏综合症(21三体综合症)、囊性纤维化及白化病遗传学疾病等。
由此可见,健康的子宫环境,以及顺利的胚胎发育是健康儿童出生的关键。在这个过程中可能会需要对出现的疾病等问题进行治疗和干预,因此选择适合子宫及胚胎的基因治疗工具进行特异性的靶向调控是十分关键的。
本期小恒将从血清型选择、启动子及注射方式的角度,以几个案例详细分析一下如何利用AAV实现子宫及胚胎内基因高效特异性表达。
一、血清型选择
目前已发现AAV有12种血清型、100多种变体,其区别主要在于Cap基因(编码衣壳蛋白)的不同。不同的血清型对组织或器官有着不同的亲和性,从而导致对不同的组织和细胞感染效率不同。
通过对AAV2 RC质粒进行改造,获得不同血清型的RC质粒。在包装病毒时,将RC质粒、腺病毒辅助质粒以及含有目的基因的AAV表达质粒一起转染293细胞,获得不同血清型的重组AAV病毒颗粒(rAAV),如图所示。
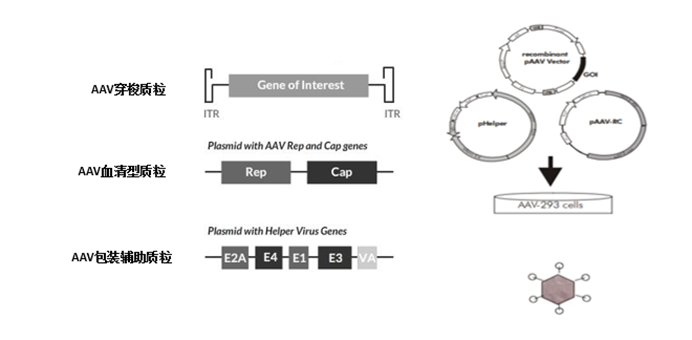
图3. AAV病毒载体的包装示意图
2022年发表在《Int. J. Mol. Sci》杂志上的文章“Direct Injection of Recombinant AAV-Containing Solution into the Oviductal Lumen of Pregnant Mice Caused In Situ Infection of Both Preimplantation Embryos and Oviductal Epithelium”中,作者将不同血清型的重组AAV载体(即AAV1、2、5和6,各载体中由巨细胞病毒增强子和鸡β-肌动蛋白启动子CAG调控增强型绿色荧光蛋白基因EGFP表达)在怀孕第0.7天时(对应于晚期1细胞阶段)注射到怀孕雌性小鼠输卵管的壶腹区域,并在桑椹胚中评估绿色荧光的表达情况。结果发现使,用AAV6-CAG-EGFP感染后,在输卵管上皮细胞中观察到的荧光较其他血清型更明显。这些结果表明,输卵管内注射AAV6载体是原位转导透明带封闭的植入前胚胎的最有效方法,AAV6载体可能是早期胚胎以及输卵管上皮细胞遗传操作的有用工具。
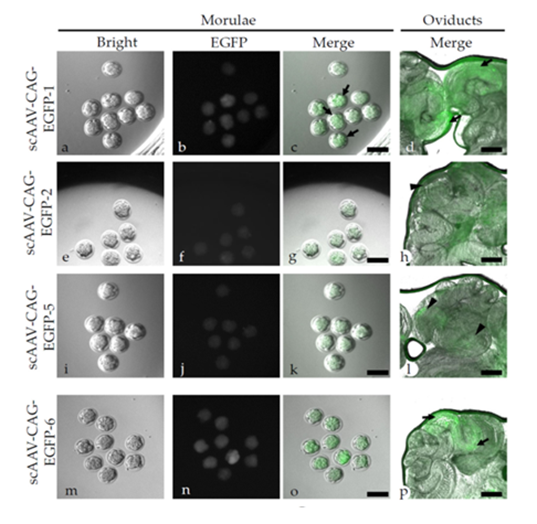
图4. AAV1、2、5 和 6 不同血清型对小鼠胚胎和输卵管的靶向性
而发表在《Cell reports》杂志上面的一篇文章“CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection”中,作者为了研究 AAV 载体能否穿透透明带并将病毒基因组传递到小鼠受精卵,使用了8种AAV 血清型分别感染 C57BL/6J 小鼠受精卵,结果在AAV1 和 AAV6组中观察到了明显的荧光,这两种血清型在 4 至 8 细胞阶段产生了明显的荧光信号,表明了AAV1 和 AAV6这两种血清型在小鼠受精卵中可以穿越透明带,并高效的将基因转导到小鼠胚胎,是高效转导小鼠受精卵的最佳血清型。
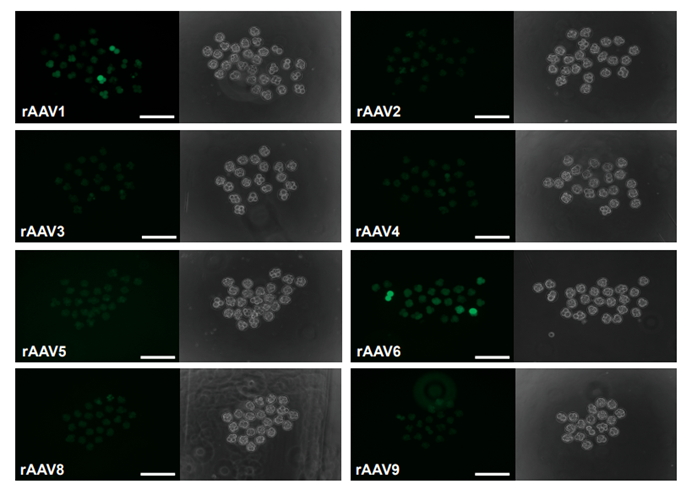
图5. 八种不同AAV 血清型对小鼠受精卵的转导效率
此外,发表在《Biochemical and Biophysical Research Communications》杂志上面的一篇文章“AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs”中,为了研究不同血清型AAV载体的基因传递, 作者使用AAV1、2、5、8、9 和 DJ载体分别与小鼠受精卵孵育,发现AAV1和AAV-DJ血清型组在感染后第 3 天开始可以观察到荧光,并一直持续到囊胚期,表明除AAV1和AAV6,AAV-DJ血清型也可穿越透明带,高效靶向小鼠受精卵。
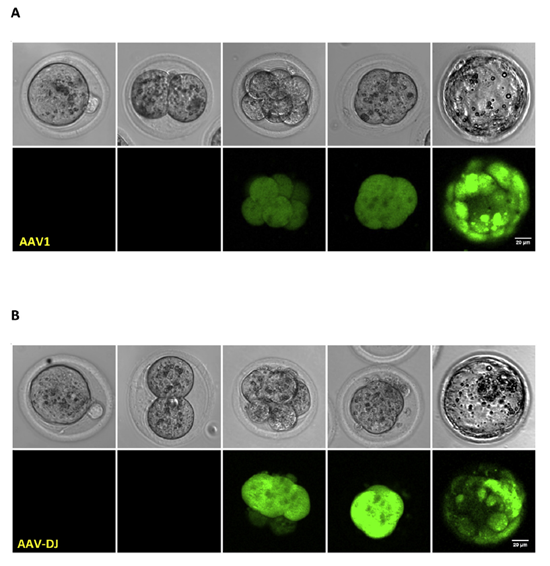
图6. AAV1和AAV-DJ血清型可高效靶向小鼠受精卵
二、启动子及注射方式
特异性血清型AAV可以实现组织或细胞特异性感染,除此之外,特异性启动子也可以实现基因在特定组织或细胞中高效特异性表达。然而,在生殖系统比如子宫胚胎的研究中还没有特别好的特异性启动子可供我们使用。因此,想要实现基因在子宫及胚胎中特异性高效表达的话,我们可以使用原位注射的方式结合强启动子比如CMV启动子、CAG启动子等来实现局部特异性高效表达外源基因的目的。除了前文所述可以通过将病毒注射到输卵管中对早期胚胎进行感染,还可以通过其他原位注射方式来感染子宫或胚胎组织,下面分享两个案例供大家参考。
发表在《Molecular Therapy》杂志上的“Fetal Gene Therapy Using a Single Injection of Recombinant AAV9 Rescued SMA Phenotype in Mice“一文中,作者对怀孕小鼠子宫切口手术后,通过IP(intraplacental,胎盘内注射),i.c.v.(intracerebroventricular,脑室注射)两种注射方式对发育期E15的胚胎小鼠注射rAAV9-EGFP病毒(强启动子CMV启动EGFP表达),来研究对中枢神经系统的转导效率。
在小鼠出生P1和P14天使用体内成像系统 (in vivo imaging system,IVIS)监测新生鼠体内AAV载体转导情况,观察到i.c.v.组在P1 时大脑中检测到最大的荧光表达,而在P14时脊髓中也显示出高水平荧光表达。IP和i.c.v.组中几乎所有幼崽的肩胛间区域的荧光信号均随时间增加,与i.c.v.组相比,IP组的小鼠的肝脏和腹股沟区域显示出更高的荧光信号强度。在P30时,对小鼠脊髓和脑切片的荧光显微镜分析显示,i.c.v.和 IP 组均存在广泛的荧光 表达,但是i.c.v.组小鼠大脑皮层、齿状回(DG)和脉络丛(CP)区域观察到了强大的转导效果。结果表明,通过IP、i.c.v.注射可以实现对胚胎组织的高效感染,该研究成果也为胎儿基因治疗提供了基础。
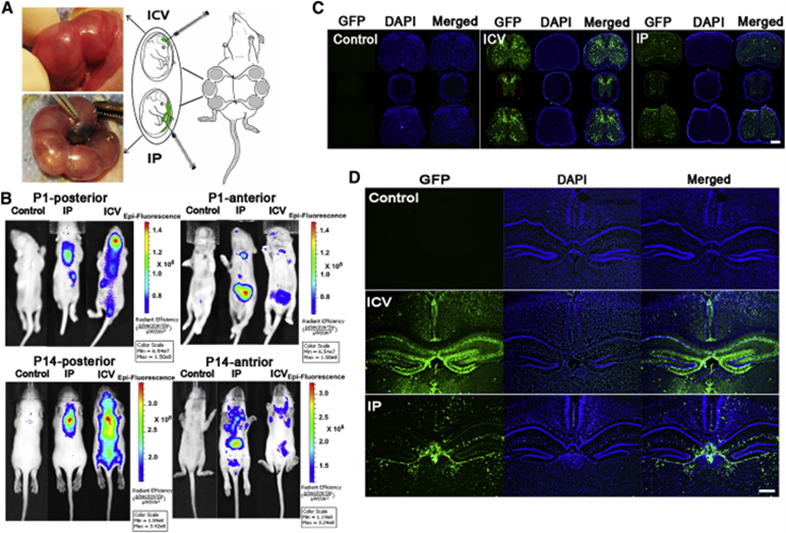
图7. IP,i.c.v.注射E15的胚胎小鼠
图8是汉恒生物客户发表在《eLife》杂志上面题为“circPTPN12/miR-21–5 p/ΔNp63a pathway contributes to human endometrial fibrosis”的文章,文中作者为了探究circ-PTPN12在子宫内膜纤维化发病过程中的作用,将同时过表达circ-PTPN12和EGFP的AAV9经子宫内注射的方式注射到小鼠体内。AAV子宫内注射后第四个发情周期,观察到子宫内膜上有明显绿色荧光,表明AAV9经子宫内注射可以实现对子宫内膜的感染。经检测发现,相对于对照组,circ-PTPN12过表达组子宫内膜中circ-PTPN12上调,与之相互作用的mir-21-5p下调,上皮标志物下调,间质标志物上调,最终揭示了circPTPN12基因在子宫内膜纤维化发病机制中的作用。
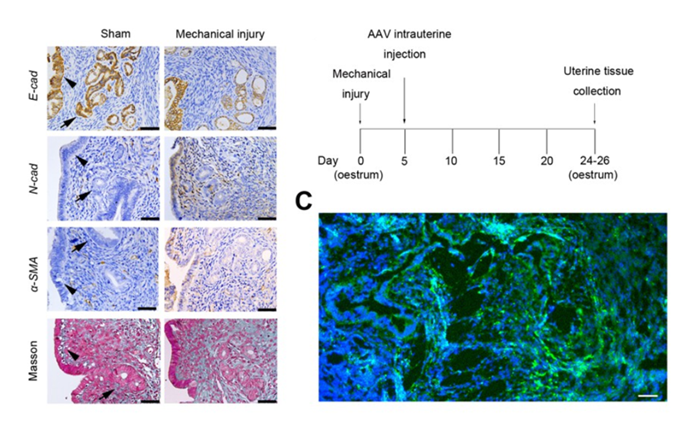
图8. AAV-circPTPN12感染小鼠子宫内膜
本期干货内容主要为大家介绍了使用AAV感染子宫及胚胎时血清型的选择、病毒注射方法和案例,希望对正在做这方面实验的小伙伴有所帮助。
参考文献:
[1]. Malik M, Roh M, England S K. Uterine contractions in rodent models and humans[J]. Acta physiologica, 2021, 231(4): e13607.
[2]. Habiba M, Heyn R, Bianchi P, et al. The development of the human uterus: morphogenesis to menarche[J]. Human reproduction update, 2021, 27(1): 1-26.
[3]. Sato M, Sato-Yamamoto N, Wakita A, et al. Direct injection of recombinant AAV-containing solution into the oviductal lumen of pregnant mice caused in situ infection of both preimplantation embryos and oviductal epithelium[J]. International Journal of Molecular Sciences, 2022, 23(9): 4897.
[4]. Chen S, Sun S, Moonen D, et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection[J]. Cell reports, 2019, 27(13): 3780-3789. e4.
[5]. Romeo C, Chen S H, Goulding E, et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs[J]. Biochemical and biophysical research communications, 2020, 526(1): 85-90.
[6]. Rashnonejad A, Chermahini G A, Gündüz C, et al. Fetal gene therapy using a single injection of recombinant AAV9 rescued SMA phenotype in mice[J]. Molecular Therapy, 2019, 27(12): 2123-2133.
[7]. Song M, Zhao G, Sun H, et al. circPTPN12/miR-21–5 p/∆ Np63α pathway contributes to human endometrial fibrosis[J]. Elife, 2021, 10: e65735.

查看更多

查看更多

查看更多

联系我们

返回顶部