查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

做实验的小伙伴们一定对稳定细胞系不陌生,那么具体什么情况下要构建稳定细胞系,又有哪些方法流程呢?
第一,长期在目的细胞中研究基因功能,通过构建稳定株,可以大大降低频繁转染或者病毒包装的成本,也极大方便实验研究;
第二,部分蛋白半衰期极长,瞬时RNA只能干扰表达,无法去除已经表达的目的蛋白,通过构建稳定株可以实现更好的基因干扰效果;
第三,瞬转往往会引入极高拷贝数的表达,导致因为人为因素造成实验结果的不精确,构建稳定株可以帮助筛选拷贝数适量的细胞进行实验研究;
第四,需要用诱导表达系统的,主要是一些致死基因或者是需要时空表达的;
第五,需要用细胞做动物实验的,比如裸鼠成瘤等,往往需要构建成稳转株。
既然,稳定细胞系这么有用,能帮助我们解决如此诸多的问题,节约时间成本,提高实验效率,那么如何构建稳定细胞系就成了重点!
目前稳转细胞系的构建主流的方法肯定是慢病毒介导的,首先进行MOI摸索预实验, MOI(MultiplicityofInfection,感染复数),即每个细胞感染的病毒数;通常MOI越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。
举个例子,取MOI=3、10、30、100,根据操作说明,将换算好体积的病毒液加入细胞中。每孔加病毒量(µl)=MOI*细胞数/滴度(TU/ml)×1000
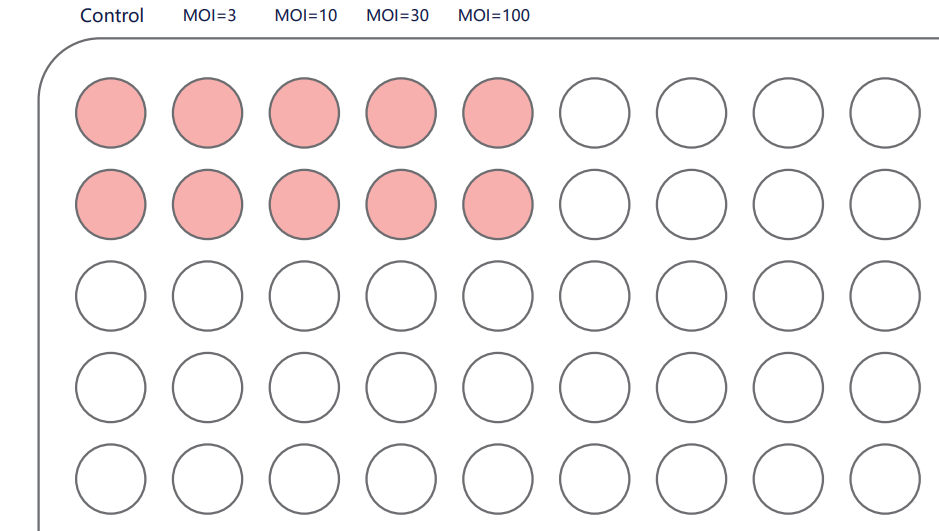
感染3-4天后,观察荧光表达情况,通过细胞感染效果,确认目的细胞的感染条件和感染参数。
小恒推荐1/2小体积感染法,即病毒感染时,加入1/2体积新鲜培养液,加入慢病毒感染4h后补足至培养体积。对于需要加入polybrene的细胞,可同时加入适量polybrene。24 h后吸去含有病毒的培养液,换上新鲜的完全培养液,继续培养。加入病毒48-72小时可以观察荧光效果。感染后进行细胞筛选,稳定细胞株的筛选有以下几种方法:
(1)嘌呤霉素筛选:嘌呤霉素最佳的作用时间是3-10天之间,嘌呤霉素常用浓度范围在1-10μg/ml。
感染培养72h(感染时间根据细胞的具体情况及感染效率而定)后在6孔板中加入之前预实验确定的puro药物浓度,根据培养基的颜色和细胞生长情况,每3~5天更换一次筛选培养基。当有大量细胞死亡时,可以把puro浓度减半维持筛选,每天观察细胞的状态,生长情况以及基因表达的水平及所占比例,直至显微镜下观察荧光细胞比例为90%以上。
(2)G418筛选:由于每种细胞对G418的敏感性不同,一般变动在100ug/ml~1000ug/ml范围。通过预实验确定了最佳筛选浓度。感染培养48小时或者更长,到细胞增长接近汇合时按1:4密度传代,继续培养,待细胞密度增至50%~70%汇合时;加G418:去掉培养液,PBS洗一次,加入按最佳筛选浓度配制好的G418筛选培养基。根据培养基的颜色和细胞生长情况,每3~5天更换一次筛选培养基。当有大量细胞死亡时,可以把G418浓度减半维持筛选。每天观察细胞的生长情况及荧光的所占比例,直至显微镜下观察荧光细胞比例为90%以上。
(3)潮霉素筛选:潮霉素用来筛选稳转株的工作浓度需要根据细胞类型,培养基,生长条件和细胞代谢率而变化。推荐使用浓度为50-1000μg/ml。一般而言,哺乳动物细胞50-500μg/ml,细菌/植物细胞20-200μg/ml,真菌300-1000μg/ml。对于第一次使用的实验体系建议通过建立杀灭曲线即剂量反应性曲线,来确定最佳筛选浓度。
但慢病毒只适用于目的基因较小的情况,如果基因较大包装慢病毒困难,还可以选择转座子系统介导的细胞系稳转系统。
以下以PiggyBac(PB)转座子为例
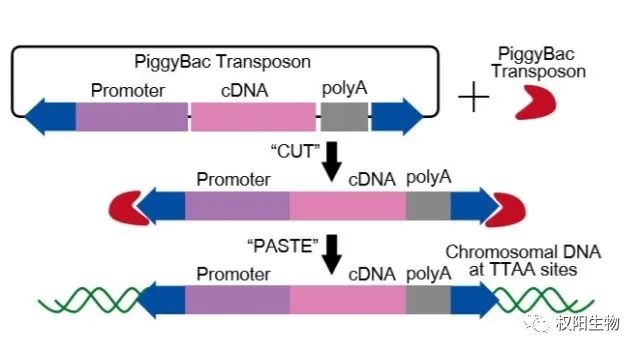
转座子也被称为跳跃基因,是指一段DNA序列由基因组的一个位置跳跃到另一个位置。转座子主要包含两种类型:I类转座子:逆转座子和II类转座子:DNA转座子。PiggyBac转座子结构与作用机制PB是一种II类转座元件,它特异性靶向DNA中的TTAA四核苷酸位点,PB转座子长度为2472bp,由PB转座酶(PBase)基因组成,该基因两侧有转座所需的末端重复序列。转座通过“剪切和粘贴”机制发生,在该机制中,PBase最初识别并结合转座子末端。然后,它将整个转座子从其原始位置切除,并通过一种不依赖于宿主因子的机制催化其插入另一个染色体位点。
除此之外,还可以选择CRISPR敲入系统; CRISPR敲入系统一般来说有两种情况,一种是定点敲入,该方法的目的是引入定点突变,crispr系统的基因敲入是概率事件,根据sgRNA位点及插入donor的差异,敲入效率并不是固定不变的,我们只能通过优化序列及介导效率去提高敲入的水平,最终还是要通单克隆分选,才能获得正确的定点敲入细胞株。另外一种是固定位点的整合将外源基因导入到目标细胞内,常用的整合位点AAVS1(human)及Rosa26(mus)。因为固定的整合位点是固定的sgRNA及donor序列,所有我们只需在donor的中间插入需要合成的外源基因序列,即可实现稳定的基因敲入目的。该方法的特定是定点整合,目标位置是已被证实的安全基因打靶位点,最大限度的降低基因导入对内源性基因表达的影响,结合特殊的递送载体,可实现外源基因的精准递送。
最后,还有最原始的细胞系构建方案——质粒筛选稳转细胞株,只需要把目的质粒成功转染到细胞内,使用对应抗性长期筛选,也有一定概率获得稳转细胞株,但稳定性和表达效率十分有限,实验难度也较大。

查看更多

查看更多

查看更多

联系我们

返回顶部