查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在前面几期的干货分享中,我们主要介绍了不同组织器官如何进行基因表达的特异性调控。接下来,我们将聚焦于基因魔剪CRISPR/Cas9基因编辑系统的研究。

基于细菌免疫系统CRISPR(clustered regularly interspaced palindromic repeat)改造发展而来的CRISPR/Cas9 系统正在改变着生物学和基础医学研究,是现有基因编辑和基因修饰技术中效率最高、最简便、成本最低的技术之一。CRISPR/Cas9的出现预示着一个新时代的到来,它允许人们轻易的在各种细胞和生物体中修改、调控或标记基因组位点,基因组层面的操作不再是实验的瓶颈,它为生物和医学的基础研究铺平了道路,并可应用于生物技术的各个分支以及人类疾病的治疗。今天我们将为大家讲解CRISPR/Cas系统的由来,CRISPR/Cas9基因编辑的基本原理,并介绍基于CRIPSR/Cas9的常用工具,以及递送CRIPSR/Cas9进入靶细胞的有效手段。
CRISPR/Cas系统是原核生物的一种天然免疫系统,其工作原理是(图1):当细菌或古细菌首次遇到病毒、噬菌体等入侵时,含有CRISPR序列的细菌会获得病毒的一段DNA序列,作为其内部重复序列之间的间隔区;当病毒再次入侵时,CRISPR序列会在前导区的调控下转录出pre-CRISPR-derived RNA (pre-crRNA) 和trans-acting crRNA (tracrRNA)。其中生物pre-crRNA最终会形成一段短小的crRNA ,crRNA与cas蛋白结合,通过碱基互补配对与入侵DNA结合,Cas蛋白发挥DNA内切酶的作用破坏病毒DNA序列,使其失活。
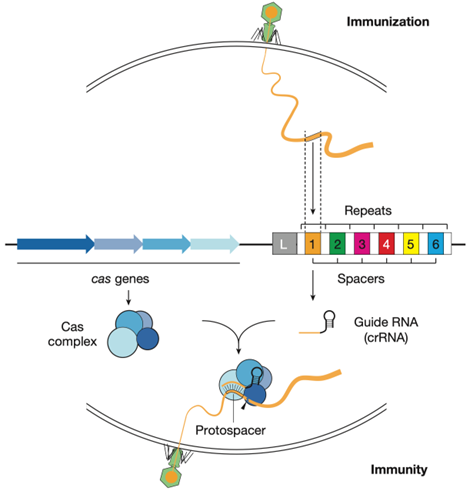
图1. CRISPR/Cas系统的工作原理
关于CRISPR的发现(图2),最早是在1987年Nakata等人在研究大肠杆菌的iap基因时,首次报告了在iap基因3’端结构域中发现了一段特殊序列,该序列由五个高度同源的序列组成,包含29个核苷酸,中间相隔32个核苷酸。在接下来的十多年中,研究人员继续在细菌和古细菌中发现了类似的有规律间隔重复序列。2002 年,Janson等人对这些重复的DNA序列命名为“成簇规则间隔短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPRs)”。 CRISPRs附近的基因早先被理解为DNA修复系统的一部分,但后来发现它们主要与 CRISPR基因伴生,因此被称为CRISPR相关(CRISPR-associated,Cas)基因。
2005年,Mojica等人发现细菌中的这种间隔序列大部分来自外源DNA,并且发现病毒更有可能感染没有同源间隔序列的细胞,因此猜测CRISPR 参与了细菌抵抗外部噬菌体感染或质粒转移等过程。这一猜测在随后的2年也被报道证实。
在2011年Siksnys等人将CRISPR基因序列从嗜热链球菌转移到大肠杆菌中,发现含CRISPR基因序列的大肠杆菌可以抵抗质粒转化,这也是CRISPR/Cas9在非宿主细菌中发挥作用的首次报道。2012年,Charpentier和Doudna利用Cas9实现了体外切割原核细胞DNA,并且阐明了CRISPR/Cas9的工作机制。2013年,麻省理工学院的华人学者张峰和哈佛大学医学院的George Church分别发文报道了CRISPR/Cas9被成功用于哺乳动物细胞的案例。至此,CRISPR基因编辑技术的研究得到了迅猛的发展,为从医学到农学等各个生物学领域创造了巨大的应用价值。
在之后的研究中,研究人员通过解析Cas9的物理化学结构、Cas9切割双链的作用机制等继续赋予cas9新的功能。比如通过突变Cas9的结构域得到了nCas9、dCas9,将他们与一些效应因子(如转录调节因子、DNA甲基化修饰因子、脱氨酶、逆转录酶等)融合开发了新的调控工具:转录激活/抑制系统、单碱基编辑器(如胞嘧啶碱基编辑器-CBEs、腺嘌呤碱基编辑器-ABEs)和先导编辑-PEs等。此外,也发现了具有RNA识别和切割功能的Cas13a以及同样具有DNA双链切割功能的cas12a等多种类型的cas蛋白,极大的丰富了基因编辑类型。
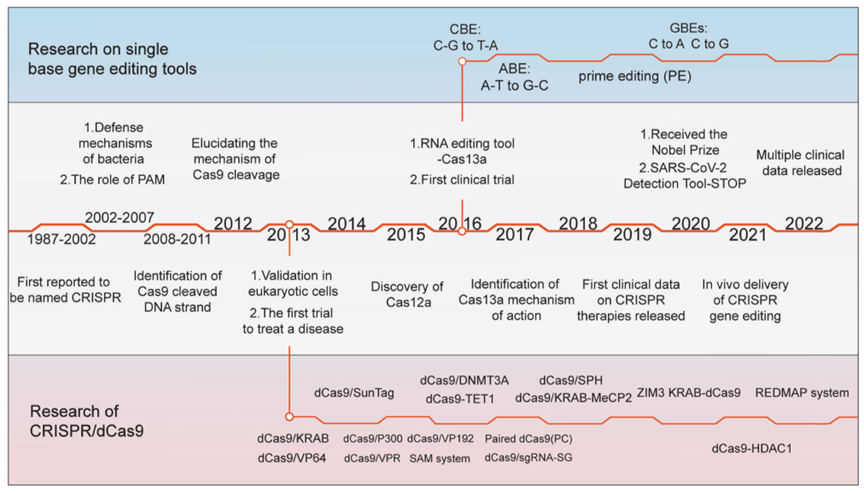
图2. CRIPSR/Cas系统发展历程
核酸酶Cas9具有HNH和RuvC两个DNA切割结构域(图3A),其中HNH切割sgRNA靶向的DNA链,RuvC切割非靶向链。在sgRNA的引导下,Cas9定向切割目的基因,使DNA产生双链断裂(DSB);然后经过细胞内源的DNA修复通路-非同源末端连接(NHEJ)或同源重组(HDR)进行修复;最终实现对靶基因的敲除、插入和突变修饰等(图3B)。
对Cas9分子结构的研究显示,Cas9先与sgRNA结合,在sgRNA的引导下,其进一步与目标双链DNA结合。Cas9的构象变化使靶向的双链DNA解旋,sgRNA链侵入,从而特异性的结合与sgRNA互补的DNA链。机制研究还表明,靶向序列3’端的PAM序列对最初的DNA结合至关重要;如果没有PAM,即使与sgRNA序列完全互补的靶序列也不会被Cas9识别。当序列完全匹配时,Cas9便发挥其核酸酶活性。HNH结构域和RuvC结构域分别切割一条DNA链,从而形成DNA双链断裂(图3A)。而对这两个结构域的其中一个进行突变,便可以获得只能切割单链的nCas9(Cas9 nickase);同时突变两个结构域则可以获得没有切割活性的dCas9 (Cas9 Endonuclease Dead)。这两种Cas9突变体被广泛应用于构建各种遗传操作工具。
Cas9切割产生的DNA双链断裂一般会被细胞内的DNA修复通路:NHEJ和HDR进行修复处理。NHEJ是一种易错DNA修复方式,它能快速连接DNA断裂缺口的两端,但其容易导致缺口处发生短片段的缺失或插入,从而造成基因编码区移码(移码突变:是指DNA分子由于某位点碱基的缺失或插入,引起阅读框架变化,造成下游的一系列密码改变,使原来编码某种肽链的基因变成编码另一种完全不同的肽链序列),使靶标基因失去功能,从而实现基因敲除。HDR则通过引入donor模板进行精确修复,通过提供修复模板,可以在Cas9切割位点附近实现对内源基因的精准修复(点突变、蛋白标签序列或荧光蛋白序列的插入、特定片段的删除等)(图3B)。
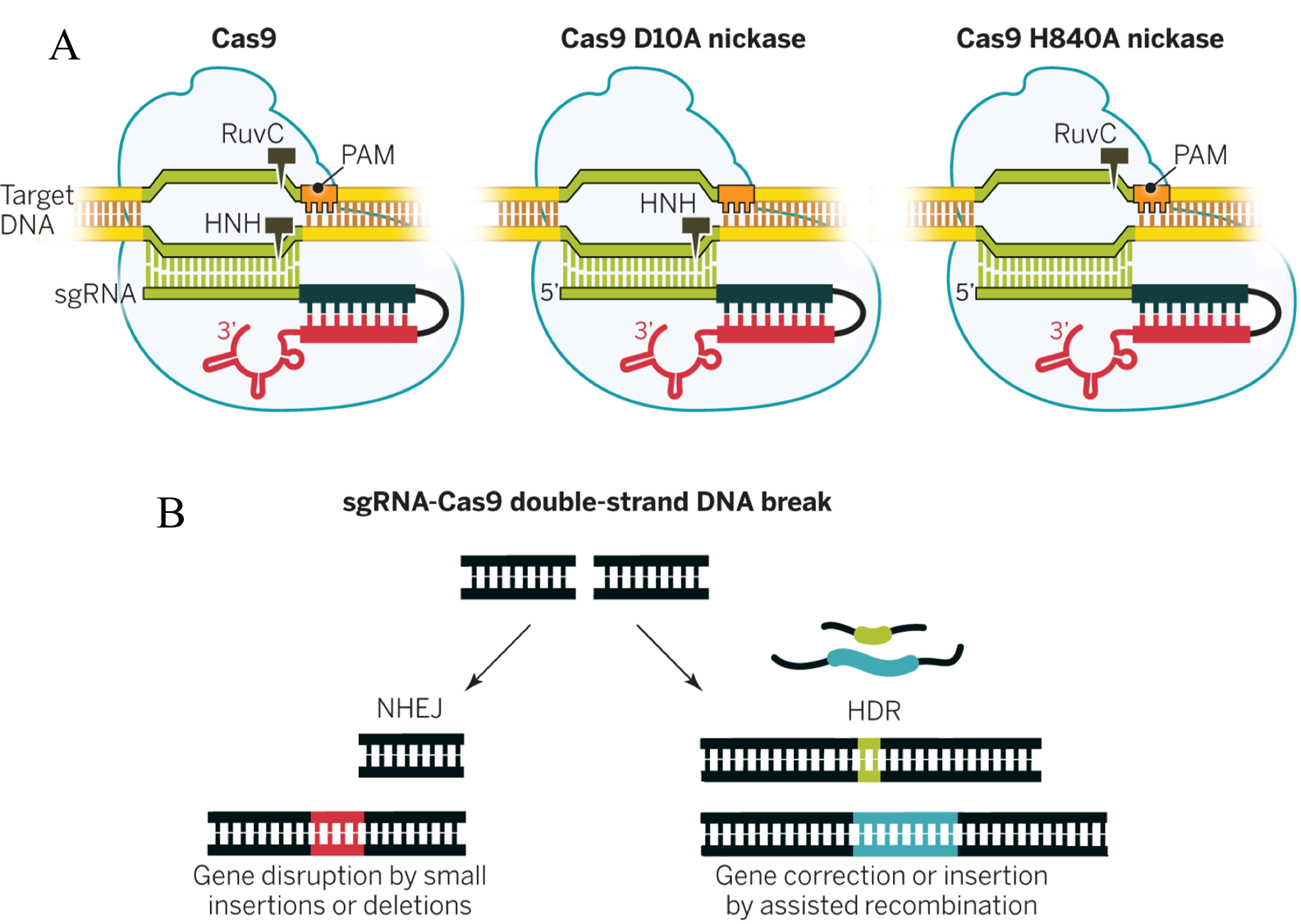
图3. CRIPSR/Cas9编辑原理(A)及Cas9蛋白切割原理(B)
由于其稳健性和灵活性,CRISPR正在成为一种多功能工具,其应用不仅改变了基因编辑研究,也改变了许多其他基因组和染色质操作工作。正如前文提到的,这些应用大多利用了dCas9的可编程靶向能力,它不能切割DNA,但仍能被引导至靶序列。研究人员已将这些Cas9变体重新用于各种基因组靶向研究工作中(图4)。
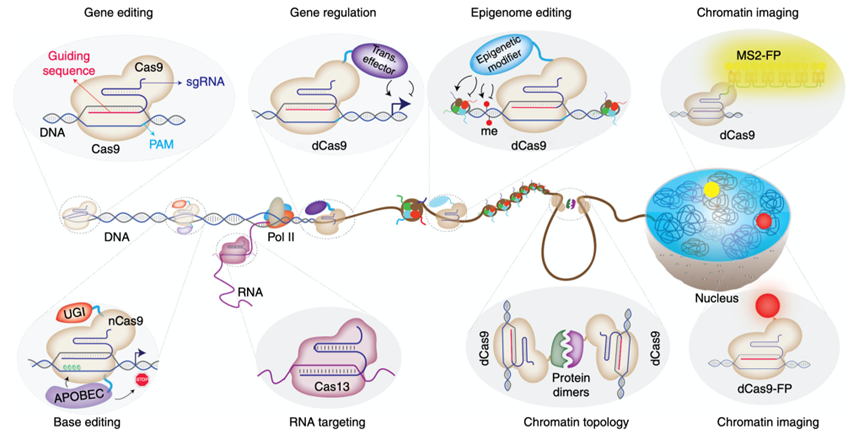
图4. 基于CRIPSR/Cas9的常用工具
1. 基因表达调控工具:通过融合表达或招募的方式将转录激活或抑制因子带到基因组的特定位点,以实现对特定基因表达的调控。由于dCas9能与DNA靶序列紧密结合,这种紧密结合会干扰其他 DNA 结合蛋白的活性,如内源性转录因子和RNA聚合酶II。人们利用这一点开发出了CRISPR干扰(CRISPRi)方法,其中dCas9的结合活性会阻断转录过程,从而抑制基因的表达。再次基础上,将 Kruppel-associated Box(KRAB)等强抑制因子复合物与dCas9融合可产生更强、更特异的基因抑制。相对的,使用dCas9靶向工具招募强转录激活因子可强力诱导基因表达。例如,将dCas9与VP64融合,VP64是由四个单纯疱疹病毒的16个氨基酸大小的转录激活结构域(VP16)串联组成,一些CRISPR基因激活工具进一步将dCas9与由VP64、P65和Rta(VPR)蛋白组成转录激活复合物融合,以实现更强效的基因表达效果。
2. 表观修饰编辑工具:基因组中有多种表观遗传调控机制,如DNA甲基化、组蛋白翻译后修饰等。其中,DNA甲基化是研究最广泛的基因调控表观遗传机制之一。为了实现对DNA甲基化状态的编辑,研究人员将 dCas9 与真核生物DNA甲基转移酶(DNMT3A)或原核生物DNA甲基转移酶(MQ3)的催化结构域融合,都观察到了目标位点DNA甲基化水平的增加和基因表达的改变。同时,有针对性地招募抑制表观遗传机制的其它组分,如KRAB-ZNF、DNMT3L和多聚酶复合体,进一步增强了DNA甲基化和长期持续的基因抑制。相对的,如果dCas9招募TET蛋白(TET1、TET2和TET3)的催化结构域可实现特定位点的DNA去甲基化。例如,dCas9-TET1 融合复合物可导致高达90%的局部CpG二核苷酸发生DNA去甲基化,并显著增加靶位点的mRNA表达。除DNA甲基化外,表观遗传信息还储存在组蛋白中,例如,基因组中活跃的远端调控元件在组蛋白H3的第4位赖氨酸(H3K4me1/2)上有单甲基化和二甲基化标记,染色质修饰受各种表观遗传写入器(writers)、读取器(readers)和擦除器(erasers)的动态调控。因此,利用多功能的dCas9工具,将各种组蛋白修饰因子招募到特定位点,可以实现对组蛋白修饰的改变。
3. 单碱基编辑工具:CRISPR技术领域的关键进展之一是单碱基编辑技术的发展。野生型Cas9会在目标位点造成DSB和Indel,与之不同的是,第二代基因组编辑工具能够精确地将一个碱基转换成另一个碱基,而不会造成DNA DSB。nCas9与APOBEC1脱氨酶和尿嘧啶糖基化酶抑制剂(UGI)蛋白融合而成的融合复合物能有效地将目标位点的胞嘧啶(C)转化为胸腺嘧啶(T),而不会造成DSB。另有研究将转运RNA腺苷脱氨酶与nCas9融合,开发出另一种新型碱基编辑器,可在目标位点直接实现A-G转换。这些新型碱基编辑方法大大扩展了基因组靶向的范围。除APOBEC腺苷脱氨酶外,活化诱导腺苷脱氨酶(AID)也已可与dCas9酶融合实现C到T的编辑。
4. 染色质成像工具:dCas9技术的进步也提高了活细胞染色质成像的效率和范围。研究人员已利用荧光标记的dCas9靶向基因组的重复区域,实现了这些区域在细胞内的可视化。此外还可以通过与不同荧光蛋白融合的dCas9同源物的共同表达实现特定区域的双色染色质成像,类似的方法被用于靶向端粒和中心粒的成像。将dCas9靶向非重复基因组位点更具挑战性,因为自由漂移的荧光标记dCas9蛋白会产生背景荧光信号。因此,要实现非重复基因组区域的活细胞成像,通常需要转染多达26-36个特异的sgRNA。另外,通过改造sgRNA支架,使其包含多个MS2结合模块,也可实现荧光信号的增强。
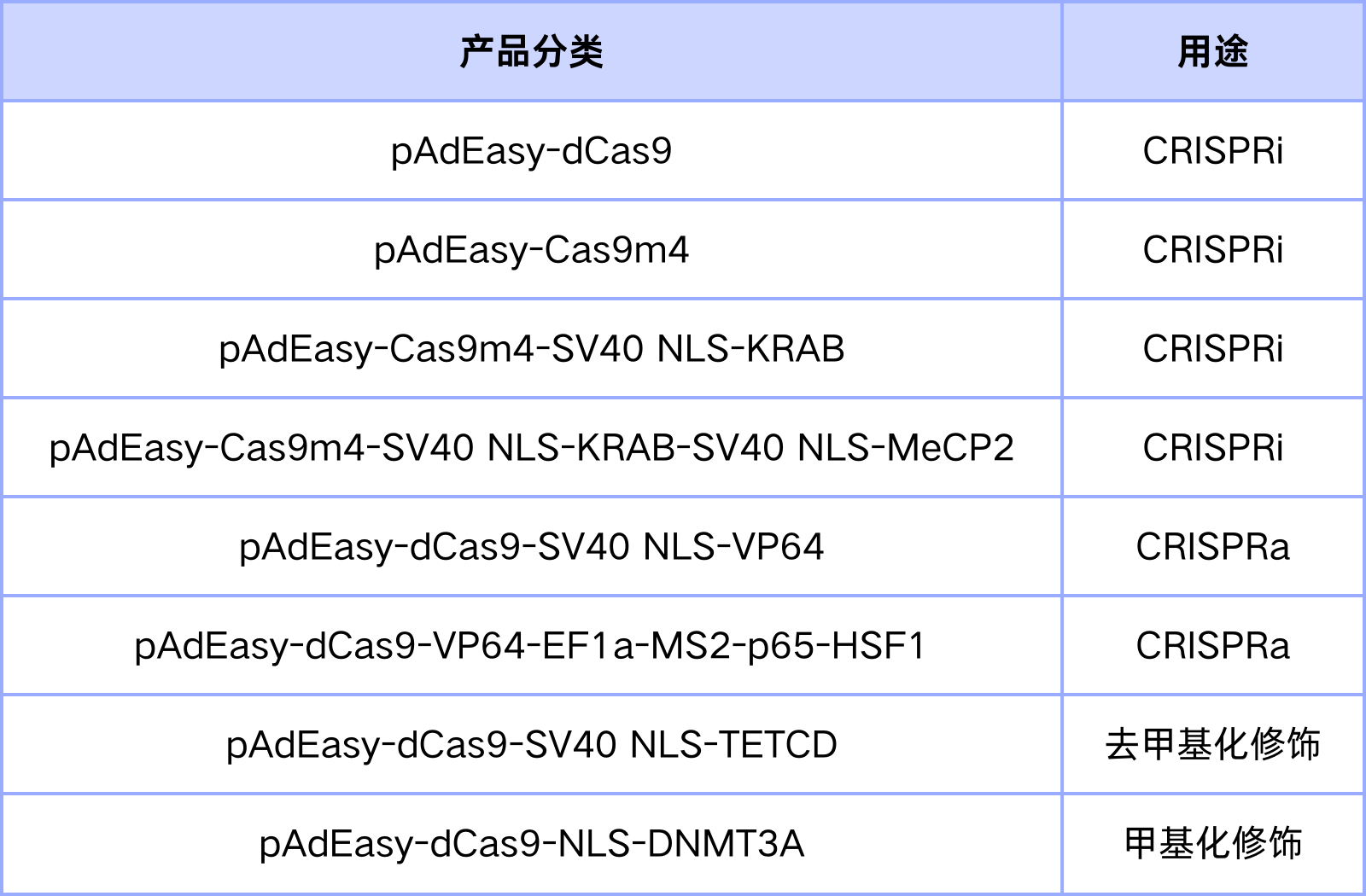
表1. 汉恒生物cas9突变体相关产品
CRISPR/Cas9应用广泛,根据目标细胞的不同,存在多种递送方式(图5),主要包括物理递送方法(如显微注射、电穿孔),化学递送方法(如脂质纳米颗粒、细胞穿透肽、多聚体),以及病毒递送方法(如慢病毒LV、腺病毒Ad和腺相关病毒AAV)。递送主要是将装载编码CRISPR/Cas9基因编辑系统的质粒或mRNA或sgRNA和cas9蛋白的RNP复合物递送到体外细胞或动物组织细胞中,在细胞内sgRNA和cas9蛋白表达并实现对目的基因的编辑效果。
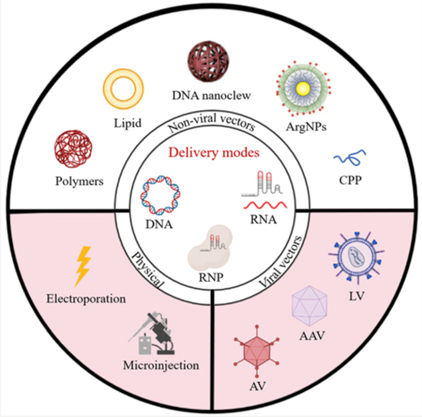
图5. CRISPR/Cas9主要递送工具
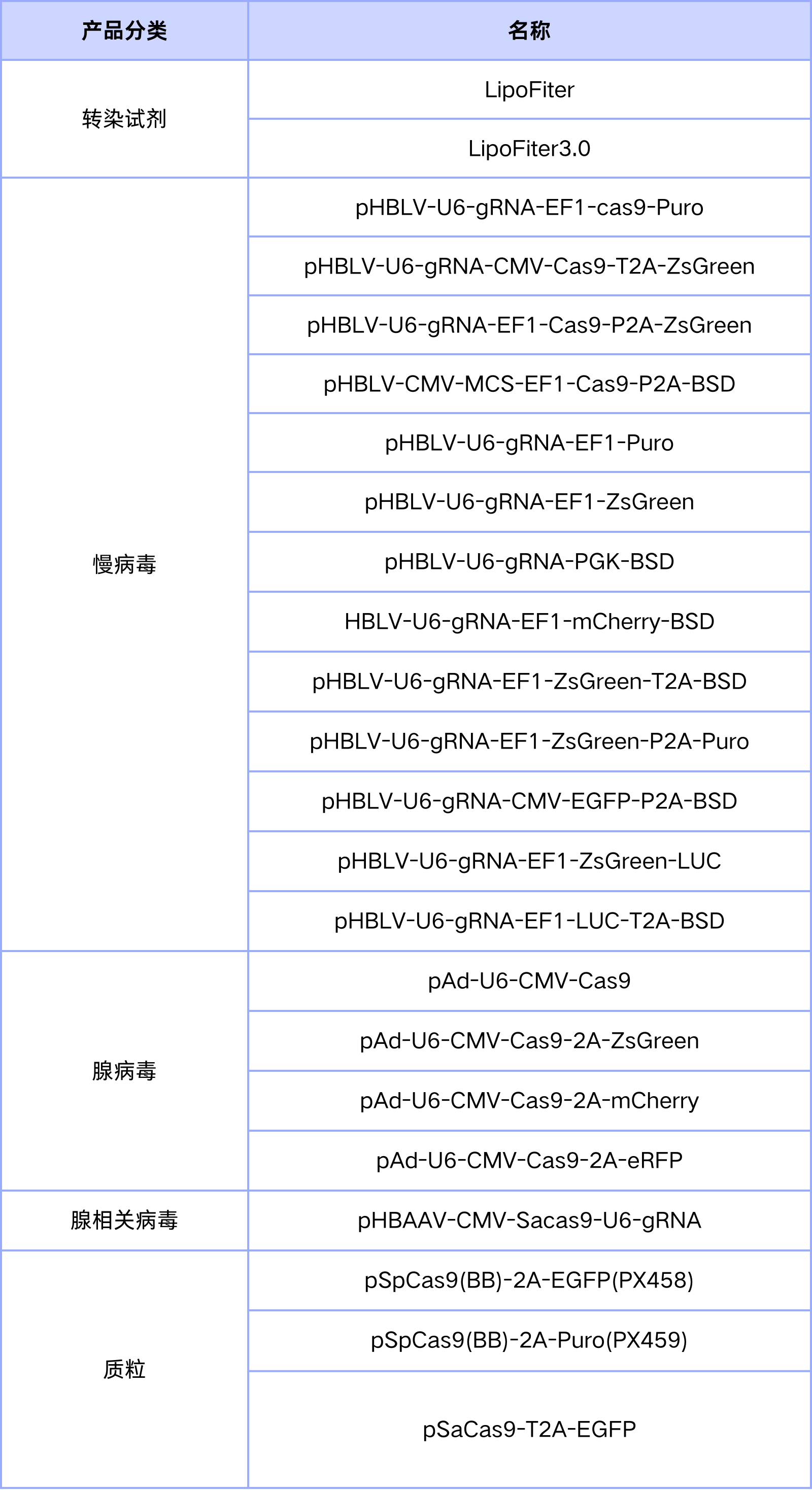
汉恒生物可提供用于CRISPR/cas9表达质粒递送的脂质体转染试剂,也可提供CRISPR/cas9表达质粒、慢病毒LV、腺病毒Ad和腺相关病毒AAV等相关递送工具(表2)。
表2. 汉恒生物CRISPR/cas9递送工具及质粒
本期关于CRISPR/Cas9系统介绍到这里就结束了,希望通过本期的介绍能够帮助大家更好地理解CRISPR/Cas9系统。下期我们将主要介绍利用CRISPR/cas9系统进行基因敲除操作的相关分享,感兴趣的小伙伴可以多多关注哦~~
参考文献:
[1]Marraffini LA. CRISPR-Cas immunity in prokaryotes. Nature. 2015;526(7571):55-61. doi:10.1038/nature15386
[2]Nidhi S, Anand U, Oleksak P, et al. Novel CRISPR-Cas Systems: An Updated Review of the Current Achievements, Applications, and Future Research Perspectives. Int J Mol Sci. 2021;22(7):3327. Published 2021 Mar 24. doi:10.3390/ijms22073327
[3]Li T, Yang Y, Qi H, et al. CRISPR/Cas9 therapeutics: progress and prospects. Signal Transduct Target Ther. 2023;8(1):36. Published 2023 Jan 16. doi:10.1038/s41392-023-01309-7
[4]Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014;346(6213):1258096. doi:10.1126/science.1258096
[5]Adli M. The CRISPR tool kit for genome editing and beyond. Nat Commun. 2018;9(1):1911. Published 2018 May 15. doi:10.1038/s41467-018-04252-2
[6]Lino CA, Harper JC, Carney JP, Timlin JA. Delivering CRISPR: a review of the challenges and approaches. Drug Deliv. 2018;25(1):1234-1257. doi:10.1080/10717544.2018.1474964
[7]Cheng H, Zhang F, Ding Y. CRISPR/Cas9 Delivery System Engineering for Genome Editing in Therapeutic Applications. Pharmaceutics. 2021;13(10):1649. Published 2021 Oct 9. doi:10.3390/pharmaceutics13101649

查看更多

查看更多

查看更多

联系我们

返回顶部