查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期干货内容为大家介绍了视网膜特异性基因调控策略,本期将为大家科普肌肉特异性基因调控策略,主要从肌肉组织特性、常见疾病、肌肉嗜性AAV血清型、肌肉特异性启动子和病毒递送到肌肉的方法等方面展开分享。

肌肉是多数动物体内重量最大的组织,具有驱动身体运动和保持身体姿势等功能。对于脊椎动物来说肌肉可分为骨骼肌(Skeletal muscle) 、平滑肌(Smooth muscle)和心肌(Cardiac muscle)三大类。骨骼肌是最常见的肌肉类型,附着于骨头,占比最大(占人体重量的40%)且分布广泛,机体可通过自主控制骨骼肌收缩和放松来协调身体的运动,如行走、跑步、举物等;而平滑肌主要存在于器官中、不受意识控制、通过自主神经系统调节,主要功能是维持内脏器官的正常运作,如胃、肠、血管等;心肌则是心脏中的肌肉组织,通过自主收缩推动血液流动[1]。
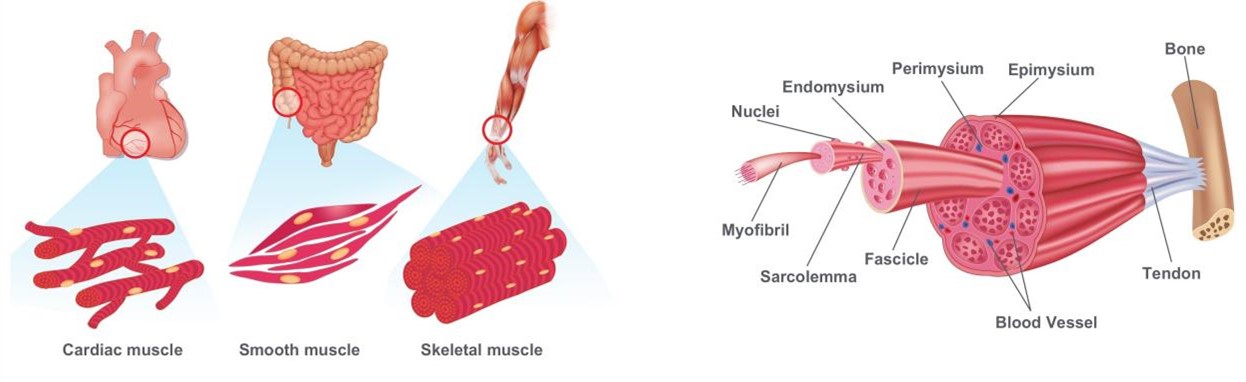
图1. 左:肌肉分类;右:骨骼肌结构
行动对于正常生活的重要性不言而喻,即使处于静止状态下也需要某些部位的肌肉正常运作以保证机体存活,如完成呼吸、心脏收缩舒张等。因此一旦肌肉发生病变,轻则不便生活,重则危及生命。肌肉病变主要症状表现为肌肉萎缩、肌收缩力减弱以至消失等,常见的肌肉疾病包括杜兴氏肌肉营养不良症(Duchenne muscular dystrophy, DMD)、肢带型肌营养不良症(LGMD)和庞贝病等。目前,传统药物只能减缓肌肉退化,缺乏长期有效的疗愈手段。因此,针对肌肉的靶向基因治疗成为科研工作者的持续关注重点,已有众多临床研究在探索肌肉疾病的基因治疗效果[2]。另一方面,肌肉还可以作为生物工厂来合成和分泌治疗剂,治疗诸如糖尿病、动脉粥样硬化、血友病、癌症和传染病等疾病[3]。
肌肉相对而言是比较容易操作的靶组织,通过直接靶向肌肉导入有助肌肉恢复功能的基因载体即可达到治疗目的。重组腺相关病毒(rAAV)作为最常用的基因治疗载体之一,具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验的基因治疗应用中。rAAV在肌肉靶向上的相关研究也在如火如荼地进行着。本文将结合相关研究案例详细介绍肌肉组织靶向性AAV的选择,包括血清型、特异性启动子以及常用注射方式等,希望能够为相关研究的科研工作者们提供一些思路和帮助。针对心肌特异性调控在往期干货《【心血管干货篇】AAV在心血管疾病研究中的靶向策略》中进行了独立介绍,感兴趣的小伙伴可以前往学习哦。
一、肌肉嗜性AAV血清型
针对AAV,虽然不同的血清型具有相似的结构和大小,但衣壳蛋白的结构不同决定了它们具有不同的组织或细胞嗜性。各类血清型AAV对肌肉组织的嗜性情况也有不少研究进行探索,如Carmela Zincarelli等人通过尾静脉向小鼠注射可表达荧光素酶的rAAV1-9,观察各rAAV在组织中的表达分布,结果显示在包括腘绳肌(hamstring)、腓肠肌(gastrocnemius)以及肱四头肌(quadriceps)的骨骼肌中rAAV9介导的荧光素酶活性最高(图2)[4]。另外,Zhong wang等人构建了可表达GFP的各血清型rAAV载体,并通过腹腔注射(图3a)和股静脉注射AAVs(图3c、d),检测了GFP在肌肉组织中的表达情况:rAAV8在腹腔注射方式中显示出最好的肌肉转导效率。与rAAV2相比,通过股静脉注射,rAAV8在腓肠肌(GAS)、胫骨前肌(TA)和大腿肌肉中均表现出较高的转导效率[5]。综上研究,在常规血清型中rAAV9、rAAV8 靶向肌肉的基因递送效果较好。

图2. 9种血清型AAV系统递送荧光素酶在组织中的表达情况[4]
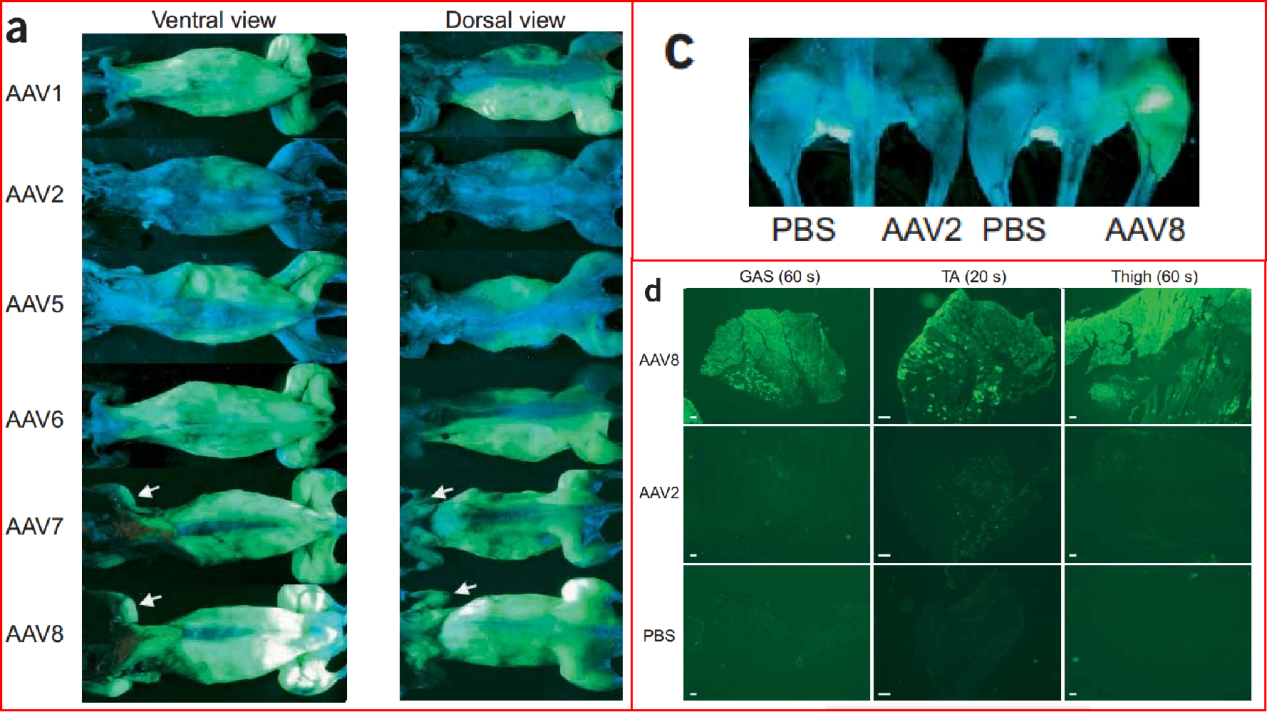
图3.a: 腹腔注射各血清型rAAV的表达情况;c: 后腿股静脉注射rAAV2和rAAV8后GFP表达情况;d: 后腿股静脉注射后腓肠肌(GAS)、胫骨前肌(TA)和大腿肌肉横切面荧光图[5]
二、肌肉特异性启动子
除了选择靶向性血清型外,不同类型肌细胞的基因特异性调控还可以借助特异性启动子来实现。汉恒生物不仅可以提供广谱启动子,如CMV、EF1A等,还推出了4种肌细胞特异性启动子,可帮助您构建高效、特异性靶向不同肌肉组织的rAAV载体。
表1. 肌细胞特异性启动子

1、SM22α平滑肌细胞特异性启动子[6]
SM22α是一种22 kDa的钙调相关蛋白,在平滑肌中特异性表达,为平滑肌细胞最广泛使用的标志物。因此,AAV携带SM22α启动子可用于靶向感染平滑肌细胞。
【汉恒文献速览】 河北医科大学韩梅教授团队发现血管张力关键调节因子Kv7.4通道加重了血管炎症反应,促进了内膜增生和腹主动脉瘤的形成。文章使用汉恒生物提供的AAV9-SM22α-shKcnq4成功敲低了血管平滑肌细胞中Kv7.4的表达水平(图4)[7]。
注射参数
病毒类型:HBAAV9-SM22α-shKcnq4
目标部位:主动脉平滑肌
注射方法:尾静脉注射
注射剂量:5×109 pfu/kg
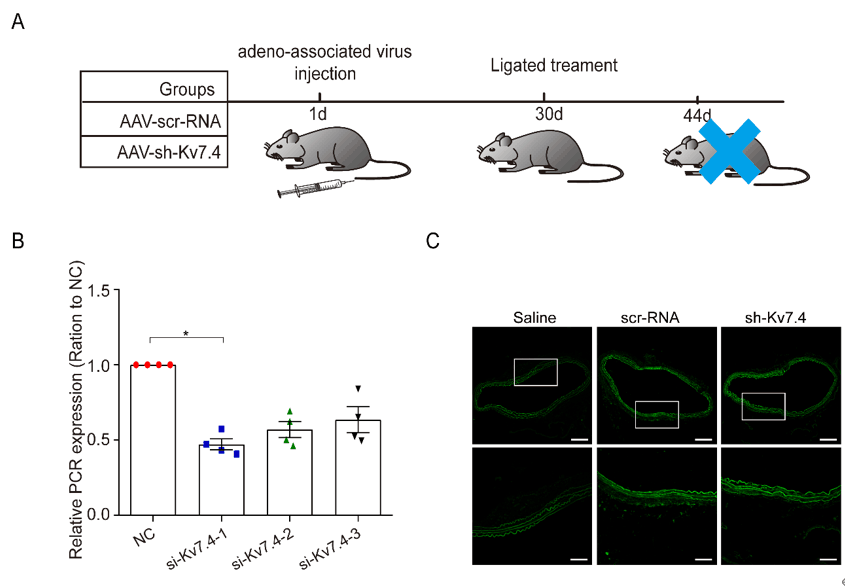
图4.AAV感染视网膜色素上皮细胞结果图[7]
【汉恒文献速览】 中山大学第八附属医院黄慧团队研究发现血管平滑肌细胞SIRT6 特异性敲除小鼠表现出慢性肾脏病(CKD)的血管钙化(VC)现象。文章中用于敲低的AAV2-SM22α-shSIRT6病毒由汉恒生物提供。注射病毒4周后处死部分小鼠并收集主动脉和肾脏,通过WB检测AAV2-SM22α-shSIRT6在主动脉和肾脏中的敲低效率,发现该病毒在主动脉处实现了特异性敲低(图5)[8]。
注射参数
病毒类型:HBAAV2-SM22α-shSIRT6
目标部位:主动脉平滑肌
注射方法:尾静脉注射
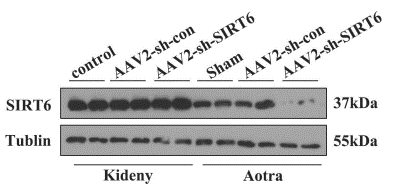
图5. 主动脉平滑肌细胞特异性敲低SIRT6结果图[8]
2、MHCK7横纹肌细胞特异性启动子[9]
ɑ-肌球蛋白重链增强子/肌酸激酶增强子启动子(hybridα-myosin heavy chain enhancer-/muscle creatine kinase enhancer-promoter, MHCK7)是由Salva MZ等人通过对小鼠肌肉肌酸激酶启动子(murine muscle creatine kinase, MCK)优化所得,MHCK7启动子在小鼠以及灵长类动物肌肉组织中具有良好的特异性和较高的启动效率,在科研及临床前期实验中得到广泛的运用[10]。
【汉恒文献速览】 中国人民解放军第二军医大学王培教授团队发现富含FNDC5/irisin(骨骼肌高表达的运动相关激素)的外循环囊泡有助于运动引起的血管老化保护。文章中使用的AAV2/9-MHCK7-mFndc5-EGFP病毒由汉恒生物提供,文章结果显示EGFP仅在骨骼肌中表达,肝脏中没有表达[11]。
注射参数
病毒类型:HBAAV2/9-MHCK7-mFndc5-EGFP
病毒滴度:1.8×1012 vg/ml
目标部位:胫骨前肌和腓肠肌
注射方法:肌肉原位多点注射
注射剂量:50ul/部位,首次注射3天后重复注射一次。
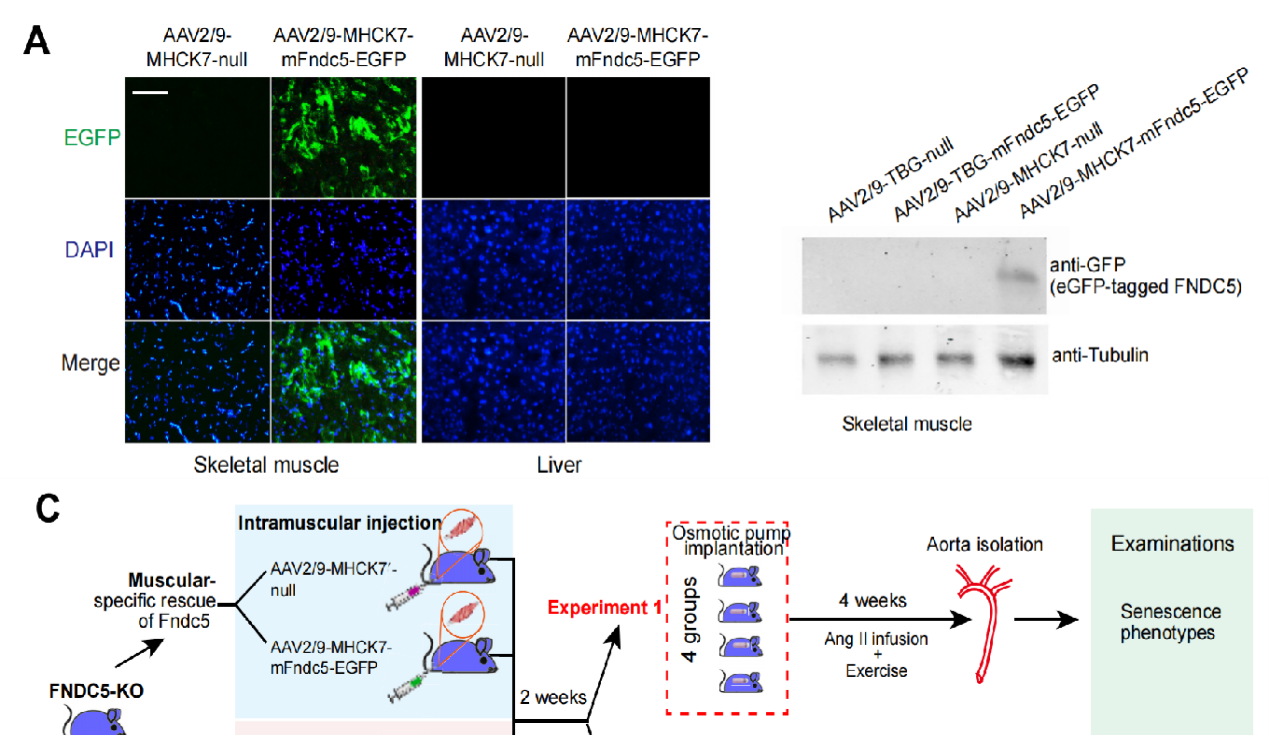
图6. AAV2/9-MHCK7在骨骼肌中的基因递送效率[11]
3、ACTA1肌原细胞特异性启动子[12]
人骨骼肌肌动蛋白(HSA,又名ACTA1)在骨骼肌中高水平表达,可在横纹肌中特异性表达并调节其正确发育过程。
【文献速览】 佛罗里达大学研究者发现血管生成关键因子PFKFB3的肌肉特异性和内皮特异性表达都增强了缺血性血运重建,但只有肌肉特异性表达PFKFB3才能改善肌肉功能。研究者采用肌肉原位注射将AAV2/9 - ACTA1病毒注射至小鼠胫骨前肌(TA)及趾长伸肌(EDL)中,并通过荧光蛋白表达情况确定了其在胫骨前肌及趾长伸肌中的基因递送效率[13]。
注射参数
病毒类型:AAV2/9-ACTA1-PFKFB3
目标部位:胫骨前肌(TA)及趾长伸肌(EDL)
注射方法:肌肉原位多点注射
注射剂量:TA 50ul,EDL 12ul
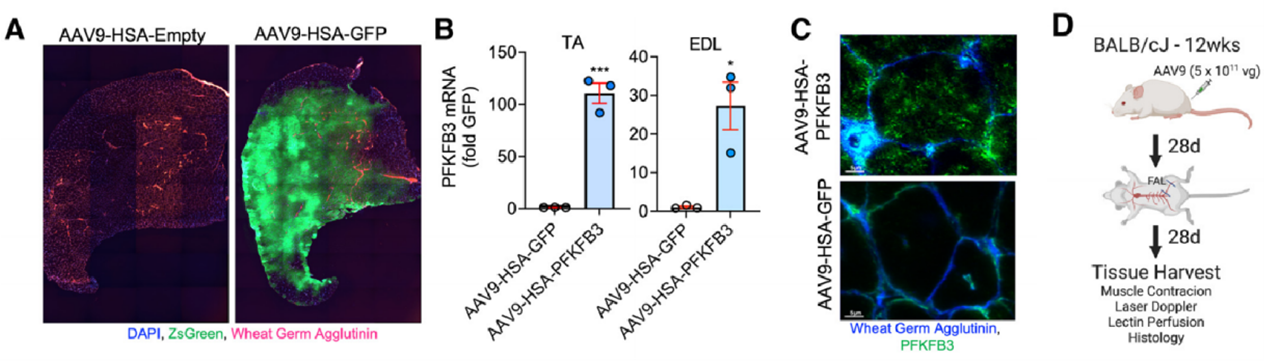
图7. AAV2/9 -ACTA1在胫骨前肌及趾长伸肌中的基因递送效率[13]
4、MyoG成肌细胞特异性启动子[14]
肌细胞生成素(myogenin, MyoG)是骨骼肌中特异表达的基因之一。Yee SP等人通过截取小鼠MyoG 5’侧翼-4.25 kb区域内不同片段缺失序列以启动报告基因lacZ的表达,并将其构建成不同的转基因小鼠胚胎,对胚胎中lacZ的表达模式进行了分析。结果表明,由MyoG启动子启动的lacZ表达仅限于体节的肌节细胞;-1092 ~ -134bp之间的序列对lacZ表达效率产生最显著的影响;而只有包含5'侧翼-133 ~1bp内的序列能够正确靶向肌节细胞表达。
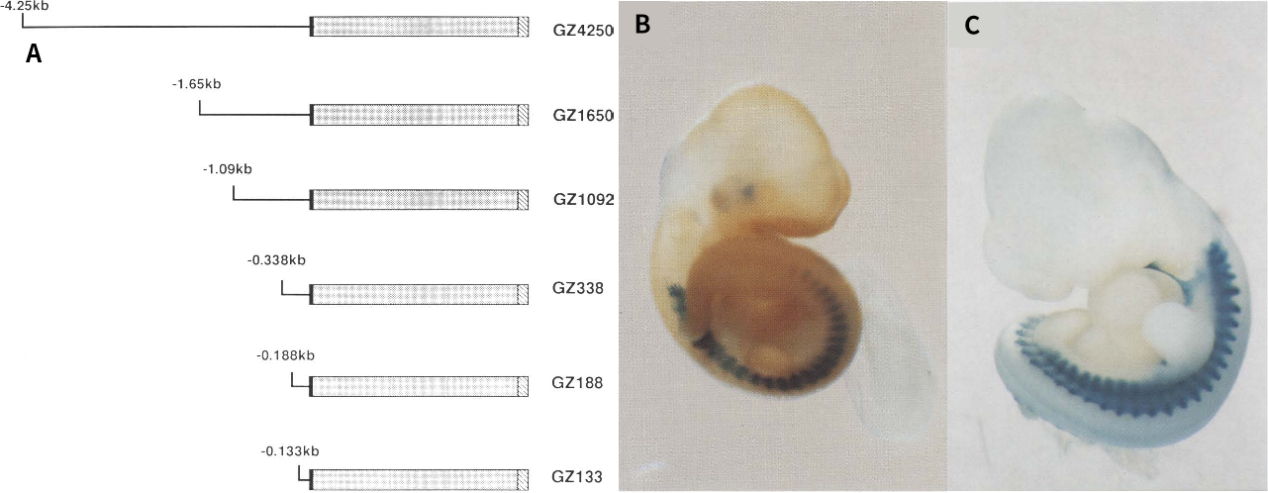
图8. MyoG启动子启动lacZ在胚胎中的表达情况。A:MyoG启动子不同缺失模型图;B:GZ4250在10.5 dpc胚胎中的表达情况;C:GZ1092在10.5 dpc胚胎中的表达情况。(蓝色染色区域为lacZ表达区域)[14]
三、病毒递送方法
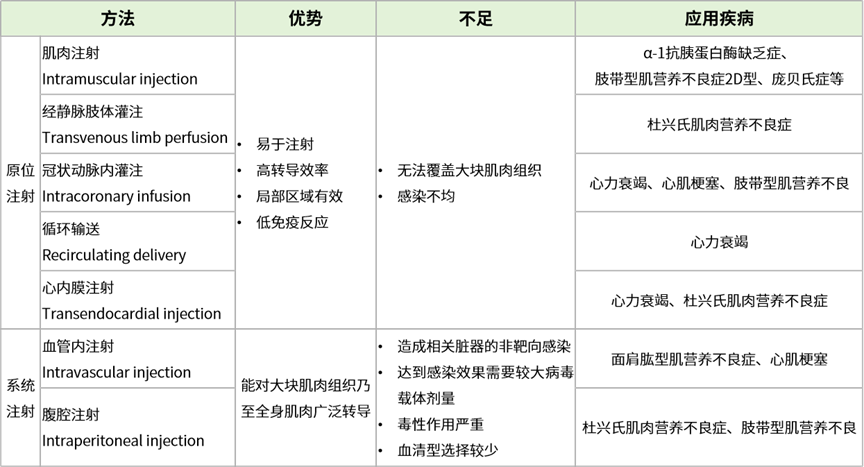
向肌肉组织递送AAV病毒载体的方式通常分为局部原位注射和系统性注射两大类。一般来说肌肉疾病大多表现为全身性,因此系统性注射是最优策略。然而在一些需要利用肌肉组织作为生物工厂分泌特定分子的过程中,直接进行肌肉注射效果更佳。对于局部大面积的肌肉组织,也可采用逆行性经静脉肢体灌注的方法局部转导AAV。具体注射方式和用量,建议老师们先进行预实验哦,选择最适合自己实验的AAV血清型、特异性启动子以及操作方式。
关于肌肉的AAV病毒递送方式详情可以参考下表[15]:
表2. 肌肉靶向性AAV递送方式
接下来还将会为大家分享胰腺、肝脏的组织(细胞)特异性调控干货知识,欢迎大家继续订阅关注!
参考文献:
[1] Muscle. (n.d.). https://www.britannica.com/science/muscle.
[2] Asher DR, Thapa K, Dharia SD, Khan N, Potter RA, Rodino-Klapac LR, Mendell JR. Clinical development on the frontier: gene therapy for duchenne muscular dystrophy. Expert Opin Biol Ther. 2020 Mar;20(3):263-274.
[3] Mah, Cathryn S, Christina A. Pacak, and Barry J. Byrne. Muscle as a metabolic factory for gene therapy. Muscle Gene Therapy (2010): 219-230.
[4] Zincarelli, Carmela et al. “Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection.” Molecular therapy : the journal of the American Society of Gene Therapy vol. 16,6 (2008): 1073-80.
[5] Wang Z, Zhu T, Qiao C, et al. Adeno-associated virus serotype 8 efficiently delivers genes to muscle and heart. Nat Biotechnol. 2005;23(3):321-328.
[6] Li L, Miano JM, Mercer B, Olson EN. Expression of the SM22alpha promoter in transgenic mice provides evidence for distinct transcriptional regulatory programs in vascular and visceral smooth muscle cells. J Cell Biol. 1996;132(5):849-859.
[7] Fan XZ, Wang YY, Cui ZY, et al. Kv7.4 channel is a key regulator of vascular inflammation and remodeling in neointimal hyperplasia and abdominal aortic aneurysms. Free Radic Biol Med. 2022;178:111-124.
[8] Li W, Feng W, Su X, et al. SIRT6 protects vascular smooth muscle cells from osteogenic transdifferentiation via Runx2 in chronic kidney disease. J Clin Invest. 2022;132(1):e150051.
[9] Salva MZ, Himeda CL, Tai PW, et al. Design of tissue-specific regulatory cassettes for high-level rAAV-mediated expression in skeletal and cardiac muscle. Mol Ther. 2007;15(2):320-329.
[10] Salva MZ, Himeda CL, Tai PW, et al. Design of tissue-specific regulatory cassettes for high-level rAAV-mediated expression in skeletal and cardiac muscle. Mol Ther. 2007;15(2):320-329.
[11] Chi C, Fu H, Li YH, et al. Exerkine fibronectin type-III domain-containing protein 5/irisin-enriched extracellular vesicles delay vascular ageing by increasing SIRT6 stability. Eur Heart J. 2022;43(43):4579-4595.
[12] Brennan KJ, Hardeman EC. Quantitative analysis of the human alpha-skeletal actin gene in transgenic mice. J Biol Chem. 1993;268(1):719-725.
[13] Salyers ZR, Coleman M, Le D, Ryan TE. AAV-mediated expression of PFKFB3 in myofibers, but not endothelial cells, improves ischemic muscle function in mice with critical limb ischemia. Am J Physiol Heart Circ Physiol. 2022;323(3):H424-H436.
[14] Yee SP, Rigby PW. The regulation of myogenin gene expression during the embryonic development of the mouse. Genes Dev. 1993;7(7A):1277-1289.
[15] Wang D, Zhong L, Nahid MA, Gao G. The potential of adeno-associated viral vectors for gene delivery to muscle tissue. Expert Opin Drug Deliv. 2014 Mar;11(3):345-36

查看更多

查看更多

查看更多

联系我们

返回顶部