查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
非酒精性脂肪肝(NAFLD)以肝脂肪变性为特征,可发展为肝脂肪性肝炎、肝硬化,甚至肝细胞癌(HCC)。非酒精性脂肪肝还与其他代谢性疾病(如胰岛素抵抗 (IR)、2型糖尿病 (T2DM) 和心血管疾病 (CVD))并存,增加了不良临床结果的风险。迄今为止,非酒精性脂肪肝还缺乏有效的治疗性药物。
2023年8月16日,上海交通大学贾伟、郑晓皎及贾伟平以共同通讯作者在《Cell Metabolism》上在线发表了题为“Hyodeoxycholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis”的研究论文,发现了NAFLD 患者的独特代谢特征,并且发现口服猪去氧胆酸(HDCA)物质可显着改善高脂饮食 (HFD) 喂养小鼠的 NAFLD 表型,表明 HDCA 具有治疗 NAFLD 的潜力。值得注意的是,在本研究中,作者使用了汉恒生物提供的AAV-shCyp7b1病毒,对Cyp7b1基因进行了敲低。
接下来,让我们一起来了解一下这篇文章吧。
鉴于胆汁酸(BA)与包括肥胖和糖尿病在内的代谢异常之间存在明确的相关性,作者对由 251 名参与者(178 名 NAFLD 患者和 73 名健康对照者)组成的队列进行了研究,以阐明血清中 BA 水平,尤其是猪胆酸(HCA) 种类、HDCA和甘氨猪去氧胆酸 [GHDCA] 的总和)与非酒精性脂肪肝之间的关系。结果发现与对照不同,非酒精性脂肪肝患者血清中 HCA 种类的水平显著降低,尤其是 HDCA + GHDCA的种类,由此将非酒精性脂肪肝与 HDCA 的耗竭联系起来了。
临床和动物实验数据显示,NAFLD 受试者血清和肝脏中的 HCA 种类(尤其是 HDCA)水平显着降低。作者又进一步评估了HDCA和猪胆粉(bilepowder,从猪胆汁中提取的富含HDCA的粉末)对NAFLD小鼠模型的治疗效果。结果发现,猪胆粉和HDCA显着减少了肝细胞中积累的过量脂滴和肝脏重量。HFD+HDCA或HFD+猪胆粉组血清ALT(丙氨酸氨基转移酶)水平显着降低,AST(谷草转氨酶)水平也有所降低,但无统计学意义。作者又评估了 HDCA 在两种 NAFLD 小鼠模型中的治疗效果,发现HDCA治疗后小鼠肝脏TG、组织学评估(脂肪变性、气球样变、炎症和纤维化评分)和血清ALT均显着改善,这与db/db小鼠模型的中结果一致。这些结果表明HDCA 缓解了 NAFLD 表型。
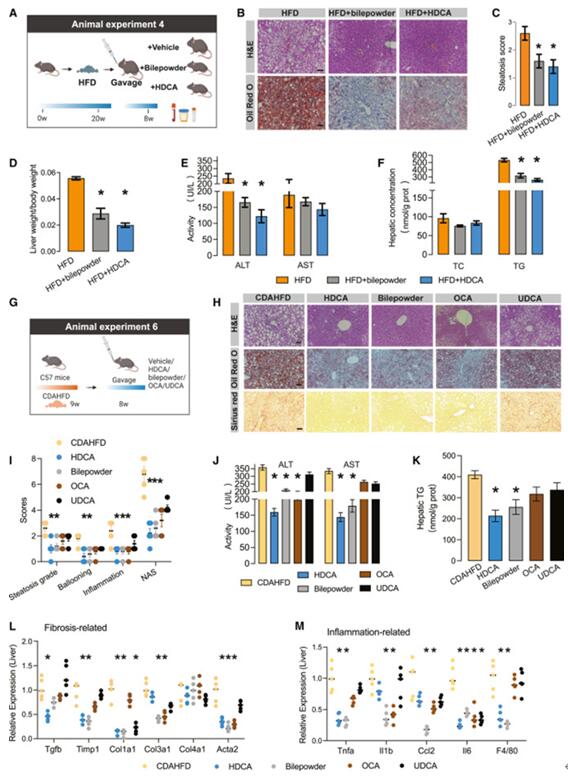
图1. HDCA减弱NAFLD相关代谢表型
为了研究HDCA或猪胆粉对整体表达的影响并确定其潜在的分子靶标,作者利用对照组、HFD组、HFD +猪胆粉组和HFD + HDCA组的肝组织进行RNA测序(RNA-seq)分析。基因分层聚类数据显示,除HFD组外,对照组、HFD+胆粉组和HFD+HDCA组都聚类在一起。根据KEGG通路富集分析发现,主要胆汁酸生物合成通路受到严重影响。根据基因丰度绘制火山图,发现在Cyp7a1下调的同时,Cyp7b1显著上调,这表明在HDCA干预下,BA的生物合成过程从经典途径转向了替代途径。qPCR 和蛋白质印迹分析也验证了 RNA-seq 的结果,即 CYP7A1 下调的同时 CYP7B1 表达显着上调。作者通过腺相关病毒(AAV)在小鼠肝脏对Cyp7b1进行敲低和过表达, HFD喂养20周的小鼠注射AAV,随后给予HDCA或猪胆粉处理8周,发现HDCA 或猪胆粉的治疗效果在shCyp7b1小鼠中有所下降。当肝脏Cyp7b1被敲低时,干预组中肝脏 TG 和血清 ALT 水平的缓解作用也减弱,而当肝脏Cyp7b1过表达时,肝脏中脂肪的积累大大减少,代谢紊乱也得到很大改善,与HFD+HDCA组相似。这些结果表明CYP7B1驱动的BA替代生物合成在减轻肝脏脂肪变性中发挥着至关重要的作用,也可能是HDCA抗NAFLD作用的关键机制。
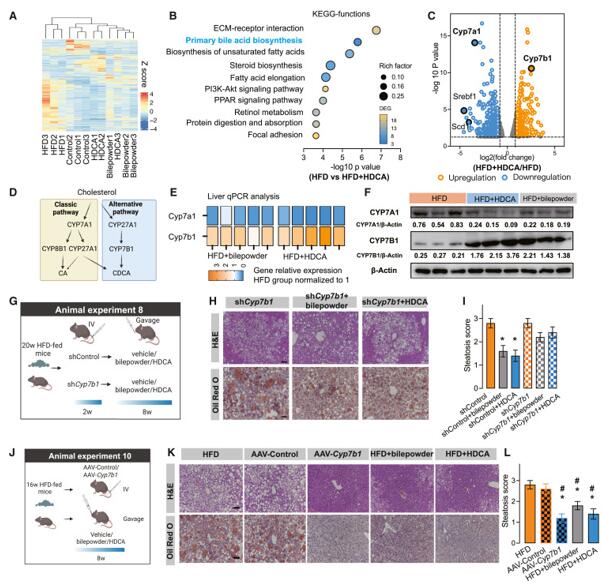
图2. HDCA 激活了以 CYP7B1 为主要目标的 BA 替代合成途径
紧接着,作者探究并破译了HDCA改变BA合成途径的分子机制。在研究中发现HDCA 或猪胆粉在不同小鼠模型中均抑制肠道FXR-FGF15信号传导,具体表现在肠道 mRNA、蛋白质表达、血清中 FGF15 的水平以及肠道 FXR-FGF15 信号传导的水平变化。为了证实HDCA对FXR通路的抑制作用,作者培养了小鼠肠道类器官,并在体外观察到 FXR 靶基因表达的减少。当使用肠道限制性 FXR 抑制剂甘氨酸-β-木胆酸(Gly-MCA)来模拟HDCA对肠道 FXR 信号转导的影响时,发现肝脏 CYP7A1 和 CYP7B1 均上调,这与 HDCA 上调 CYP7B1 和下调 CYP7A1 的效果不同。这一差异表明,还有其他因素导致 BA 合成发生改变,从经典途径转向替代途径。作者认为HDCA 诱导的肠道微生物群改变可能有助于缓解肝脏脂肪变性,并在小鼠中进行粪便微生物群移植 (FMT)来加以验证。HFD组和HFD+HDCA组小鼠的粪便经抗生素抑制肠道微生物后分别植入无菌小鼠体内。与 FMT-HFD 组相比,接受 HFD + HDCA 组粪便的小鼠肝脏脂肪积累减少。此外,与接受 HFD 组肠道微生物群的小鼠相比,它们还表现出较低水平的 TC、TG、ALT 和 AST,并且葡萄糖稳态得到改善。FMT-HFD + HDCA组中CYP7A1的表达下调,而CYP7B1的表达上调,与HDCA干预结果一致。使用 FMT 和抗生素的小鼠的这些代谢表型和 BA 合成模式证实了肠道微生物群在 HDCA 对肝脏脂肪变性的治疗效果中的关键作用。

图3. HDCA 以肠道依赖的方式减轻肝脏脂肪变性
随后,为了确定猪胆粉和 HDCA 如何影响重塑的肠道微生物群,作者对HFD、HFD +猪胆粉和HFD + HDCA组的盲肠内容物进行了宏基因组测序。PCoA 分析显示,HFD 和猪胆粉/HDCA 治疗组之间的肠道微生物群落有明显的聚类,具有统计学上的显着性,这意味着猪胆粉或HDCA干预后肠道微生物群具有显著差异。三组中的α多样性(香农指数)保持不变。在门水平上,经猪胆粉和HDCA处理后,厚壁菌门显著减少,而拟杆菌门(P. distasonis)显著增加。作者通过的生长曲线研究 HDCA、CA 和 CDCA 对P. distasonis生长的影响,发现 HDCA比CA和CDCA更能加速P. distasonis的生长,这表明HDCA为P. distasonis的繁殖提供了有利的环境。为了测试 HDCA 诱导P. distasonis的重要性,作者又进行了P. distasonis单定植实验,将HDF诱导小鼠每天用活P. distasonis (HFD + LPD) 或热灭活的P. distasonis (HFD + KPD) 口服喂养,持续8周。结果显示,HFD+LPD组脂肪堆积程度明显减轻,肝脏CYP7B1表达增加,CYP7A1表达减少。然后,作者探究了受 HDCA 和胆粉影响的微生物组功能,根据 VIP 评分,发现与 HFD 组相比,其不饱和脂肪酸途径的生物合成显着增加,P. distasonis的相对丰度与不饱和脂肪酸生物合成途径呈正相关,这表明P. distasonis参与了不饱和脂肪酸代谢。为了进一步验证这一点,作者在HFD组和对照饮食组提取物中培养了P. distasonis ,以确定食品成分是否为肠道微生物群提供了底物。有趣的是,P. distasonis在 HFD 提取物中培养时会在很短的时间内产生 γ-亚麻酸 (C18:3)。
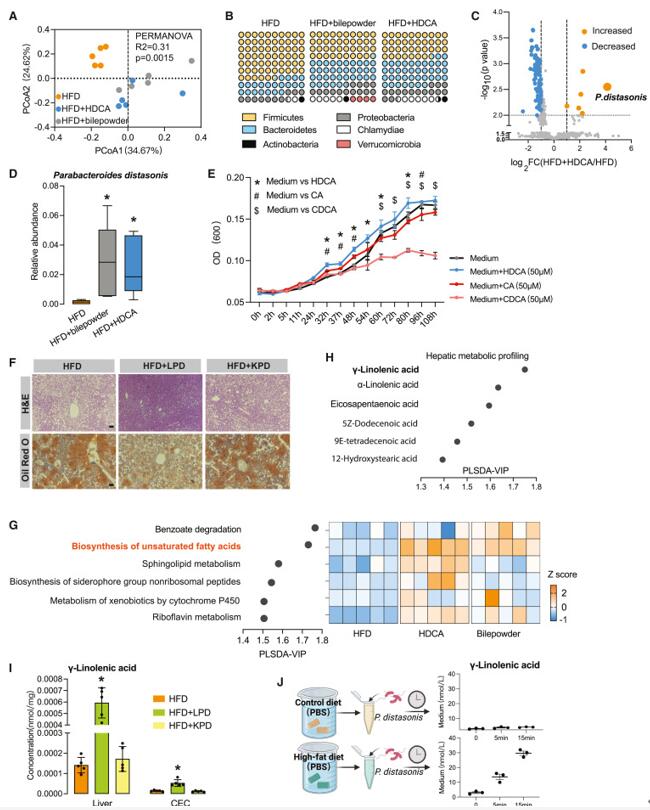
图4. HDCA富集了distasonis Parabacteroides 及其衍生脂肪酸
分析RNA-seq数据中的转库因子,发现PPAR信号通路显着上调,并且PPARα在HDCA影响的所有转录因子中排名第一。鉴于 PPARα 公认的配体是脂肪酸,作者认为P. distasonis衍生的 γ-亚麻酸诱导了PPARα 调节 BA 合成酶的表达。将原代小鼠肝细胞与 PPARα 激动剂吡尼尼克酸 (Wy-14643) 和不同浓度的 γ-亚麻酸共培养,结果表明 CYP7A1 受到抑制。为了研究 γ-亚麻酸调节 CYP7A1 的机制,作者通过双荧光素酶实验检测了吡尼尼克酸 (Wy-14643) 和 γ-亚麻酸对 CYP7A1 的转录活性的影响,发现 PPARα/RXRα 的过表达降低了 CYP7A1 转录活性,添加吡尼酸和 γ-亚麻酸后,活性进一步降低。使用Pparα −/−小鼠HFD 喂养 12 周后,发现HDCA 和P. distasonis并没有显着改善这些小鼠的脂肪肝表型。在原代肝细胞上使用 FGF19 和 PPARα 激动剂来模拟肠-肝轴对 CYP7A1 的综合影响,发现与 PPARα 激动剂和低剂量 FGF19 共培养时,CYP7A1 受到抑制。PPARα 激动剂(Wy-14643 和 pemafibrate)处理原代肝细胞,察到 FXR 表达上调,用 pemafibrate 处理Pparα -/−小鼠的原代肝细胞,观察到 FXR 表达几乎没有变化,并且,单独使用 HDCA 不能直接上调肝脏 FXR 表达。这些结果表明肝脏 PPARα 可能被 γ-亚麻酸激活,进而激活肝脏 FXR。
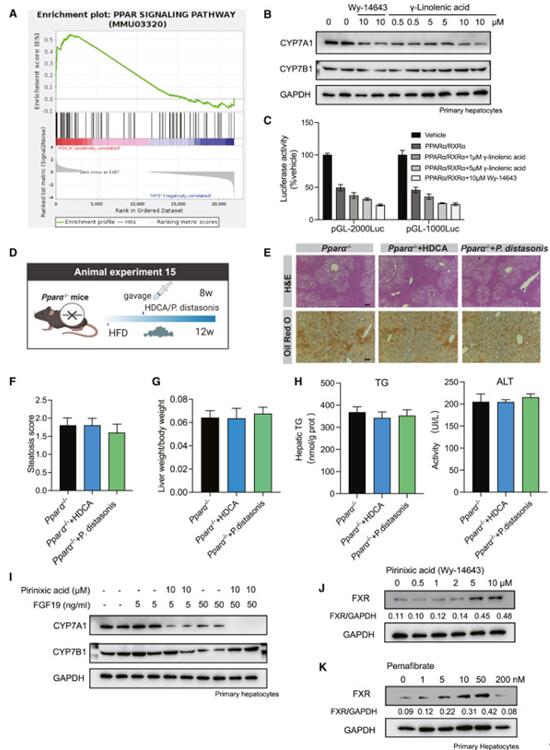
图5. 肠道微生物群产生的脂肪酸介导的 PPARα 激活抑制了 CYP7A1
综上所述,本研究的结果表明了HDCA 通过抑制肠道 FXR 激活以 CYP7B1 为中心的替代途径,并通过 P. distasonis -γ-亚麻酸 -PPARα 信号传导来抑制以 CYP7A1 为中心的经典通路,从而改变肝脏 BA 合成途径。这一研究发现或为NALFD药物研发提供了新思路。
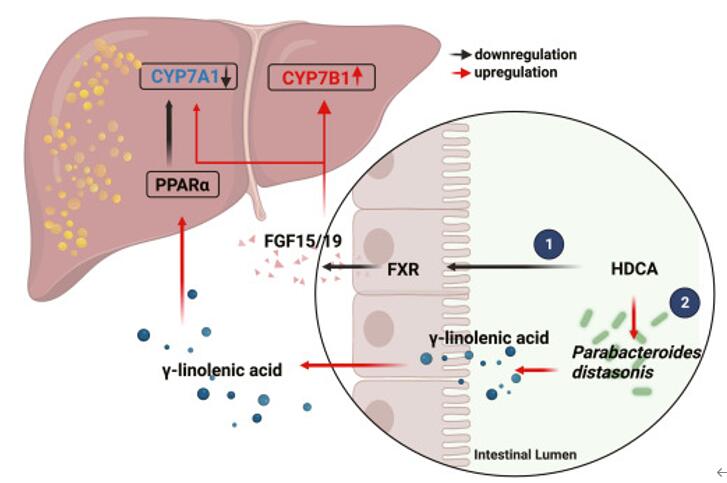
图6 HDCA改善肝脏脂肪变性的分子机制

查看更多

查看更多

查看更多

联系我们

返回顶部