查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
癌症基因组记录了正常细胞发育和癌变过程中 DNA 损伤和 DNA 修复缺陷引起的基因改变。BRCA1缺陷型(BRCA1d)和BRCA2缺陷型(BRCA2d)癌症的全基因组体细胞改变模式归因于HR的缺陷,HR是人类细胞修复双链断裂(DSB)的主要途径。其中一些突变模式可能反映了细胞在缺乏 HR 的情况下使用的特定易出错的 DSB 修复机制。这种突变模式可作为 HR 缺乏的生物标志物,并有助于识别临床相关的治疗缺陷。
2023年8月16日,发表在《Nature》杂志上的一篇题为“Long-molecule scars of backup DNA repair in BRCA1- and BRCA2-deficient cancers”的文章,揭示了BRCA1或BRCA2缺陷所特有的重排类别可能是HR缺陷细胞中细胞遗传畸变的来源。
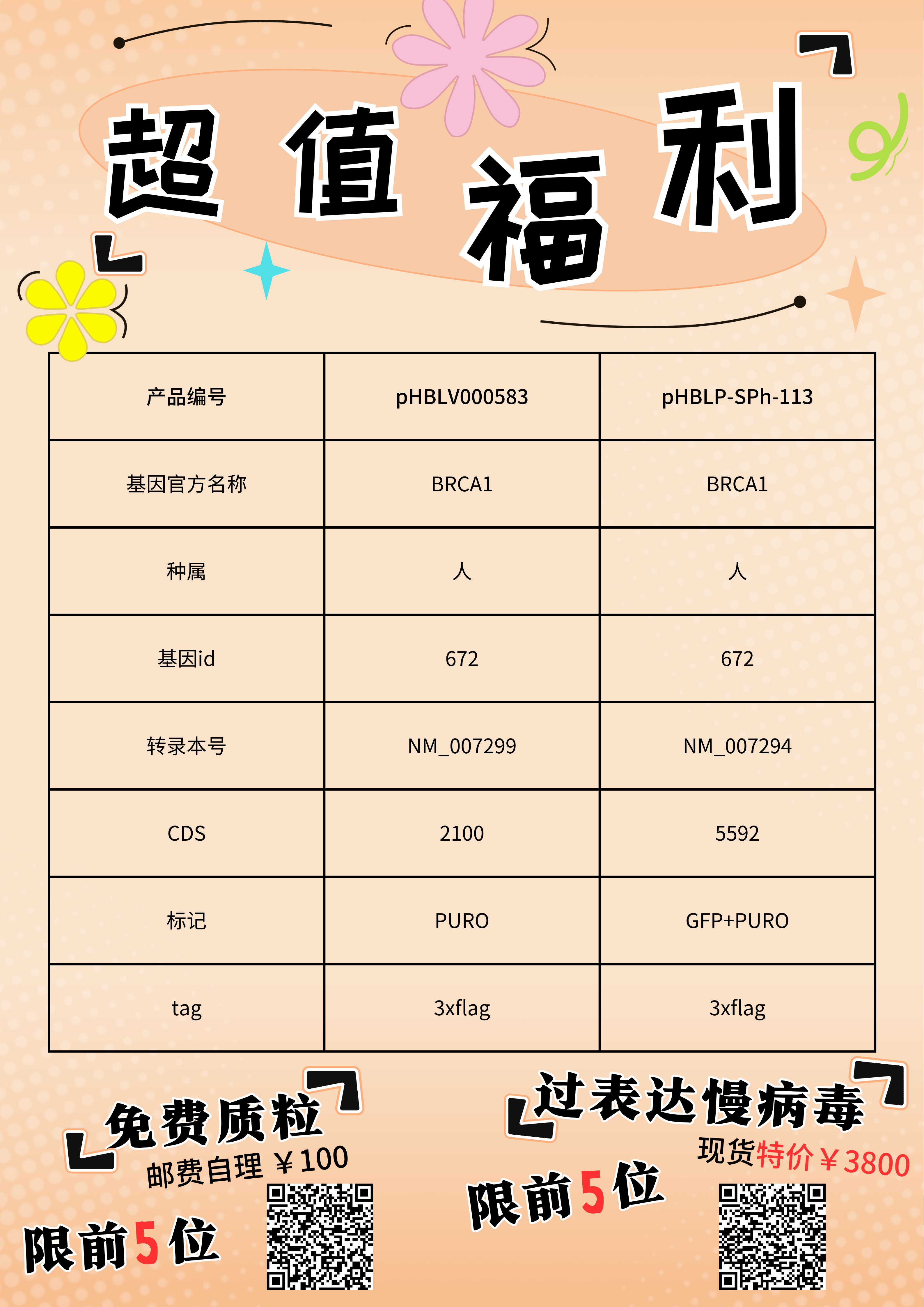
现汉恒有BRCA1相关基因产品,超值限量活动!
典型的互变重排(即平衡易位或倒位)不会导致遗传物质的丢失或增殖。许多重排,包括易位和倒位,断裂末端在基因组上靠近但不相邻。TICs和chromoplexies(平衡重排链)是近乎对等的复杂 SVs (structural variants,结构变异)的例子。近对等 SV 包含中间基因组区域的拷贝缺失或增益,被称之为空白区段。根据质量守恒,当断裂末端连接到间隙区段(+极性)时,拷贝数会增加;当断裂末端连接到侧翼区段(-极性)时,拷贝数会减少。对于(+)间隙区段,相同的基因座拓扑结构和拷贝数特征可能与易位或简单的模板插入同样一致,在易位或模板插入中,间隙区段被拷贝到远处的基因座上,而源基因座则未被拷贝。对相互对(reciprocal pairs)的间隙段长度和极性进行可视化后,发现了三种不同的亚模式,它们是 BRCA1 缺乏症和/或 BRCA2 缺乏症所特有的。首先,在 BRCA1d 肿瘤中,具有两个 100-bp-100-kbp (+) 极性间隙片段的互变对富集,被称之为互变重复(rDups)。其次,在 BRCA2d 肿瘤中,具有两个 1-bp-10-kbp (-) 缺口片段的互变对富集,被称之为互变缺失(rDels)。第三种情况是,在 BRCA1d 和 BRCA2d 病例中,由 1-bp-100-kbp 的极性相反(+)和(-)的间隙片段组成的互补对富集,被称之为互补缺失重复(rDelDups)。对单个互变配对位点的检测证实,这些相互对发生在基因组区域,而这些区域在 1-Mbp 范围内并不包含其他重排。在验证数据集中分析这些模式证实,rDups、rDels 和 rDelDups 分别在 BRCA1、BRCA2 和 HR 缺陷中富集。
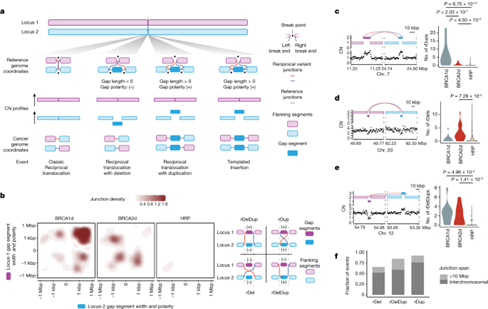
图1. 在 BRCA1d 和 BRCA2d 肿瘤中富集了相互对(reciprocal pairs)
接下来,为了评估相互对是否可能导致 HRD 癌症中的大规模重排,作者推断了它们的衍生染色体结构,即相位。这些分析的具体目标是根据 LR WGS 配对模式区分顺式(复制粘贴、模板插入)结果和反式(平衡易位或倒位)结果。在对基因定相进行基准测试后,作者分析了 LR WGS 数据中的相互对。对 BRCA1d 样本中的 94 个 rDups 进行相位分析后发现,顺式相位占绝大多数(67/94;71%),每一个结果都是在远处基因座的串联重复间隙片段之间复制和粘贴一个间隙片段。例如,给定 ABC 和 DEF 这两个基因座,就会产生一个 ABEBC 单倍型,其中包含串联的变异 BE 和 EB 连接,而另一个 DEF 单倍型则未进行排列。其余 29% 的基因座包含反式结构,其中 BE 和 EB 连接点位于不相连(染色体间 rDups)或相距较远(染色体内 rDups)的重排等位基因上。在这些结果中,两个不同的衍生等位基因 ABEF 和 DEBC 共享重复的 B 和 E 段。这包括平衡易位,在交界处有多达约 20 kbp 的重复序列。同样,使用 LR WGS 对 37 例 HRD(22 例 BRCA1d,14 例 BRCA2d,1 例 BRCA1d 和 BRCA2d)中的 46 个 rDelDups 进行了分期。与 rDups 一样,在不同的基因位点上发现了顺式和反式相位,尽管在 BRCA1d 肿瘤中反式相位占优势,比例约为 2:1,而在 BRCA2d 肿瘤中顺式相位占优势,比例约为 4:1。就 ABC 和 DEF 基因座而言,顺式 rDelDups 包括 "剪切、复制和粘贴 "的结果,即在一个衍生的 AEC 等位基因上用一个额外的 E 拷贝取代了 B 拷贝,而一个未排列的 DEF 基因座包含了另一个 E 拷贝;相比之下,反式基因座显示相同(1-241 kbp)的 E 片段在两个不同的 DEC 和 AEF 衍生基因座上重复。最后,短读数预测 BRCA2d 肿瘤特异性 rDels 会产生严格的反式结果,LR WGS 证实了这一点。这些结果表明,反式相互对在 rDups、rDels 和 rDelDups 中很常见,是 BRCA1d 和 BRCA2d 肿瘤中大规模重排的来源。

图2. LR WGS 揭示了类似相互对拓扑的顺式和反式相位
鉴于顺式和反式相互对的染色体结果不同,作者寻找能在短读 WGS 中区分这些位点的特征,从而能在更大的数据集中研究相互对的相位。对顺式 rDups 的相位结构进行深入分析和可视化后发现,短(50 bp-1 kbp)E 段主要以 ABEBC 结构交错于长(1-300 kbp)B 段的两个拷贝之间。然而,在 ABEF 和 DEBC 单倍型中,反式 rDups 由一对较长(1 kbp-300 kbp)的 B 和 E 片段组成。将这些 LR WGS 相位顺式和反式位点与来自短读数 WGS BOPP 数据集的非相位数据绘制成图,以每对中较长的间隙段长度为方向(y 轴),发现了两个不同的 rDup 群。第一个 "长-短 "rDup 群涉及较长(1-100 kbp)和较短(10 bp-1 kbp)间隙片段的连接,完全由顺式事件组成。相比之下,反式 rDups 完全包含在第二个 "长-长 "群中。发现类似的长度差异可以区分顺式和反式 rDelDups。这些长度差异使得在短读数 WGS 中以合理的精度推算相互对相位成为可能。由于反式相互对可能产生长程 SV(例如平衡易位和倒位),预测反式事件(而非顺式事件)的染色体方向会受到限制。具体来说,反式相互对可能出现在两种中心粒定向之一:第一种(I 型)定向只产生单中心染色体,而第二种(II 型)定向产生一个或多个异中心衍生物。由于无着丝粒 DNA 片段容易在随后的细胞分裂中丢失,因此无着丝粒片段上的连接点会优先丢失,而剩余的连接点不会被检测为相互对。这将导致反式相互对的 I 型偏倚。相反,由于模板插入不会改变染色体中心粒的剂量,因此顺式基因座应该与 I 型和 II 型取向无关。事实上,当分析 LR WGS 的分期数据时,发现反式基因座对 I 型和 II 型的偏倚超过 9:1,而顺式基因座同样有可能处于 I 型或 II 型方向(P = 3.9 × 10-6,几率比(OR)= 8.57,费雪精确检验)。接下来,作者分析了短读数 WGS BOPP 数据集中的无相位相互对,根据大小和方向推算顺式和反式相位。结果发现这些数据具有相同的偏倚方向(P = 1.4 × 10-4,OR = 1.96),尽管这些数据仅有归因相位。特别是,这些分析表明,染色体内反式相互对产生的巨碱基规模倒位同样受到中心粒剂量的限制。反式相互对预测会出现的间期和端粒缺失的大小分布反映了在HRD癌症中发现的间期和端粒LOH的分布。这些结果共同表明,反式相互对具有大规模染色体后果,因此可能与细胞遗传学上可见的畸变有关,而这些畸变通常与 BRCA1 和 BRCA2 失活有关。
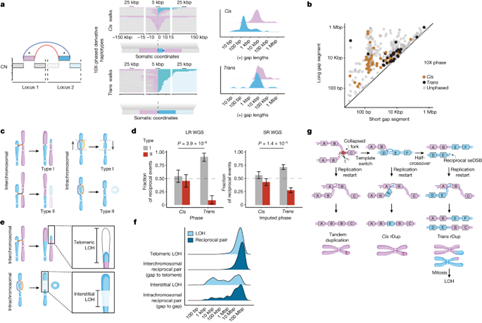
图3. 异常复制-重启模型将反式相互对与巨碱基规模的染色体改变联系起来
鉴于LR WGS 数据,作者认为可以利用长分子图谱检测 HR 缺失特异性修复途径的其他疤痕。单链退火(SSA)是一种DSB修复途径,涉及DSB侧翼近似同源(同源)重复序列的杂交。HR 缺乏的实验模型系统显示,SSA 在 BRCA2d 癌症中是活跃的,但在 BRCA1d 癌症中并不活跃。在切除断裂末端深处退火相似序列时,SSA 能允许低至 80% 的序列同一性;然而,以前对 HR 缺乏症的基因组研究只分析了精确的微同源性,而没有检查不精确的序列同一性。为了更好地评估 LR WGS 图谱中的 SSA ,作者开发并验证了一种算法,用于检测体细胞断裂末端附近的同源运行或 80% 或更高的序列同一性。该算法确定了 50 bp 左右的同源峰值,在 46 个 LR WGS 样本中发现了 138 个同源度大于 10 bp 的连接点。值得注意的是,这些同源连接大多也能在短读程 WGS 中高效检测到,这表明同源分析可应用于完整的短读程 WGS BOPP 数据集。对 583 对肿瘤-正常人配对(BRCA1d、BRCA2d 或 HRP)的分析表明,49,561 个连接点中有 1,248 个(2.5%)是同源的,其分布情况与 LR WGS 相似。虽然这些连接的同源长度中位数为 40 bp,但观察到的连接束长达 128 bp。接下来,作者研究了哪些类别的简单或复杂变异包含同源连接。比较不同基因型的分布发现,相对于 BRCA1d(RR = 3.93,P = 4.2 × 10-4,伽马-泊松回归的 Wald 检验)和 HRP 癌症(RR = 3.28,P = 8.37 × 10-6,伽马-泊松回归的 Wald 检验),BRCA2d 癌症中较大(超过 1 kbp)同源缺失的负担和比例明显更高。尽管在其他 SV 类中也观察到了同源断裂末端,但这些事件的负担与 HR 缺陷状态无关。值得注意的是,同源缺失的中位大小与已知发生在 BRCA2d 细胞中的末端切除长度一致31,32,支持 SSA 在人类 BRCA2d 肿瘤中作为后备修复途径的作用。
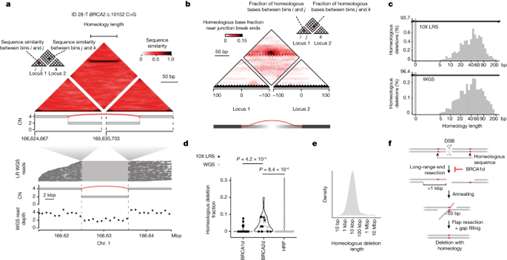
图4. LR WGS 在 BRCA2d 基因组中发现了 SSA 的足迹
最后,作者思考了仅根据断点级结构基因组特征预测HR缺陷的效果如何?为了评估这一点,作者比较了仅使用 HRDetect 中 SV 特征(RS3 和 RS5 标志)训练的随机森林分类器和使用 B1+2 特有的附加 SV 特征(同源缺失、互对和 1-100-kbp 简单重复)训练的随机森林分类器的性能。结果发现与基于 HRDetect 的 SV 分类器(AUROC = 0.73,AUPRC = 0.57)相比,基于 B1+2 的 SV 分类器(AUROC = 0.93,AUPRC = 0.57,泛癌 HMF)的性能要好得多(P < 2.2 × 10-16,DeLong 检验)。虽然某些 B1+2 分类器特有的 SV 特征单独使用时具有相关性,但当这些特征结合使用时,观察到的性能最高。接下来作者研究了 B1+2 是否能区分 BRCA1 和 BRCA2 缺乏症,这两种疾病是不同的生物状态,各自可能有不同的治疗缺点。由于 HRDetect 并非为解决这一任务而开发,将 B1+2 与根据 HRDetect 的六个特征训练的随机森林分类器进行了比较。结果发现 B1+2 在区分 BRCA1d 和 BRCA2d 肿瘤方面的表现(AUROC = 0.90,AUPRC = 0.91)大大优于这种类似 HRDetect 的分类器(AUROC = 0.80,AUPRC = 0.83)(P = 0.005,DeLong 检验)。B1+2 分类器特异性 SV 特征对于区分非 BOPP 癌症尤为重要。由于 B1+2 可分别输出 BRCA1d(B1 得分)和 BRCA2d(B2 得分)的概率,因此可以分析分类器称为 HR 缺乏的肿瘤(B1+2 阳性,B1 + B2 得分 > 0.5)中 BRCA1d 或 BRCA2d 的概率。这项分析证实,相对于乳腺癌和卵巢癌,前列腺癌和胰腺癌的 HR 缺失明显富集于 BRCA2d 表型,而在乳腺癌和卵巢癌中,BRCA1 和 BRCA2 缺失的可能性相同。HR缺陷基因组特征的一个主要用途是发现HR通路失活的替代机制,并评估意义不确定变体(VUS)的致病性。对训练和测试数据中排除的病例的 B1+2 评分分布进行了调查,结果发现在各层次的单拷贝和/或 VUS 病例中,B1+2 阳性率明显较高。尽管这一比例大大低于 BRCA1 或 BRCA2 双倍性致病性改变的病例(95%)。这包括对 BRCA1d(BARD1 和 EME1)和 BRCA2d(PALB2 和 RAD51C)具有不同偏倚的基因,这与它们在 HR 通路中的已知作用一致。这些结果表明,B1+2 分类器有助于发现和亚分类导致 HR 缺乏的致病等位基因。
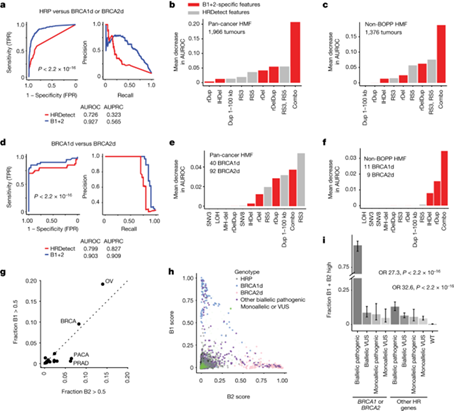
图5. 区别 BRCA1 和 BRCA2 缺乏症的 SV 特征
总之,本研究通过对数千例肿瘤的短线程全基因组测序(WGS)图谱的基因组图谱分析与对 46 例 BRCA1 或 BRCA2 突变乳腺癌的深度链读测序 WGS 分析相结合,发现了一类不同的HR缺陷富集重排,称为相互对,其是HR缺陷中的疤痕类型,而这些疤痕来自于两种备用的修复机制,可能促使HR缺陷的癌细胞存活,而阻断这一机制或许是治疗这些癌症的一种新方法。

查看更多

查看更多

查看更多

联系我们

返回顶部