查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
肾脏纤维化是慢性肾脏病(CKD)发展至终末期的最终结果,其主要特征包括肾小球硬化和小管间质纤维化。目前,CKD的治疗包括使用抗高血压药物,如血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂,以及采取其他血压控制措施,包括减少蛋白质和盐的摄入。除了透析和手术(即肾移植)外,似乎还没有有效的治疗肾纤维化和终末期肾病的方法。因此,治疗方法的创新是十分必要且重要的。
肠道微生物群与肾脏疾病的关联最近得到了重视,2022年10月3日,中国药科大学中医药学院张志浩作为通讯作者在Nature Communications(IF=17.694)发表了题为“The gut microbe Bacteroides fragilis ameliorates renal fibrosis in mice”的研究论文,该研究发现 脆弱拟杆菌(B.fragilis)通过降低LPS和提高1 , 5 - A G 水平改善肾纤维化,为开发脆弱拟杆菌治疗慢性肾病的潜力提供了必要的基础。值得注意的是,在本研究中,作者使用了汉恒提供的慢病毒成功构建了SLC5A2基因过表达HEK293细胞稳转株。
接下来让我们看看文章的研究结果:
作者先后从武汉大学人民医院和普陀人民医院各招募了一组CKD患者和一组年龄和性别匹配的健康对照,发现CKD患者中脆弱拟杆菌的相对丰度显著降低。此外,脆弱拟杆菌的丰度与BUN和Scr呈显著负相关。因此,作者将重点放在脆弱拟杆菌上,以研究该物种与CKD之间的关系。
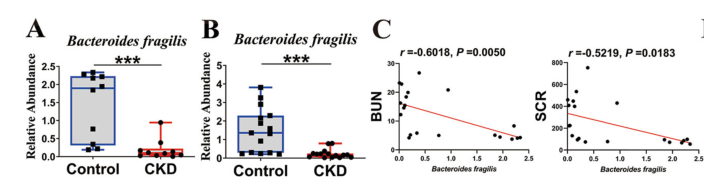
图1慢性肾脏病(CKD)人群中的脆弱拟杆菌丰度
接着作者使用肾纤维化UUO小鼠模型,完成了一项口服活的非热杀的脆弱拟杆菌实验,发现脆弱拟杆菌治疗显著改善了其肾脏形态并降低了肾脏指数。免疫荧光显示,波形蛋白的表达明显减少,E-Cadherin的表达明显增加。Masson染色显示,肾小管扩张、肾小管萎缩和间质间隙变宽,严重炎性细胞浸润减弱。这些发现共同表明,通过口服灌胃补充活的脆弱拟杆菌能够改善UUO小鼠的肾脏纤维化。
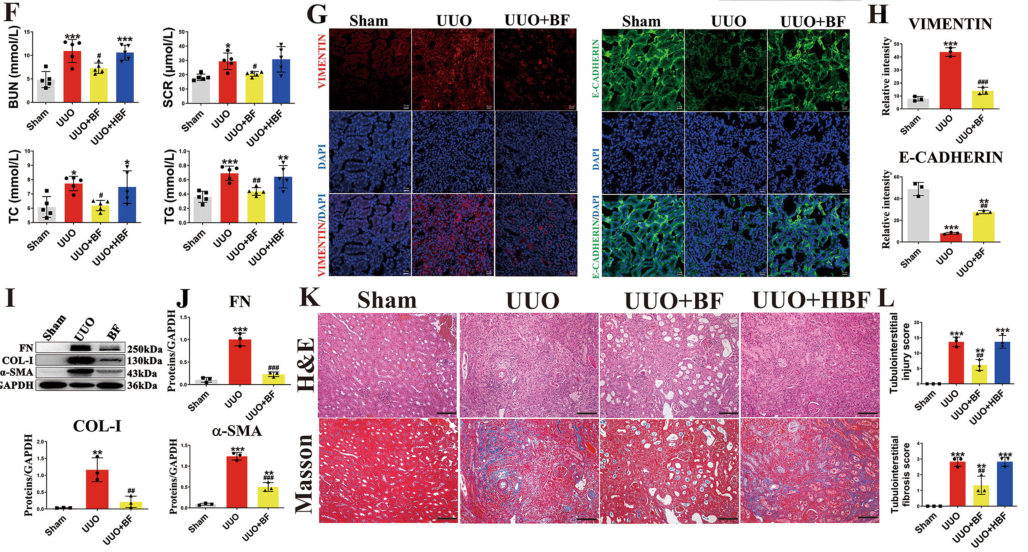
图2 脆弱拟杆菌能够改善UUO小鼠的肾脏纤维化
与正常小鼠相比,UUO小鼠中TGF-β、Smad2、Smad3的表达均显著增加,然而在脆弱拟杆菌治疗后TGF-β、Smad2和Smad3表达的显著减弱。还发现UUO导致Keap1和ROS生成分子(包括12 Lox和Rac1)显著增加。在脆弱拟杆菌治疗后,UUO小鼠中抗氧化蛋白(Nrf2)的表达显著下调。这些结果表明,脆弱拟杆菌通过抑制UUO模型中的氧化应激和TGF-β/Smad信号通路来减轻肾纤维化。

图3 脆弱拟杆菌通过抑制UUO模型中的氧化应激和TGF-β/Smad信号通路来减轻肾纤维化
有报道称CKD患者血清中的1,5-AG的水平呈现显著降低。为评估脆弱拟杆菌治疗后的代谢物变化,作者使用气相色谱-质谱(GC-MS)分析治疗前后UUO小鼠血清样品,发现用脆弱拟杆菌治疗可以显著上调UUO小鼠的血清1,5-AG水平。接着作者探究了1,5-AG在UUO小鼠中的肾保护作用,1,5-AG的给药显著改善了UUO小鼠的肾脏形态,降低了UUO小鼠的肾脏指数,并降低了几种促纤维化标志物的水平。此外,1,5-AG在UUO小鼠中激活Nrf2/Keap1并抑制TGF-β/Smad信号通路。这些结果表明脆弱拟杆菌通过上调1,5-AG水平来减轻肾纤维化。
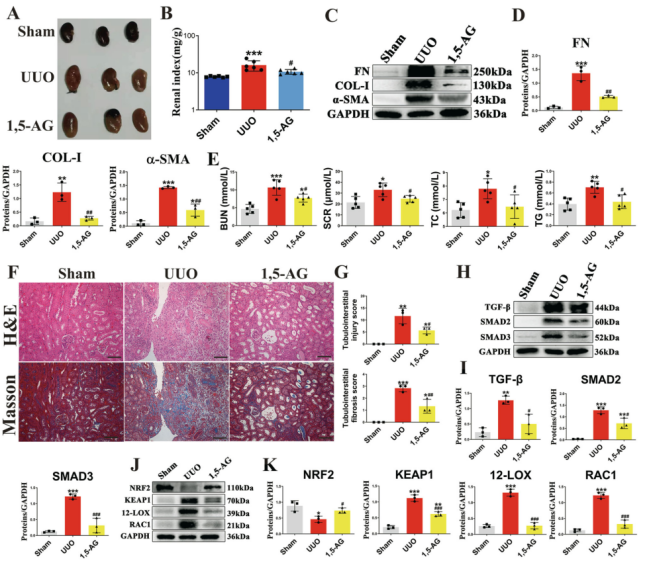
图4 1,5-AG减轻UUO模型中的肾纤维化
SGLT2 (SLC5A2)是一种表达于肾皮质的葡萄糖转运蛋白,主要负责从肾小球滤液中重新吸收葡萄糖,接下来,作者在稳定表达SGLT2的HEK293细胞与野生型(WT)细胞中进行1,5-AG的细胞摄取实验。发现在稳定表达SGLT2的HEK293细胞中1,5-AG的摄取量比WT细胞高1.7倍,这表明1,5-AG是SGLT2的底物,SGLT2负责1,5-AG的肾重吸收。
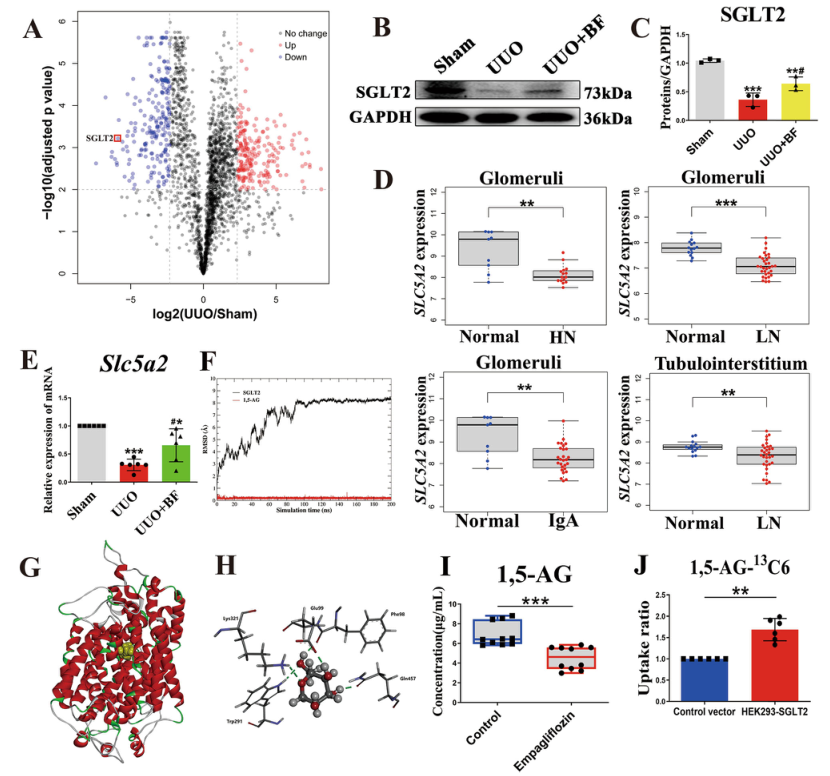
图5 SGLT2负责1,5-AG的肾重吸收
草药能够维持肠道菌群的稳态,作者评估了14种草药成分对脆弱拟杆菌的生长调节作用。发现madecasoside(Mad)促进了脆弱拟杆菌的生长,提高了脆弱拟杆菌的丰度,通过口服Mad可以改善肾脏形态和肾脏指数。这些结果表明,Mad以肠道微生物群依赖的方式保护小鼠免受肾纤维化。

图 6 Mad以肠道微生物群依赖的方式保护小鼠免受肾纤维化
在这项研究中,作者发现脆弱拟杆菌的减少是CKD患者的一个关键特征。此外,作者发现了未被认识的脆弱拟杆菌对CKD进展的作用,并进一步证明了脆弱拟杆菌通过上调CKD患者中1,5-AG水平来减轻肾纤维化。此外,通过体外筛选发现一种中药成分Madecassosid可促进脆弱芽孢杆菌生长,显著改善肾纤维化。综上所述,该研究说明了脆弱拟杆菌在肾纤维化恢复中的机制作用,并拓展了脆弱拟杆菌以及Madecassosid用于CKD治疗的前景。

查看更多

查看更多

查看更多

联系我们

返回顶部