查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息

目前,全世界有三分之一的人口超重,十分之一的人被列为肥胖。肥胖引起的慢性炎症加剧了多种类型的组织器官恶化和干细胞功能障碍。过去,肥胖被认为是骨密度的保护因素,但流行病学研究数据表明,尽管骨密度达到标准,肥胖仍会增加骨折风险。然而,肥胖对骨骼组织的影响及其潜在机制尚不清楚。
2024年7月4日,中南大学湘雅医院李长俊团队在Bioactive Materials(IF=18)在线发表题为“Macrophage-derived extracellular vesicles regulate skeletal stem progenitor Cell lineage fate and bone deterioration in obesity”的论文。研究发现肥胖小鼠骨髓巨噬细胞分泌的细胞外囊泡(bone marrow macrophage-secreted extracellular vesicles, BMM-EVs)诱导瘦小鼠骨质退化,相反,来自瘦小鼠的BMM-EVs减缓肥胖小鼠的骨质退化;进一步筛选得到肥胖BMM-EVs中差异表达的miR-140和miR-378a,通过靶向Pparα-Abca1轴协同调节骨干/祖细胞(skeletal stem/progenitor cell, SSPC)的成骨和成脂分化命运;最后利用特异性靶向SSPC的适配体-细胞外囊泡递送系统,挽救了肥胖小鼠的骨质退化。汉恒生物有幸为作者提供了用于构建条件性缺失小鼠模型的HBAAV2/2-F4/80-cre-ZsGreen、在SSPC细胞中过表达Pparα的慢病毒以及Pparα 3'UTR双荧光素酶质粒。下面,我们一起来了解具体的研究内容。

肥胖小鼠骨髓巨噬细胞来源的细胞外囊泡诱导瘦小鼠骨质退化
5周龄C57BL/6J雄性小鼠分别饲喂高脂饲料和正常鼠粮,喂养8周以产生肥胖小鼠和瘦小鼠,肥胖小鼠表现出骨质退化和SSPC向脂肪细胞分化的倾向。从以上小鼠中分离出BMM,通过超离心收集BMM-EVs,与亲本细胞相比,BMM-EVs中CD9、CD63和Tsg101富集,内质网特异性蛋白calnexin几乎未检测到,说明BMM-EVs成功分离。然后,以瘦小鼠为受体,通过尾静脉向受体小鼠注射瘦小鼠的BMM-EVs(瘦BMM-EVs)和肥胖小鼠的BMM-EVs(肥胖BMM-EVs),每周两次,每次100μg,为期两个月。Micro-CT和免疫组织化学染色分析显示,与瘦BMM-EVs处理组相比,肥胖BMM-EVs处理组的骨小梁质量更低,骨小梁表面骨钙素阳性的成骨细胞较少,骨髓中脂肪细胞数量较多;但骨表面破骨细胞数量无显著差异。接下来,作者又验证了肥胖BMM-EVs在调节SSPC命运中的作用,与瘦BMM-EVs相比,肥胖BMM-EVs抑制SSPC成骨分化和矿化,成骨相关基因(Alp, Runx2, Bgl和Sp7)的表达降低,钙结节减少;相反增强了成脂分化,成脂相关基因(Fabp4和Ppar-g)表达增加,脂滴密度增加。这些数据表明肥胖BMM-EVs促进骨质退化,抑制成骨,并促进SSPC的脂肪生成。
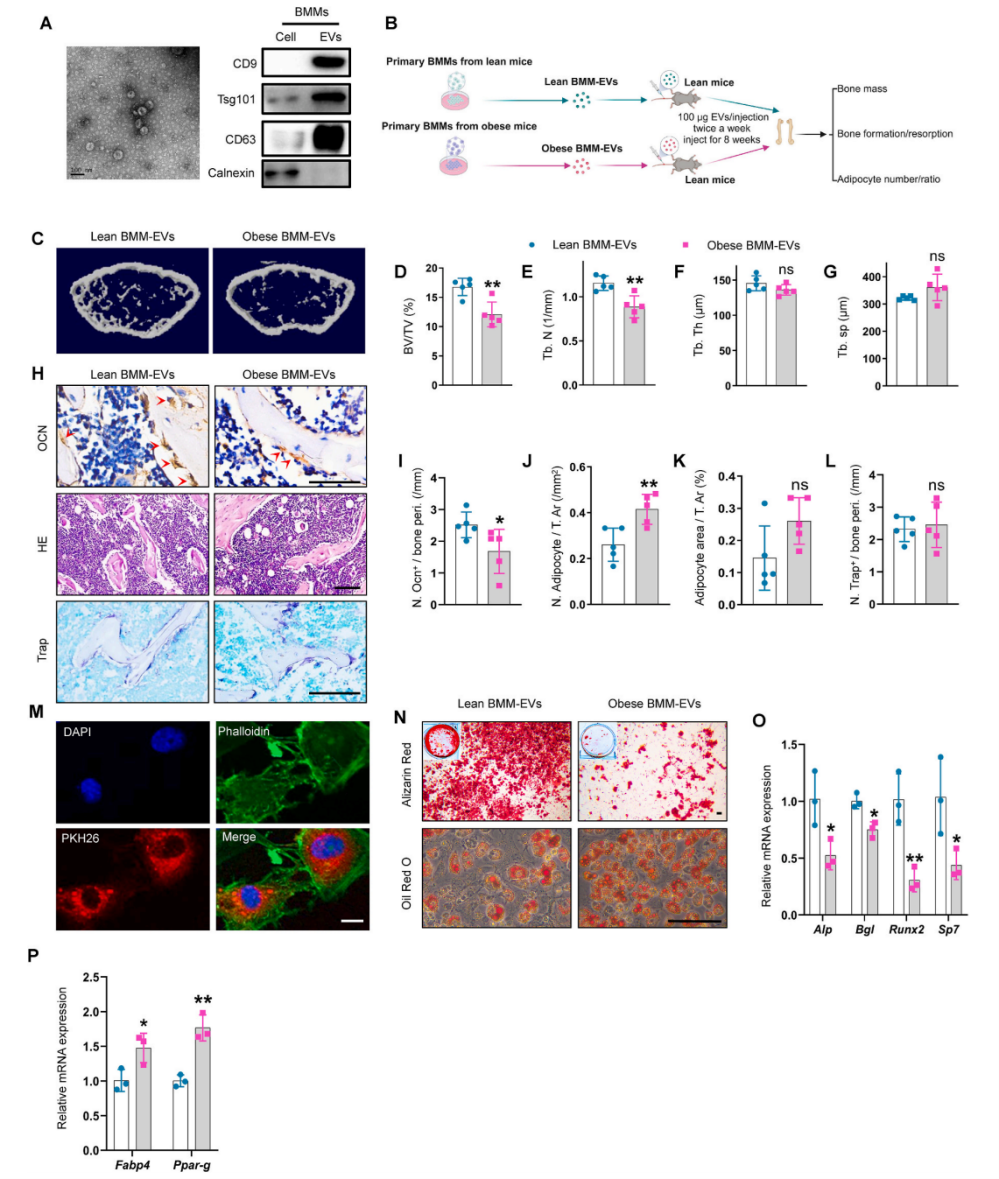
图1 肥胖BMM-EVs诱导瘦小鼠骨质退化
瘦BMM-EVs改善肥胖小鼠的骨质退化和骨髓脂肪堆积
考虑到肥胖BMM-EVs对骨稳态的负面影响,作者接下来评估了瘦BMM-EVs是否可以减轻肥胖小鼠的骨质退化。以肥胖小鼠作为受体,接受瘦BMM-EVs处理,两个月后,与对照PBS组相比,瘦BMM-EVs处理不影响骨小梁表面破骨细胞的数量,但瘦BMM-EVs组小鼠骨小梁质量增加,骨小梁表面有更多的成骨细胞,骨髓中的脂肪细胞积累较少。这说明瘦小鼠产生的BMM-EVs可以改善肥胖引起的骨质退化和骨髓脂肪积累。
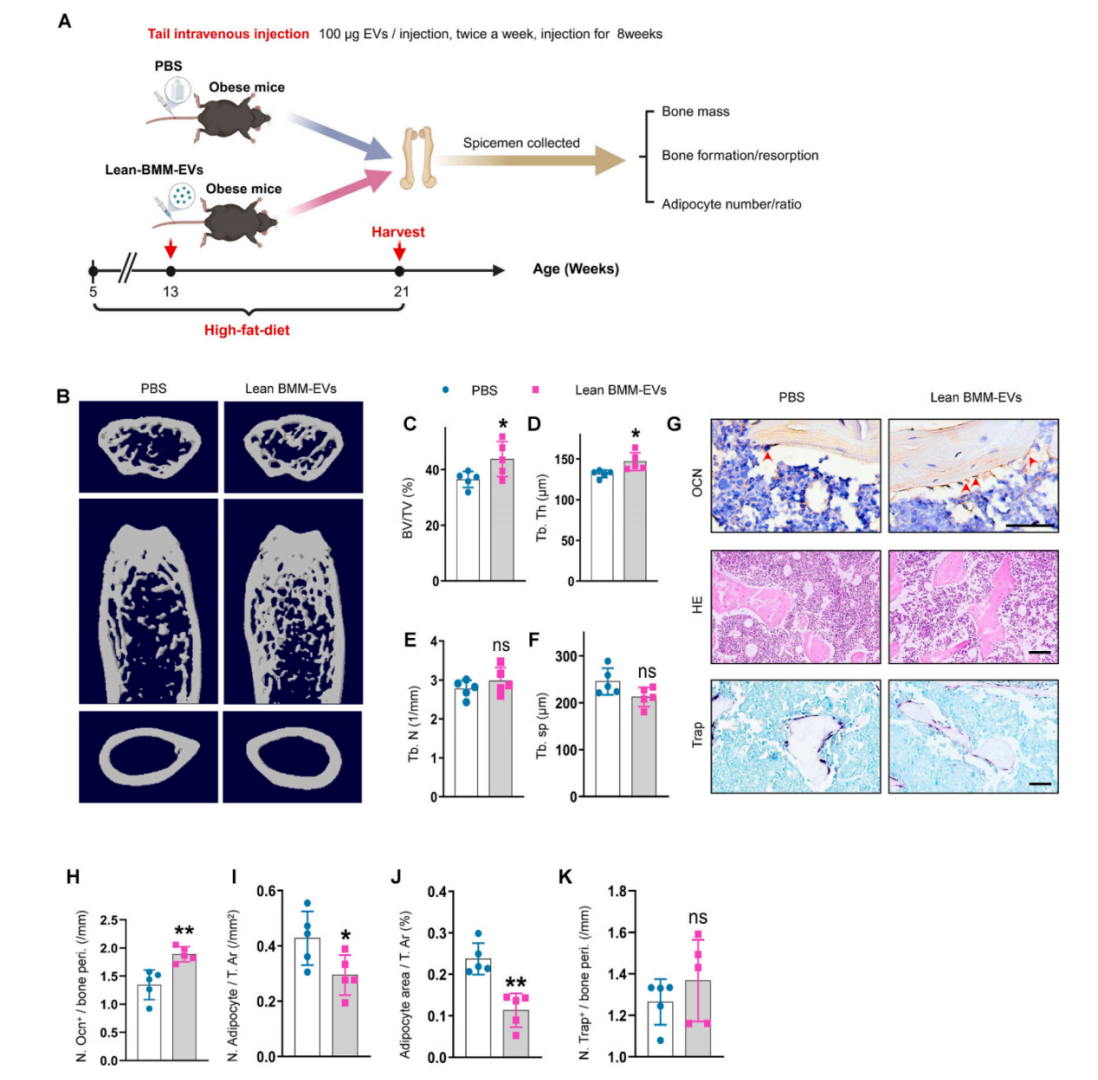
图2 瘦BMM-EVs改善肥胖小鼠的骨质退化和骨髓脂肪堆积
BMM-EVs microRNA-378a-3p和microRNA-140-5p协同调控SSPC谱系命运
对肥胖BMM-EVs和瘦BMM-EVs进行miRNA阵列分析,鉴定出1888个差异表达的miRNA,综合评估基础表达、显著差异、折叠变化、序列保守性和新颖性后,选择了在肥胖BMM-EVs中3个上调的miRNA (microRNA-1839-5p、microRNA-221-5p、microRNA- 140-5p)和3个下调miRNA (microRNA-378a-3p、microRNA-378c、microRNA-378d)进行进一步研究。首先在体外研究这6个miRNA对SSPC成骨和成脂分化的影响,三个上调的miRNA中,microRNA-140-5p(以下简称miR-140)抑制了成骨相关基因(Alp和Sp7)的表达,促进了脂肪相关基因(Fabp4)的表达;在三个下调的miRNA中,microRNA-378a-3p(以下简称miR-378a)促进了成骨相关基因(Alp和Sp7)的表达,抑制了脂肪相关基因(Fabp4和Ppar-g)的表达。据此推测BMM-EVs中miR-378a和miR-140可能协同调节肥胖小鼠SSPC谱系命运,所以作者选择miR-140和miR-378a进行后续分析。结果表示,miR-140抑制SSPC成骨分化和矿化,促进脂滴形成;miR-378a促进成骨,抑制脂肪形成。
为了确定BMM-EVs中的miR-140或miR-378a对调节SSPC谱系成骨和成脂分化的影响,作者将miR-140 mimic或miR-378a mimic转染到BMM中并分别收集富miR-140和miR-378a的BMM-EVs,发现用miR-140-BMM-EVs处理SSPC,SSPC表现出脂肪生成增强,成骨潜能受损;而miR-378a-BMM-EVs促进SSPC成骨分化并抑制脂肪分化。这些结果表明,BMM-EVs中miR-378a可以促进SPPC向成骨细胞分化,miR-140使SSPC倾向于向脂肪细胞分化,miR-378a的降低和miR-140的升高可能协同调节SSPC成骨和脂肪分化。
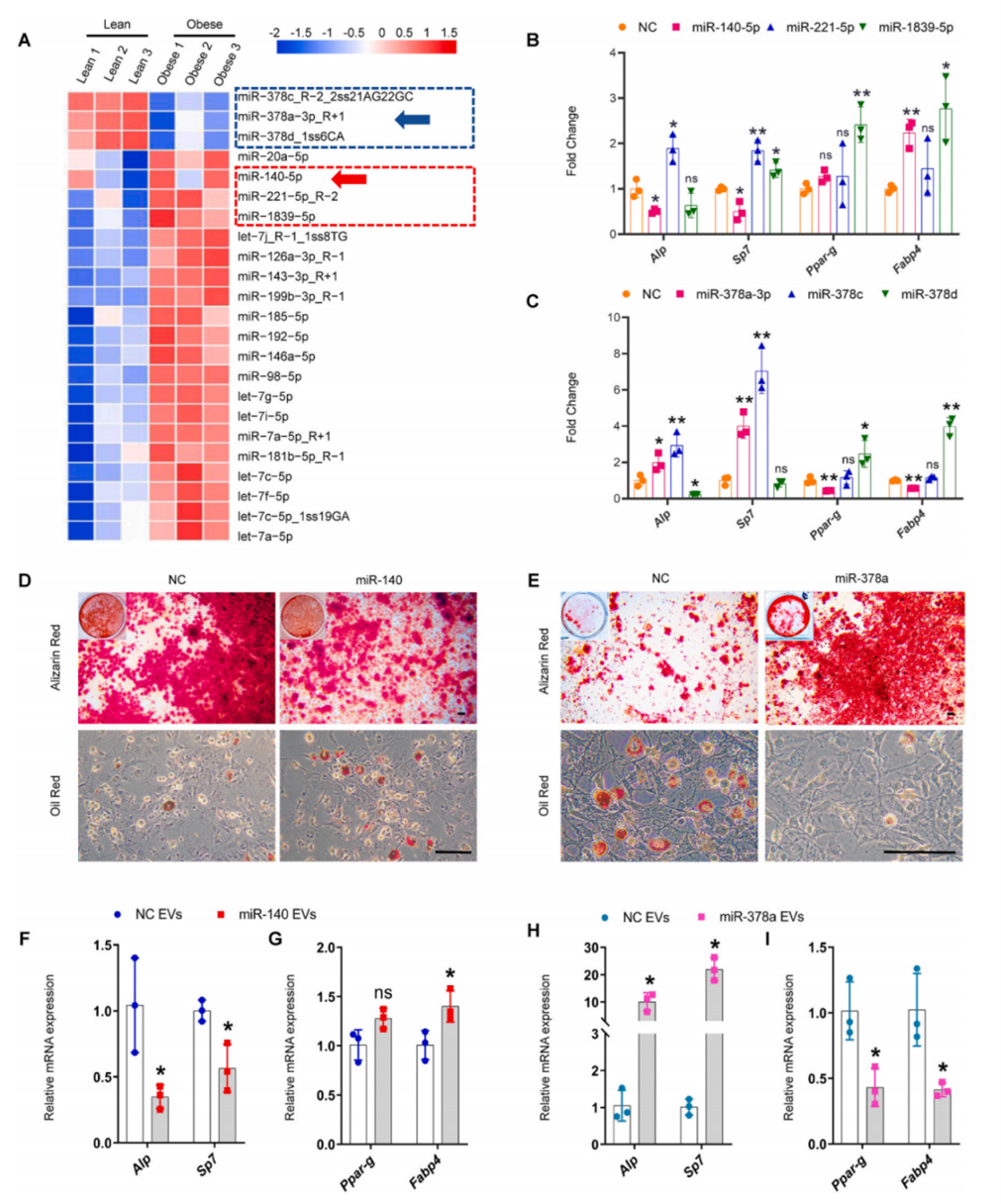
图3 miR-378a和miR-140协同调控SSPC谱系命运
BMM条件性敲除miR-140可减轻肥胖小鼠的骨质退化
鉴于肥胖BMM-EVs中miR-140促进SSPC脂肪生成,作者继续探究了miR-140缺失是否可以逆转肥胖小鼠的骨质退化和骨髓脂肪积累。为此构建了miR-140flox/flox小鼠,高脂喂养2个月后骨髓内注射HBAAV-F4/80-Cre-ZsGreen,继续高脂喂养2个月,以产生BMMs中miR-140条件性缺失的肥胖小鼠模型(miR-140BMM△)。结果显示,与对照miR-140BMM+/+小鼠相比,miR-140BMM△小鼠股骨的骨小梁体积和数量更大,骨小梁分离更少,骨小梁表面有更多的成骨细胞,骨髓中脂肪细胞的数量和面积更少。这些数据说明BMM中miR-140的减少或许可以减轻肥胖小鼠的骨质退化和骨髓脂肪积累。
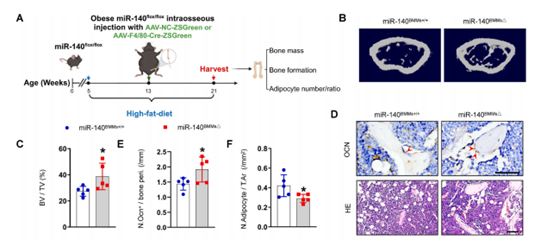
图4 敲除miR-140可减轻肥胖小鼠的骨质退化
SSPC条件性过表达miR-140的小鼠表现出骨量减少和骨髓脂肪积累
为了进一步测试miR-140对SSPC的直接影响,通过杂交构建了SSPC特异性过表达miR-140的小鼠模型(miR-140SSPC-OE)。收集miR-140SSPC-OE和miR-140 TGflox/flox(对照)小鼠的股骨进行Micro-CT分析和骨切片染色,与miR-140 TGflox/flox小鼠相比,miR-140SSPC-OE小鼠的骨小梁体积、数量和皮质骨厚度均较低,骨髓脂肪积累更多。这表明过表达miR-140可以诱导SSPC向脂肪细胞分化,从而导致小鼠骨量减少和骨髓脂肪积累。
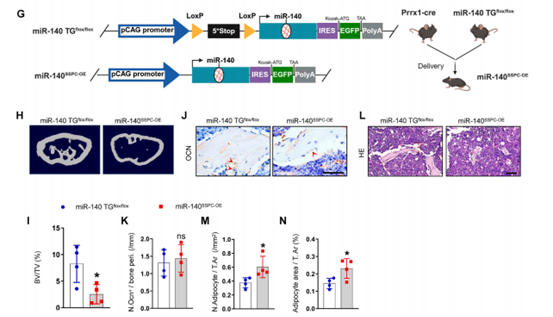
图5 过表达miR-140导致骨量减少和骨髓脂肪积累
BMM条件性敲除miR-378a的瘦小鼠表现出骨量减少和骨髓脂肪积累
在验证了miR-140对肥胖诱导的骨质退化的影响后,作者又研究了miR-378a对骨的影响。使用相同的策略构建了BMM条件性缺失miR-378a的小鼠模型(miR-378aBMM△),结果显示,与对照miR-378aBMM+/+小鼠相比,miR-378aBMM△小鼠股骨的骨小梁骨量更少,骨小梁分离更大,骨表面成骨细胞较少,骨髓中脂肪细胞较多。这些结果表明BMM来源的miR-378a的缺失导致骨量降低和骨髓脂肪积累,类似于肥胖引起的骨质退化。
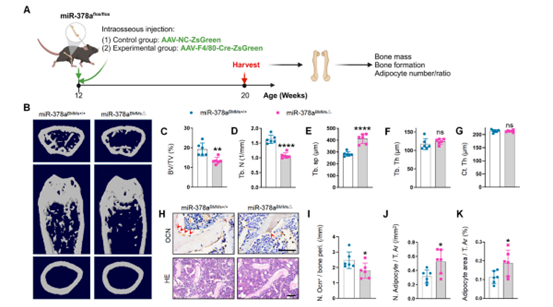
图6 敲除miR-378a导致骨量降低和骨髓脂肪积累
miR-378a过表达增加肥胖小鼠骨量
结合上述实验结果,作者进一步测试了miR-378a对肥胖性骨质退化的治疗作用。在肥胖小鼠骨髓内注射AAV-miR-378a-3p-EGFP以实现过表达miR-378a,发现用过表达miR-378a的小鼠的骨小梁体积和数量明显大于对照组,并且骨小梁表面的成骨细胞数量增加,骨髓中脂滴的数量和面积减少。这说明miR-378a治疗可减轻肥胖小鼠的骨质退化。
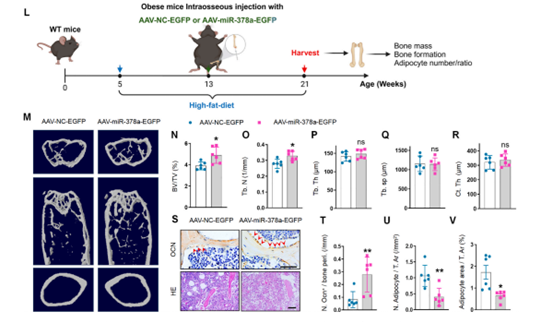
图7 miR-378a过表达增加肥胖小鼠骨量
miR-378a和miR-140通过靶向Pparα-Abca1轴协同调节SSPC谱系命运
根据前面的数据,作者推测miR-378a和miR-140协同影响SSPC谱系命运。利用TargetScan、miRanda、miRDB和miRWalk等多种靶标预测工具预测miR-378a的靶基因,结果得到miR-378a的69个靶基因,最终选择了几个与成骨和脂肪形成相关的基因,包括Pparα、Gata4、p38和Bmp4做进一步验证。结果显示,SSPC细胞转染miR-378a mimic可引起Pparα蛋白水平降低,但Gata4、p38和Bmp4蛋白水平没有变化;而转染miR-378a inhibitor的SSPC细胞中Pparα的蛋白水平显著升高。根据碱基互补配对原理,miR-378a可能靶向Pparα 3'UTR的4629-4635位碱基,并荧光素酶检测结果证实了miR-378a与Pparα的3'UTR的结合作用。利用慢病毒在SSPC细胞中过表达Pparα,可导致SSPC成骨分化受到抑制,脂肪分化被促进。这些结果表明,miR-378a可能通过靶向Pparα调控SSPC的成骨细胞和脂肪细胞分化命运。
接下来又测试了miR-140是否可以直接靶向Pparα,结果表示转染miR-140不影响Pparα的蛋白水平变化,推测miR-140可能调控与Pparα相互作用的靶基因。使用TargetScan和STRING数据库分析参与Pparα信号通路的miR-140靶基因,在候选基因中,Ppargc-1α(Pgc-1α)和Abca1被报道参与调节成骨和脂肪形成,并且Abca1是成骨的正调节因子,是Pparα信号通路的下游分子,受Pparα负调控,于是选择它们进行进一步研究。与对照组相比,转染miR-140降低了SSPC中Abca1的蛋白水平,但不降低Pgc-1α的蛋白水平,表明miR-140可能通过靶向Pparα信号通路下游分子Abca1来抑制成骨。
为了进一步测试miR-378a和miR-140是否协同影响SSPC谱系命运,作者将miR-378a mimic和miR-140 inhibitor共转染到SSPC中,并进行成骨诱导。与单独使用miR-378a mimic或miR-140 inhibitor处理的SSPC相比,使用miR-378a mimic和miR-140 inhibitor共同处理的SSPC中Alp的表达更高。综合以上数据表明miR-378a和miR-140通过靶向Pparα-Abca1轴协同调节SSPC谱系命运。
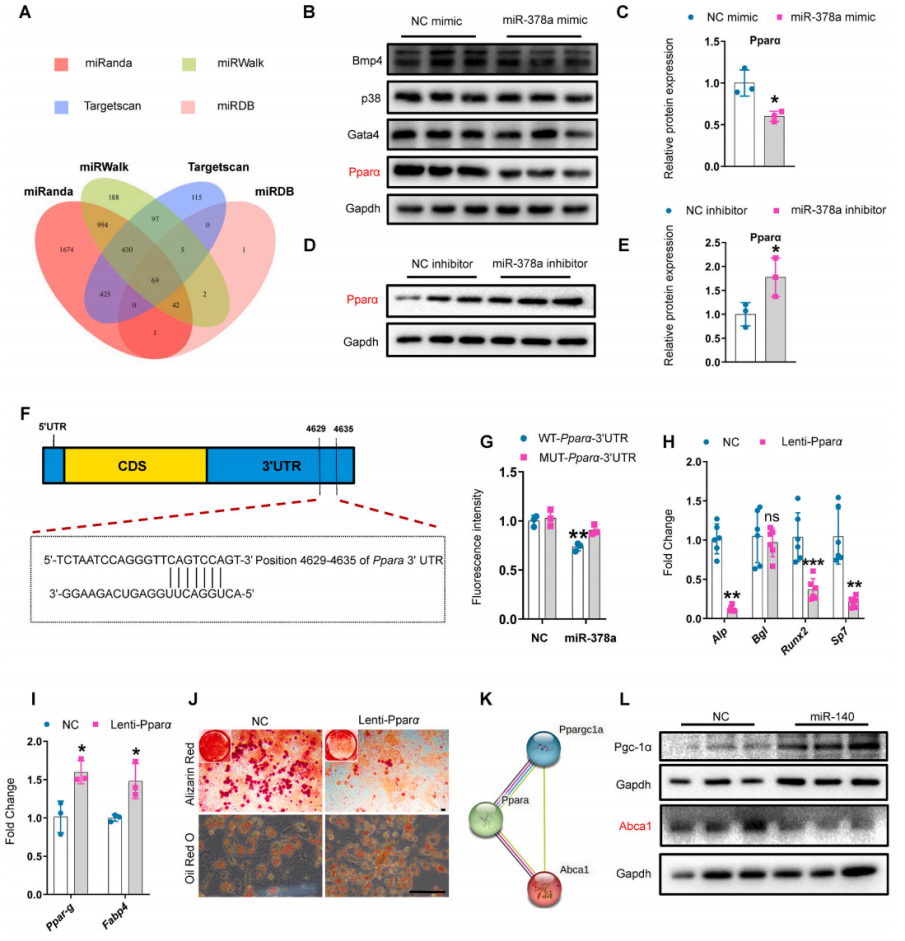
图8 miR-378a和miR-140通过靶向Pparα-Abca1轴协同调节SSPC谱系命运
SSPC适配体共轭过表达miR-378a的细胞外囊泡减轻肥胖小鼠的骨质流失
上述结果已经表明过表达miR-378a可以减轻肥胖小鼠骨髓脂肪堆积,这促使作者探索治疗肥胖诱导的骨质退化的临床转化策略。首先,通过尾静脉注射一种对SSPC具有高亲和力的适配体共轭BMM-EV (BMM-EV-Apt),相比BMM-EVs对照组,BMM-EV-Apt在体内能更有效的靶向骨。然后构建了过表达miR-378a的适配体共轭BMM-EV (miR-378a-EV-Apt)来精确靶向体内SSPC,将miR-378a-EV-Apt尾静脉注射到肥胖小鼠。与对照组(NC-EV-Apt)相比,接受miR-378a-EV-Apt治疗的肥胖小鼠的骨小梁体积和数量更高,骨小梁分离更少,骨表面的成骨细胞数量更多,骨髓中的脂肪细胞数量更少。这些结果表明,通过细胞外囊泡传递系统过表达miR-378a可能是治疗肥胖引起的骨质退化和骨髓脂肪堆积的精确方法,并可能改善临床肥胖和超重患者的骨质量。
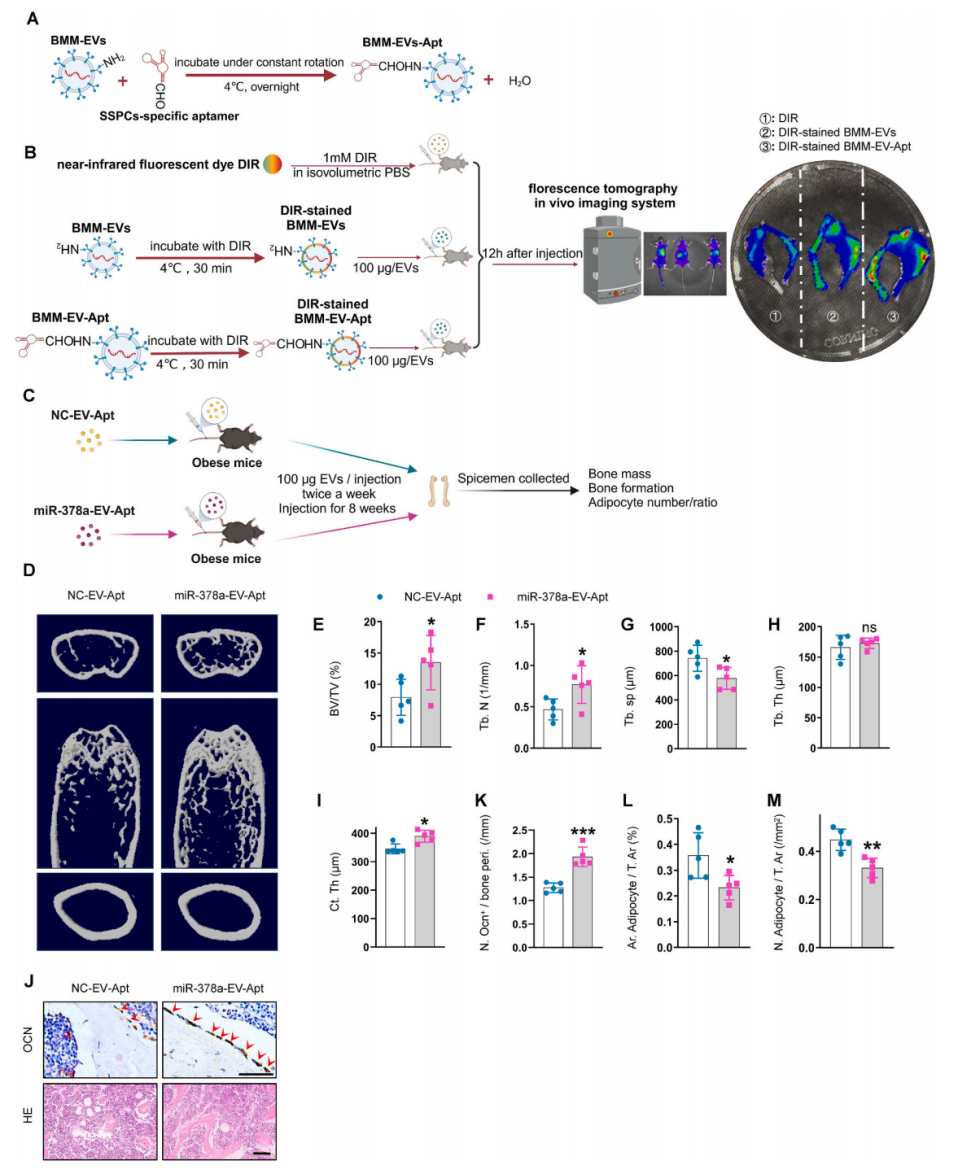
图9 miR-378a-EV-Apt减轻肥胖小鼠的骨质流失
本研究发现了肥胖BMM-EVs和瘦BMM-EVs中差异表达的miR-140和miR-378a通过Pparα-Abca1轴协同调节SSPC的成骨和成脂分化命运,这与肥胖导致的骨质退化有关。更重要的是,通过使用SSPC特异性靶向适配体共轭的细胞外囊泡递送系统,将过表达miR-378a的BMM-EV精确递送到SSPC,减轻了肥胖小鼠的骨质流失,这为肥胖诱导的骨质退化提供了一种新的治疗策略。

查看更多

查看更多

查看更多

联系我们

返回顶部