查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一个主题中,我们从原理、应用、实验流程及常见问题几个方面详细了解了染色质免疫共沉淀(chromatin immunoprecipitation,Ch-IP)技术,本期我们继续为大家带来分子互作免疫沉淀相关实验——免疫共沉淀(Co-Immunoprecipitation,Co-IP)的实验指南和常见问题解析。

众所周知,蛋白质控制着细胞中的所有生物系统,包括基因表达、细胞生长、增殖、营养吸收、形态、运动、细胞间通讯和细胞凋亡,虽然许多蛋白质独立执行其功能,但绝大多数蛋白质需要通过与其他蛋白质相互作用以获得相关的生物活性、或介导某些信号传导[1]。
Co-IP是一项广泛使用的蛋白质互作研究工具,其通过使用诱饵蛋白特异性抗体间接捕获与特定靶蛋白结合的蛋白质,来识别蛋白质-蛋白质相互作用。在捕获蛋白复合物后可通过对富集的蛋白质复合物进行分析,以确定潜在结合伴侣蛋白质的结合亲和力、结合动力学和功能。这项技术巧妙地利用了特异性抗体的特性,将目标锁定在目标蛋白质上,从而捕捉复杂的相互作用关系网络。
一、免疫共沉淀原理概述
作为免疫沉淀(immunoprecipitation,IP)的拓展技术,Co-IP同样基于IP技术的抗体-抗原反应捕获和纯化抗原的原理。Co-IP实验中,研究者感兴趣的、预先选定的蛋白质称为诱饵蛋白,与之相互作用的蛋白则称为靶蛋白,靶蛋白可能是一些复杂的伴侣蛋白、信号分子、结构蛋白、辅助因子等。
其基本原理为:生理条件下裂解的细胞保留了原有蛋白质与蛋白质之间的相互作用,运用磁珠固定的抗体特异性识别诱饵蛋白并形成免疫复合物,将免疫复合物捕获或沉淀于磁珠上并洗去未沉淀的非特异性蛋白质,随后分离收集沉淀的复合物,洗脱蛋白质复合物并进一步分析鉴定,以确定其组成和功能[2]。若要研究细胞内蛋白A和蛋白B之间是否存在相互作用,可将已知的目的蛋白A作为诱饵蛋白,用蛋白A的特异性抗体对蛋白A进行免疫沉淀,如果蛋白A和B之间存在相互作用,那么B也会随之沉淀下来。随后,采用western blot检测沉淀中是否含有蛋白B,如果能检测到,说明蛋白A和B之间存在相互作用;反之则不存在相互作用。
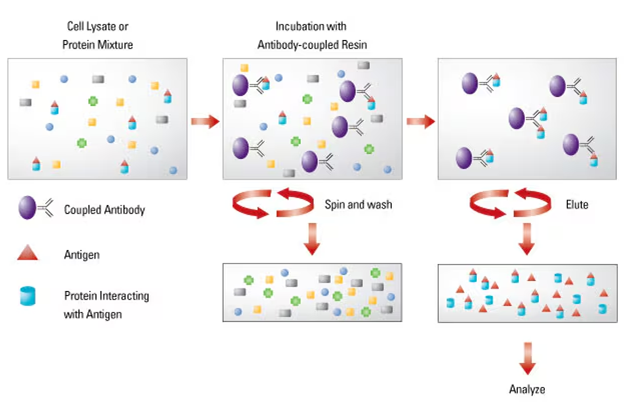
图1 标准免疫共沉淀测定的示意图(ThermoFisher)
二、应用场景
Co-IP被广泛应用于蛋白-蛋白相互作用领域,且其可与多种技术联合应用,也可合并一些实验方法进行多方面探索,其常应用于一下方面:
1. 蛋白质复合物分析与鉴定
Co-IP通常用于分析和鉴定蛋白质复合物,使用质谱等技术分析并鉴定复合物中的各个组分或翻译后修饰(PTM)。这有助于了解蛋白复合物的组成和成分,以及PTM在蛋白质-蛋白质相互作用、信号通路,深入了解它们在细胞过程中的功能和作用[3]。
2. 绘制蛋白质-蛋白质相互作用网络
通过使用不同的诱饵蛋白系统地进行Co-IP实验,可以建立一个全面的蛋白质相互作用网络,来揭示细胞信号通路、蛋白质复合物和调控网络[4]。
3. 蛋白质相互作用的验证
通过免疫沉淀靶蛋白确认其与特定结合伴侣的相互作用,验证从其他蛋白质相互作用筛选技术(例如酵母双杂交测定或蛋白质微阵列)获得的结果。
4. 研究动态蛋白质相互作用
通过在不同时间点或响应特定刺激进行Co-IP实验,深入了解蛋白质相互作用的时间调控、调控强度、丰度和化学计量的变化,这种动态分析可以更深入地了解蛋白质复合物组装、分解和响应各种细胞信号。
5. 药物靶点筛选和治疗开发
通过靶向参与疾病通路的特定蛋白质,研究人员可以使用Co-IP来识别可能作为药物干预潜在靶标的相互作用伙伴。此外,Co-IP还可用于通过检测潜在候选药物对相关复合物内蛋白质相互作用产生的变化来评估其疗效。
三、实验流程
Co-IP方案与传统IP方案非常相似,不同之处在于Co-IP需要更温和的检测条件来维持与结合伙伴的相互作用。接下来以protein A/G琼脂糖珠法为例,介绍基本实验流程:
1、样本制备:离心收集细胞后,加入适量预冷的非变性细胞裂解缓冲液和蛋白酶抑制剂,冰上静置15-30min,充分裂解细胞,4℃离心后取上清;
2、诱饵蛋白抗体孵育:取少量细胞裂解的上清以备Western blot分析,其余的上清液加入相应蛋白的抗体(适用于IP),置于4℃摇床孵育过夜。
3、沉淀免疫复合物:将一定量预处理过的protein A/G琼脂糖珠加入经抗体孵育的裂解液,继续于4℃摇床孵育2-4h或过夜,离心后弃上清,保留沉淀,并将沉淀洗涤3次。最后加入适量loading buffer煮5-10min。
4、蛋白检测:处理好样本后即可用于SDS-PAGE、western blot或质谱分析。
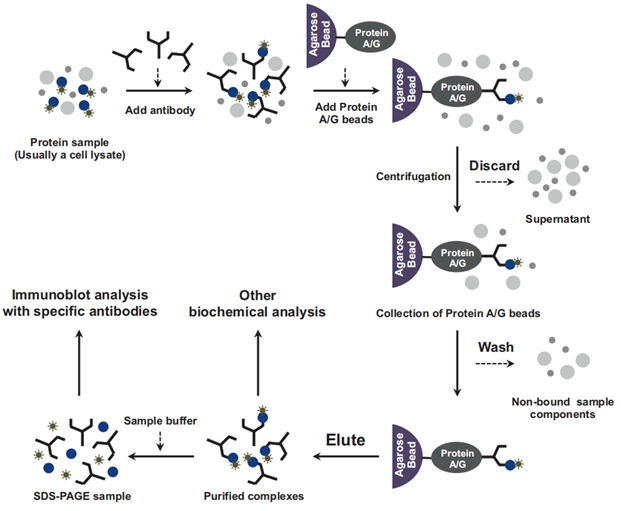
图2 co-IP实验流程示意图[1]
四、结果分析
(1)下面是Co-IP实验结果示例图(非实际条带,仅供参考):

图3 Co-IP结果示例图(A代表protein A和B存在相互作用,B代表protein A和B之间不存在相互作用)
对结果进行分析之前,还需要了解图中注释的具体含义:
由上图中可以看到,蛋白A带有Flag标签,蛋白B带有Myc标签,该实验为利用标签蛋白来沉淀和检测目的蛋白;该Co-IP实验样本分为三组,第一组仅存在protein A-Flag蛋白,第二组仅存在protein B-Myc蛋白,第三组同时存在protein A-Flag和protein B-Myc蛋白(实验组);图中共有三组胶图,分别是Input组,IP组,以及Co-IP组。
IP:即指免疫沉淀,用相应的抗体来纯化富集目的蛋白,例如图中“IP: Flag”意为使用Flag标签抗体磁珠下拉Flag,与Flag融合表达的蛋白为诱饵蛋白,与该融合蛋白相互作用的其他蛋白将因此被沉淀下来。
IB:即指免疫印迹或western blot(WB),用来检测目的蛋白的存在与否,例如图中“IB: Myc”是指用Myc抗体做WB检测,看样本中是否存在Myc标记的蛋白;值得注意的是,抗体应使用兼容IP实验的。
Iuput:指阳性对照组,是IP前制备蛋白样本时预留下的部分样品,进行WB实验确认目的蛋白存在,以排除假阳性结果的干扰。
(2)实验结果图分析:
了解结果图图注的含义后,即可根据图1 A和图1B分析protein A和protein B的相互作用情况。
① 图3中的Input组为对细胞裂解液的蛋白样本进行WB检测,分别采用标签蛋白Flag和Myc抗体验证蛋白样本中是否存在目的蛋白。图3A和3B的Input结果表示两种目的蛋白在样本中均可被检测到。
② IP组使用含Flag抗体的磁珠进行免疫沉淀,将得到的沉淀复合物进行WB检测,判断protein A和protein B是否存在相互作用。图3A的IP组结果显示,在第三组沉淀复合物样本中Myc和Flag均可被检测到,表明protein A和protein B之间存在相互作用;图1B IP组的第三组样本中只有Flag,而未检测到Myc,代表protein A和protein B之间不存在相互作用。
五、常见问题
1. 如何选择合适的抗体进行免疫共沉淀?
选择抗体时应优先考虑其特异性以及在IP条件下的结合效率。理想的抗体应为针对靶蛋白的单克隆抗体,具有高亲和力且特异性好,尽量避免与非特异性蛋白交叉反应。推荐先通过文献查阅或咨询供应商,选择已证实可用于Co-IP实验的抗体;如果无相关的抗体特异性数据,应先使用缺乏诱饵蛋白的细胞总蛋白作为阴性对照进行沉淀以确定该抗体无法沉淀任何非特异性蛋白,使用含有诱饵蛋白的蛋白溶液作为阳性对照确定该抗体可沉淀目的蛋白。此外,某些高质量抗体也可能出现非特异性结合,应使用与目标抗体相同亚类的非靶标抗体进行Co-IP来确认免疫沉淀蛋白复合物是否为所寻找的特异性复合物。
2. 如何优化操作流程以保护蛋白质复合体?
应使用非变性裂解缓冲液,其中应包含温和的非离子型去垢剂(如NP-40或Triton X-100),避免使用强烈的变性剂如SDS;裂解液中应加入蛋白酶和磷酸酶抑制剂以防止蛋白降解和去磷酸化;应避免在洗涤步骤中通过超声处理、涡旋裂解细胞,以防止破坏靶复合物的蛋白质-蛋白质相互作用;另外,可通过共价交联结合伴侣的方式加强蛋白-蛋白互作。
3. 如何设置有效的对照实验?
对于抗体的非特异性结合,应设置阴性对照(使用非特异性IgG抗体+蛋白的裂解液);对于磁珠与蛋白非特异性结合,应设置磁珠阴性对照(使用只含蛋白的裂解液);对于IP抗体和靶蛋白的非特异性结合,可设置阴性对照(使用IP抗体+靶蛋白的裂解液);对于IP抗体和其他蛋白的非特异性结合,可设置阴性对照(使用IP抗体+不含诱饵蛋白的裂解液)。此外,还应设置阳性对照(使用已知与目标蛋白相互作用的蛋白)、抗体对照组(使用无蛋白的裂解液),以及输入对照(Input,不含其他成分的裂解液),以验证实验特异性和有效性。
4. 如何减少抗体污染?
Co-IP方法最常遇到的问题之一是样品中共洗脱的抗体重链和轻链(大小分别约为50 kDa和25kDa)可能影响结果,应尽量消除抗体的干扰,使SDS-PAGE凝胶上仅存在共沉淀的蛋白。可以优化固定抗体方式来减少抗体污染:抗体与固定在磁珠上的抗体结合蛋白质(如蛋白A/G)交联、或直接共价结合到处理过的磁珠;使用融合标签(如HA标签)的靶蛋白表达系统,与预固定化的抗融合标签抗体进行蛋白质复合物纯化。
5. 如何提高洗脱效率?
优化洗脱缓冲液的组成,如增加洗脱剂浓度;适当延长洗脱时间;温和搅拌而非剧烈振荡以避免破坏蛋白复合体;使用TrueBlot等减少抗体链干扰的试剂。
6. 如何优化实验条件以应对较弱或不稳定的互作蛋白信号?
过高浓度的去垢剂可能破坏蛋白-蛋白相互作用,盐浓度、pH值以及还原剂和螯合剂的使用可能影响蛋白的稳定性,可调整细胞裂解液的配方和去垢剂的种类浓度;使用已知具有高特异性和亲和力的抗体,调整抗体浓度;抗体链信号可能掩盖目标蛋白信号,可通过降低抗体使用量、使用针对特定物种的轻/重链抗体进行阻断或选择性洗脱来减少抗体轻/重链污染;保证在提取过程中的洗涤缓冲液严格度具有相应的差异[5],洗涤步骤足够温和,避免洗脱掉目的蛋白或其结合蛋白;增强Western Blot的灵敏度,比如使用高灵敏度的ECL底物,优化转移、封闭条件等;增加细胞或组织的起始量,以提高目的蛋白的回收率。
7. Co-IP得到的阳性结果是否可以证明蛋白—蛋白的直接互相作用?
Co-IP不仅只检测蛋白—蛋白直接相互作用,也可以检测到蛋白质之间的间接相互作用;此外,在制备全细胞裂解物的过程中,也可能人工诱导生理上不相关的相互作用(例如,核蛋白与细胞质蛋白的结合)。因此需要通过其他实验,如纯化蛋白质的GST-pull down、FRET和/或BiFC等,辅助验证Co-IP中所得到的阳性结果[6]。
8. 如何减少非特异性相互作用的背景信号?
一般可通过增加洗涤次数和强度,彻底洗涤微珠结合的免疫复合物来破坏非特异性相互作用;改变盐浓度(120 mM到1000 mM)来改变IP洗涤缓冲液的离子强度;优化抗体浓度,使信噪比达到最大值;进行样品预纯化,将裂解物与免疫沉淀的相同成分一起孵育,减少裂解液中杂质(如:如果使用蛋白A/G或琼脂糖微珠,此方法可非特异性结合IP成分,同时从裂解物中去除非特异性免疫复合物);采用更纯净的抗体。
六、参考文献:
[1] Lo Sardo F. Co-immunoprecipitation (Co-Ip) in mammalian cells[M]//Polycomb Group Proteins: Methods and Protocols. New York, NY: Springer US, 2023: 67-77.
[2] Lin, Jer-Sheng, and Erh-Min Lai. "Protein–protein interactions: co-immunoprecipitation." Bacterial protein secretion systems: Methods and protocols (2017): 211-219.
[3] Jia, Jianlei, et al. "Eukaryotic expression, Co-IP and MS identify BMPR-1B protein–protein interaction network." Biological Research 53 (2020): 1-13.
[4] Kuzmanov U, Emili A. Protein-protein interaction networks: probing disease mechanisms using model systems[J]. Genome medicine, 2013, 5: 1-12.
[5] Husain, Afzal, et al. "Native Co-immunoprecipitation assay to identify interacting partners of chromatin-associated proteins in mammalian cells." Bio-protocol 10.23 (2020): e3837-e3837.
[6] Takahashi Y. Co-immunoprecipitation from transfected cells[J]. Protein-Protein Interactions: Methods and Applications, 2015: 381-389.

查看更多

查看更多

查看更多

联系我们

返回顶部