查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
稳转建系,是很多基因功能研究绕不过的实验。之前为大家介绍了构建稳定细胞株的方法与流程,今天再来详细盘点一下慢病毒构建稳定细胞株药物筛选细节。常见稳转株的两种筛选方式:流式分选和抗性药物筛选。流式分选依赖流式细胞仪,所以药筛是不少实验萌新的首要选择。然而,在勤勤恳恳选好转染工具,好不容易得到较好转染效率的阳性细胞后,因为后面的药筛细节不到位,导致结果差强人意的不在少数。到底是哪里出了问题呢?汉恒为大家整理了一篇详细的药筛Protocal,供大家参考。

1、常用的药筛抗生素种类及溶解保存:
嘌呤霉素(Puromycin);新霉素/G418(Neomycin);杀稻瘟菌素(Blasticidin);潮霉素B(HygromycinB);博来霉素(Zeocin/bleomycin)。
①以水为溶剂的抗生素贮存液应使用0.22um滤器过滤除菌;②用乙醇溶解的抗生素溶液无须过滤除菌;③所有抗生素贮液都应避光保存;④抗生素配置完成后,都需要分装成小份,方便取用,避免反复冻融。
2、杀死曲线(kill curve)建立
抗生素的有效筛选浓度与细胞类型、生长状态、细胞密度、细胞代谢情况及细胞所处周期等有关,确定抗生素杀死未转染细胞的最低工作浓度至关重要。下面以嘌呤霉素为例:
Day1:准备24孔板,铺板目的细胞,第二天细胞汇合度应在50%~60%;
Day2:加入不同浓度梯度的嘌呤霉素,同时设置不加嘌呤霉素的对照组细胞,分别设置3个平行,排除其余干扰因素。具体梯度设置可以参考相关文献,或直接设置几个梯度,如:0.5、1.0、2.0、4.0、6.0、8.0、10.0μg/mL;
Day3-4:每隔一天更换含嘌呤霉素的培养基,嘌呤霉素的筛选至少需要48 h(一般能杀死90%以上的细胞),有效浓度嘌呤霉素的筛选周期一般在2~10天。/p>
制作杀死曲线,选取48h内可杀死90%细胞的最低浓度作为后续稳转株筛选工作浓度。
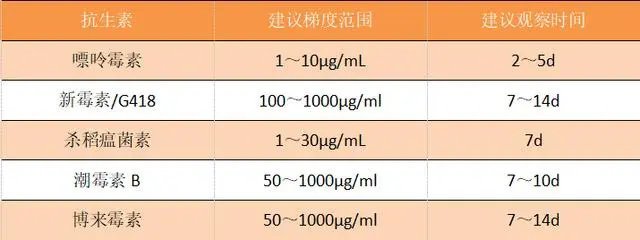
3、稳转株筛选
Day1:细胞转染携带抗性基因的质粒/病毒48-72h后,在细胞汇合度在60%~70%时(细胞太密可先行传代,等待细胞贴壁再继续后面的筛选),在培养基中加入上述确定的工作浓度抗生素,同时设置空白细胞对照组(未转染质粒或病毒等);
Day2-3:筛选至少48h,当空细胞加抗生素组死亡率>90%,将含药筛抗生素培养基撤换为新鲜完全培养基,此时实验组剩下的基本可以认为是阳性细胞;
Day4~:对筛选的阳性细胞进行继续筛选和扩增(隔代加药维持阳性细胞率,维持浓度为工作浓度的一半,或根据空白细胞生长速度及细胞状态调整),进行细胞保种与复检。
至此即得到了混合克隆稳转株。
本次分享到此结束,如有更多问题欢迎随时咨询!汉恒生物可订购多种用于药筛的高质量抗生素,同时可为您提供包括质粒、病毒在内的各种抗性及标记的基因调控载体以及稳转株一站式构建服务,欢迎咨询。

查看更多

查看更多

查看更多

联系我们

返回顶部