查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
慢病毒(Lentivirus)是逆转录病毒的一种,能够将靶基因导入细胞,并且将靶基因随机整合到宿主的基因组中,适用于几乎所以细胞系,能够在细胞系中稳定表达,还可以进行稳转细胞株的筛选。
慢病毒虽好,但是对于新手小白来说,仍有很多需要注意的问题,为了解答大家的疑惑,小恒整理了一些慢病毒感染细胞时的常见问题,希望能够帮助各位小伙伴顺利实验,少走弯路。
感染慢病毒前的细胞准备:
首先感染前确保细胞未收到污染。感染时的细胞密度过高或者过低都会影响感染效率,根据细胞增殖的速度调整细胞接种量,以保证在感染后3天左右细胞刚好快长满培养皿底部为宜。
针对大部分细胞系:传代周期在2~3天,感染时细胞铺板的密度保持在30~50%左右
针对某些原代细胞:由于细胞增长缓慢,可以在接种时提高汇合度到70~80%左右
针对非分裂细胞:如神经元细胞,接种后不再增殖,此时可以按照100%的汇合度进行接种。
感染前预实验摸索MOI:
MOI(MultiplicityofInfection,感染复数)是指每个细胞感染的病毒数,通常MOI越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。
举个例子,取MOI=3、10、30、100,根据操作说明,将换算好体积的病毒液加入细胞中。
每孔加病毒量(µl)=MOI*细胞数/滴度(TU/ml)×1000
*可在【汉恒生物】微信公众号使用病毒体积计算器进行计算
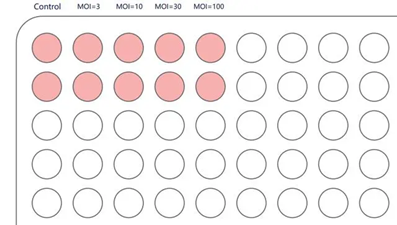
感染3-4天后,观察荧光表达情况,通过细胞感染效果,确认目的细胞的感染条件和感染参数。
病毒感染细胞以后,细胞形态发生改变或者细胞死亡?
首先,确定细胞或病毒是否有污染;其次,确定病毒感染MOI值是否过高,调整MOI值,并在感染后的4 h、8 h和12 h对细胞进行观察,若发现细胞状态变差时,则需要使用新鲜的完全培养液替换病毒感染培养液;排除以上因素后细胞状态仍然不好,尝试增加血清含量,观察细胞状态是否好转。
如何提高病毒对细胞的感染效率?
病毒对细胞的感染效率受多个因素影响,如病毒活性、细胞自身的状态、MOI值、感染时间等。
(1)首先在病毒感染前,需要确保细胞状态良好。
(2)病毒需要避免反复冻融,解冻病毒需要在冰上进行。另外如果病毒保存超过半年需要重新测定滴度。
(3)建议您进行MOI梯度摸索实验,找出最优的MOI进行感染,在感染时可以使用汉恒生物推荐的1/2小体积感染法(详见病毒操作手册)。
(4)感染时间也至关重要,换液时间太早或太晚都会对感染效果产生影响,请您根据病毒操作手册,确定好病毒换液时间(慢病毒一般24h换液,腺病毒一般6-8h换液)。
(5)可以加入polybrene助转染试剂,增加感染效率。
(6)对于悬浮细胞可以通过平角离心感染法来增加感染效率,即加入病毒液后,放入平角离心机低速(200xg)离心1h;对于极难感染的细胞,可采用多次感染的方法。
为什么过表达的病毒感染后观察荧光比对照要暗?
基因的插入会影响位于其下游的荧光蛋白等基因的表达。对照病毒或干扰病毒,由于没有插入基因或者插入基因非常短,荧光通常较强。而插入了较长基因之后,荧光的亮度会随着插入基因的长度以及特殊结构的存在等而减弱,尤其是出现高GC\片段,由于影响了转录,荧光强度会大大降低。
siRNA干扰效果好,但包装成干扰病毒后下调效果不理想?
对于干扰的病毒,是将shRNA构建到病毒载体。siRNA和shRNA在结构上并不一样,siRNA为化学合成,使用浓度一般为5uM,浓度较高,在细胞转染效率尚可情况下,瞬时进入细胞中的分子数超过10^8,且不需要经过剪切加工就可和靶点结合。
shRNA则是将干扰基因克隆到DNA上,经过病毒整合(慢病毒)或非整合(腺病毒/腺相关病毒)进入到细胞后,转录形成发夹RNA,在经过一系列酶的剪切加工,才形成可以和靶点结合的干扰RNA。这个过程中因为拷贝数低,转录加工过程复杂,会导致干扰效果不理想。

查看更多

查看更多

查看更多

联系我们

返回顶部