查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
在全球110个国家中,乳腺癌是癌症相关死亡的主要原因,其中TNBC(三阴性乳腺癌)由于缺少有效的治疗靶点,目前仍依赖化疗,最广泛使用的细胞毒性药物是蒽环类药物和紫杉醇类药物,如果出现化疗耐药性,控制癌症的进展就会变得非常困难。肝转移是乳腺癌死亡的主要原因之一,有研究表明,乳腺癌肝转移的5年总生存率为8.5%,然而,其分子机制目前尚不清楚。

2024年2月,中山大学肿瘤中心唐海林教授带领的研究团队在期刊《Drug Resistance Updates》(IF=24.3)上发表题为“Methylation of GPRC5A promotes liver metastasis and docetaxel resistance through activating mTOR signaling pathway in triple negative breast cancer”的研究论文。作者发现GPRC5A在TNBC中表达上调,且与不良预后相关。机制上,METTL3/YTHDF1轴通过m6A甲基化上调GPRC5A的表达,GPRC5A通过向溶酶体募集mTORC1激活mTORC1/p70s6k信号通路,从而促进多西他赛耐药和肝转移。在本研究中,作者使用了汉恒生物提供的GPRC5A过表达慢病毒构建SUM159PT和MDA-MB-231稳转株,进行体内异种移植肿瘤等实验,以研究GPRC5A的作用机制。接下来,我们一起来看看作者的研究结果:
1.GPRC5A过表达与乳腺癌转移及化疗耐药有关
首先,作者对3例乳腺癌患者的肝转移标本进行了scRNA-seq检测,并结合癌症基因组图谱数据库(TCGA)分析结果,发现CDH1、HES1和GPRC5A三个基因在乳腺癌组织中表达量较高,且与不良预后显著相关(图1A-C)。乳腺癌远端转移患者出现化疗耐药是一个普遍现象,3名患者中有1名曾接受过多西他赛(紫杉醇类药物)治疗,因此作者认为在乳腺癌肝转移过程中可能出现了耐药性。通过对接受化疗的乳腺癌患者的GSE25065数据集进行生物信息学分析,作者发现病理学完全缓解组(pCR,即经治疗后,样本中恶性肿瘤细胞完全消失)中GPRC5A的表达明显低于残留病变组(RD,即经治疗后,样本中仍有恶性肿瘤细胞残留),说明GPRC5A可能与化疗耐药有关(图1D)。为了进一步验证GPRC5A在TNBC中的表达,作者利用免疫组化分析,结果显示与周围乳腺组织相比,TNBC中GPRC5A的表达显著升高(图1G),且在肝转移组织中更为明显(图1H)。以上结果表明,GPRC5A可能与乳腺癌转移和化疗耐药有关。
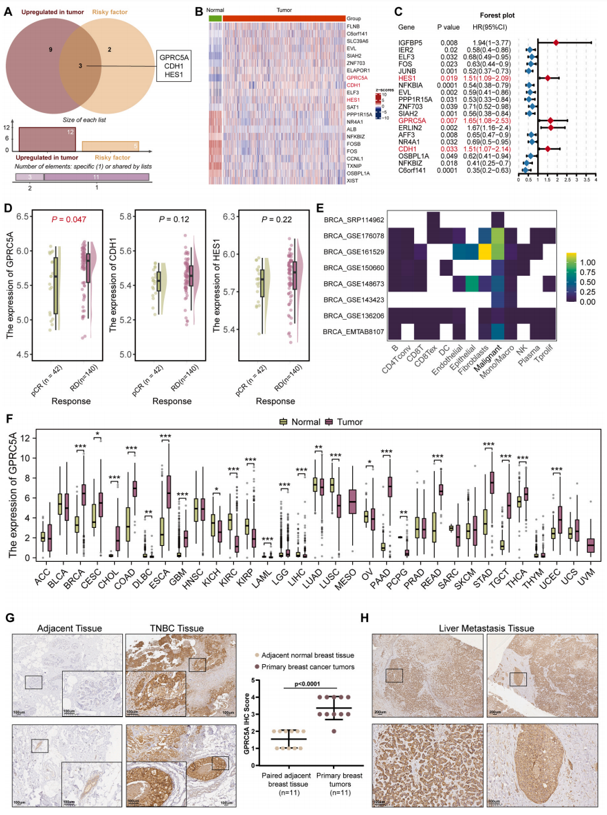
图1 GPRC5A与乳腺癌转移及多西他赛耐药相关
2.GPRC5A在体外和体内促进TNBC的增殖和迁移
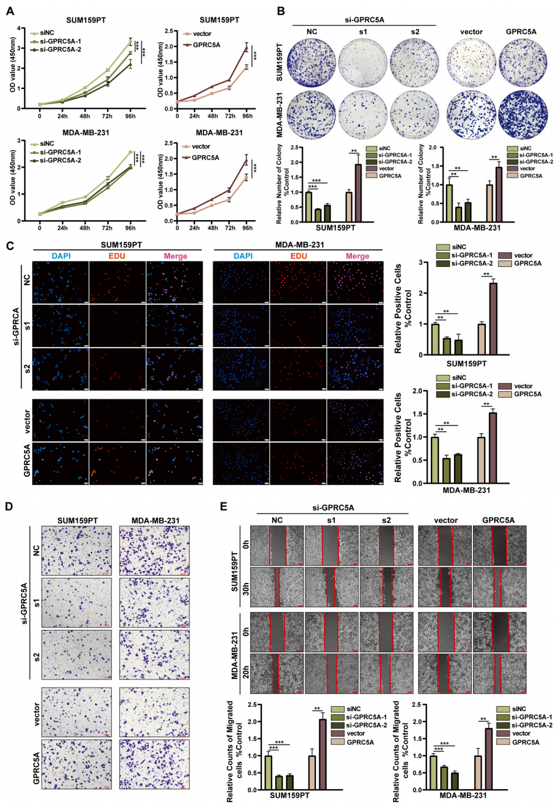
图2 GPRC5A在体外促进TNBC的增殖和迁移
确认了GPRC5A在TNBC细胞中的作用,作者随后评估了GPRC5A对体内肿瘤生长的影响。作者建立了过表达GPRC5A的SUM159PT和MDA-MB-231稳定细胞株,皮下种至裸鼠体内,每周测量肿瘤大小。结果表明,上调GPRC5A可显著促进肿瘤在体内的生长,下调则起抑制作用(图3A-G)。为了更全面地研究GPRC5A在肝转移中的作用,作者通过脾内注射过表达GPRC5A的TNBC细胞株建立了裸鼠肝转移模型,利用活体成像确定肝脏转移结节定殖大小和数量,并取肝脏组织进行进行HE染色以验证转移灶的存在,实验结果显示,与对照组相比,过表达组小鼠出现了更多的肝转移病变(图3F和H)。由此可见GPRC5A在TNBC肝转移中发挥了重要作用。
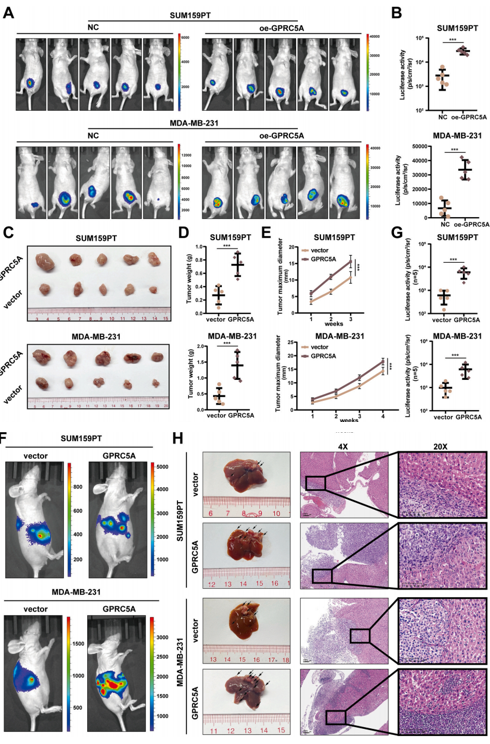
图3 GPRC5A在体内加速异种移植肿瘤的生长和肝转移
3.GPRC5A促进TNBC细胞对多西他赛的耐药
之前的研究已经表明GPRC5A过表达与乳腺癌肝转移耐药有关。通过检测多西他赛在GPRC5A过表达和敲低的SUM159PT和MDA-MB-231细胞中的IC50值,作者发现GPRC5A敲低能够显著降低IC50值,过表达则反之。因此,作者得出结论GPRC5A过表达可能有助于降低TNBC细胞对多西他赛的敏感性(图4A和B)。另外,加入多西他赛的GPRC5A敲低细胞的凋亡率显著增加(图4C和D),而在相同浓度的多西他赛作用下,GPRC5A过表达的TNBC细胞具有显著更高的集落形成能力(图4E)。基于以上结果,作者认为GPRC5A促进细胞耐药可能与凋亡通路有关。
BCL2是细胞凋亡的关键蛋白,有研究报道BCL2过表达可增强癌细胞对多西他赛的耐药性,并显著阻碍促凋亡调节剂BAX的细胞毒性作用。与敏感细胞相比,化疗耐药细胞中凋亡调节蛋白BCL2/BAX的比例更高。基于此,作者提出了GPRC5A通过调节BCL2和BAX蛋白的表达促进TNBC细胞对多西他赛耐药的假设。于是,作者分别检测了GPRC5A过表达和敲低细胞中的BCL2和BAX蛋白的表达水平,WB结果显示,GPRC5A敲低导致BCL2/BAX比值下降,GPRC5A过表达BCL2/BAX比值则升高(图4G)。综上,GPRC5A通过上调BCL2和下调BAX抑制多西他赛诱导的细胞凋亡过程,最终引发抗多西他赛反应。
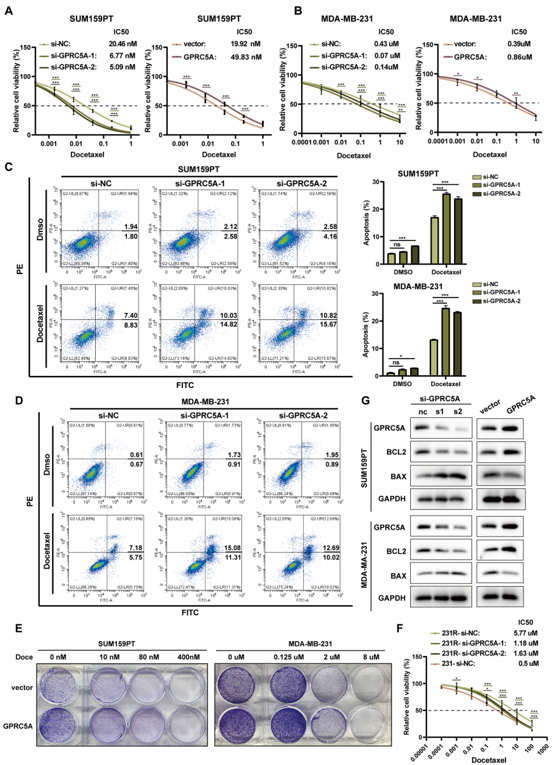
图4 GPRC5A促进TNBC细胞对多西他赛的耐药
4.GPRC5A通过METTL3/YTHDF1轴受m6A甲基化调控
有大量研究显示m6A甲基化通过多种机制显著促进肿瘤发生,而GPRC5A有4个潜在的m6A位点,作者通过meRIP实验和PCR产物琼脂电泳分析证实了GPRC5A中m6A的存在(图5A-C)。随后,作者评估了最常研究的5种m6A调节酶(ALKBH5、FTO、METTL3、METTL14和WTAP)对GPRC5A的调控作用,发现只有METTL3的抑制会显著影响GPRC5A的表达,METTL3的下调导致GPRC5A的下调,而METTL3的上调导致GPRC5A的上调(图5D和E)。此外,抗METTL3抗体可以特异性富集TNBC细胞中的GPRC5A mRNA,进一步证明了METTL3蛋白与GPRC5A mRNA之间存在直接相互作用(图5F)。
m6A相关效应的传递是由m6A reader介导的,因此,作者利用TCGA数据库分析了最常见的m6A reader(包括IGF2BP1/2/3、YTHDF1/2/3、ELAVL1和HNRNPA2B1)与GPRC5A表达的相关性。结果表明只有YTHDF1和YTHDF3与GPRC5A具有显著相关性(图5G),进一步利用敲低和RIP实验验证,发现只有YTHDF1与GPRC5A之间存在直接相互作用(图5H-L)。在两种不同的TNBC细胞系中,YTHDF1敲低可有效抑制METTL3过表达诱导的GPRC5A上调,表明YTHDF1促进翻译作用的必要性(图5M)。综上所述,这些发现阐明了METTL3和YTHDF1通过m6A机制协同调节GPRC5A的表达。
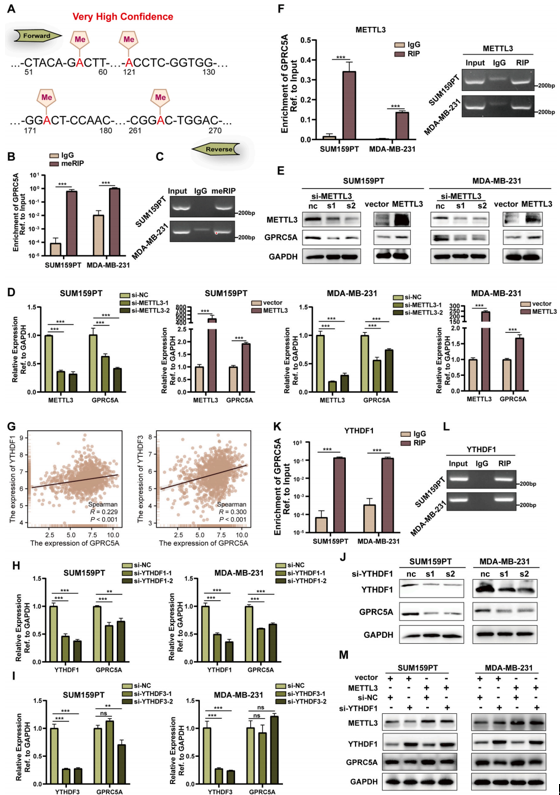
图5 METTL3和YTHDF1通过m6A机制协同调节GPRC5A的表达
5.GPRC5A与LAMTOR1相互作用,阻止其降解
为了阐明GPRC5A调控细胞功能的潜在机制,作者采用质谱(MS)分析方法鉴定了SUM159PT和MDA-MB-231细胞系中可能与GPRC5A相互作用的蛋白。在两种TNBC细胞系MS结果交叉鉴定的蛋白中,鉴定出了LAMTOR1。LAMTOR1参与mTOR信号通路,而后者的失调与各种病理生理状况有关,特别是癌症(图6A)。于是,作者使用免疫共沉淀(CoIP)和基因调控实验来验证LAMTOR1与GPRC5A之间的联系。CoIP实验中,GPRC5A使用flag标记,LAMTOR1使用myc标记,结合共聚焦显微镜观察结果,可确定两者存在相互作用(图6B-C)。随后作者对GPRC5A进行敲低和过表达来观察LAMTOR1表达量的变化,qRT-PCR结果显示LAMTOR1 mRNA表达无显著变化,而Western blotting分析显示LAMTOR1蛋白表达有显著变化,表明GPRC5A是通过蛋白质修饰来调节LAMTOR1的。
在哺乳动物细胞中,泛素蛋白体系统(UPS)被认为是最普遍的蛋白质降解方式之一,已有研究证明细胞中的LAMTOR1会被UPS降解。基于此,作者提出假设:GPRC5A可能抑制LAMTOR1的泛素化过程。环己亚胺(CHX)可阻断细胞中蛋白质的生物合成,常用于测定蛋白质的半衰期。在过表达GPRC5A的SUM159PT和MDA-MB-231细胞中加入CHX后,LAMTOR1的半衰期延长,而在细胞中加入蛋白酶体抑制剂(MG132)后LAMTOR1表达恢复(图6F-G)。为了提供进一步的证据,作者在293 T细胞中进行了共转染实验,其中共转染了myc标记的LAMTOR1和HA标记的ub。Co-IP结果表明,过表达GPRC5A会抑制外源LAMTOR1的泛素化(图6H)。这一发现支持了我们的假设,即GPRC5A通过抑制UPS抑制LAMTOR1的降解。

图6 GPRC5A与LAMTOR1相互作用,阻止其降解
6.GPRC5A通过调节LAMTOR1将mTORC1锚定在溶酶体上激活mTORC1
GPRC5A可阻止LAMTOR1降解,而后者是五聚体调节复合体的重要组成部分,可将mTORC1招募到溶酶体并激活下游信号通路。因此,作者猜测GPRC5A在TNBC细胞中表达上调导致LAMTOR1的上调,进而导致mTORC1在溶酶体上的锚定增加,以及随后mTORC1途径的过度激活。为验证这一猜想,作者进行了CoIP实验,结果显示GPRC5A的过表达导致mTOR和Raptor蛋白的更大下拉,而mTOR和Raptor蛋白是mTORC1直接结合LAMTOR1的组分,也就是说,GPRC5A促进了调控子与mTORC1的相互作用(图7A)。溶酶体相关膜蛋白(LAMP2)是一个很好的表征溶酶体膜的标志,因此可使用LAMP2来表示溶酶体膜并使其可视化,共定位分析表明,当过表达GPRC5A时,mTOR和LAMP2的重叠区域增加(图7B),这表明GPRC5A促进了mTORC1向溶酶体膜的招募。mTORC1沉积在溶酶体膜上后,会对多个下游靶标进行磷酸化,其中p70核糖体S6激酶(p70S6K)可作为mTORC1激活的一个指标,于是作者检测了两种不同的TNBC细胞系中p-p70S6K的水平,发现GPRC5A的敲低导致p70S6K磷酸化下调,而GPRC5A的过表达导致其磷酸化水平上调(图7C),表明GPRC5A可以作为mTORC1的激活剂。为了阐明GPRC5A在通过LAMTOR1调节mTORC1激活中的作用,首先作者进行了生信分析,结果显示GPRC5A与mTOR通路呈正相关(图7D)。接着作者使用siRNA敲低了GPRC5A过表达和对照的TNBC细胞中的LAMTOR1,transwell和细胞集落形成实验结果显示GPRC5A过表达对TNBC细胞的影响可以通过LAMTOR1的沉默来抵消(图7E-F)。
作者在MDA-MB-231细胞以及耐多西他赛的MDA-MB-231R细胞加入了雷帕霉素和多西他赛,细胞集落形成实验结果显示雷帕霉素有效地恢复了耐药细胞对多西他赛的敏感性,并抵消了TNBC细胞中多西他赛耐药的发展(图7G)。而在过表达GPRC5A和的TNBC细胞中加入雷帕霉素和多西他赛,发现细胞西他赛耐药倾向明显减轻(图7 H)。这些结果表明GPRC5A具有通过激活mTOR通路在TNBC细胞中引发抗多西他赛反应的能力,雷帕霉素联合多西紫杉醇可能是对抗多西紫杉醇耐药的潜在解决方案。
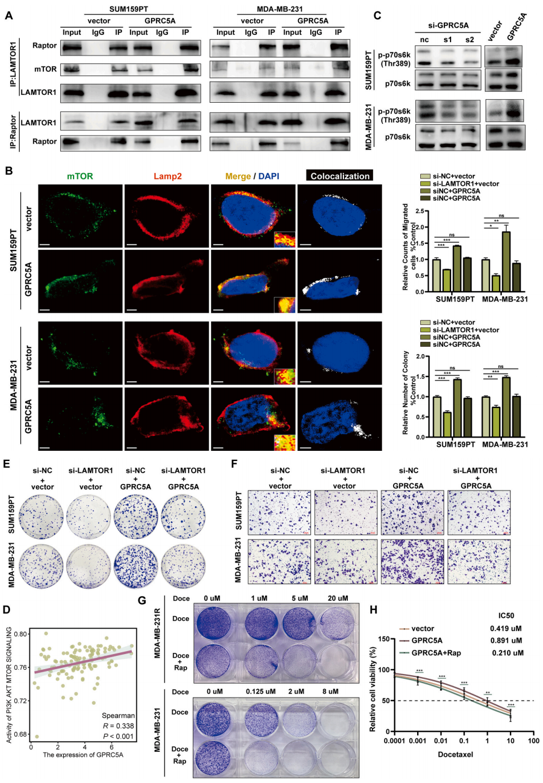
图7 GPRC5A通过调节LAMTOR1将mTORC1锚定在溶酶体上,从而激活mTORC1
综上所述,METTL3/YTHDF1轴在调节GPRC5A的m6A甲基化中起着至关重要的作用,而GPRC5A通过抑制UPS依赖性的LAMTOR1降解导致mTORC1/p70s6k信号通路的激活,从而促进了TNBC中多西他赛耐药性和肝转移。研究结果表明,GPRC5A可作为TNBC肝转移的新生物标志物和解决耐药的潜在治疗靶点。

查看更多

查看更多

查看更多

联系我们

返回顶部