查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
长期摄入高热量食物常引起慢性或过量性脂质暴露,而这将导致脂肪性肝炎、肝纤维化、肝硬化,甚至肝癌。由于持续的代谢综合征流行,成人和儿童的脂质紊乱发病率正在稳步上升,这也会导致肥胖和糖尿病。脂肪毒性和非酒精性脂肪性肝病(NAFLD)的发生源于内在脂肪生成与脂肪酸氧化(FAO)来源的脂质消耗之间的不平衡,然而,导致脂肪性肝炎发展的潜在机制的细节仍然未知。

2024年1月,广州中医药大学高永、四川大学唐小强及天津医科大学常永生共同通讯在Signal Transduction and Targeted Therapy(IF:39)在线发表题为“Hepatic Zbtb18 (Zinc Finger and BTB Domain Containing 18) alleviates hepatic steatohepatitis via FXR (Farnesoid X Receptor)”的研究性论文,发现转录因子Zbtb18在非酒精性脂肪性肝病(NAFLD)患者和小鼠模型的肝脏中下调,肝脏Zbtb18敲除促进了NAFLD特征,如能量消耗受损和脂肪酸氧化(FAO),并诱导胰岛素抵抗。在机制上,肝细胞Zbtb18激活FXR介导的FAO和CLTC表达,抑制了巨噬细胞中NLRP3炎症小体的活性,减轻了炎症应激和胰岛素抵抗。在本研究中,作者使用了汉恒生物提供的Zbtb18过表达腺相关病毒(AAV-Zbtb18)及对照的腺相关病毒(AAV-Gfp),在动物上进行相关基因调控实验。

作者对NAFLD患者、健康对照、NAFLD小鼠模型和正常对照的肝组织进行了mRNA微阵列分析,发现数据集之间有33个差异表达基因重叠,其中Zbtb18表达呈下降趋势。在几种NAFLD小鼠模型(糖尿病小鼠,肥胖小鼠和高脂肪饮食HFD诱导的肥胖小鼠)肝脏,以及油酸和棕榈酸(OA&PA)培养的小鼠原代肝细胞(MPHs)中的Zbtb18蛋白表达均显著降低。在过表达Zbtb18后,MPHs有效地增加了参与FAO和氧化磷酸化(OXPHOS)基因的表达,并显著抑制了糖异生相关的基因。表型上看,Zbtb18的过表达增加了脂肪酸分解代谢,同时减少了MPHs中的脂质沉积。
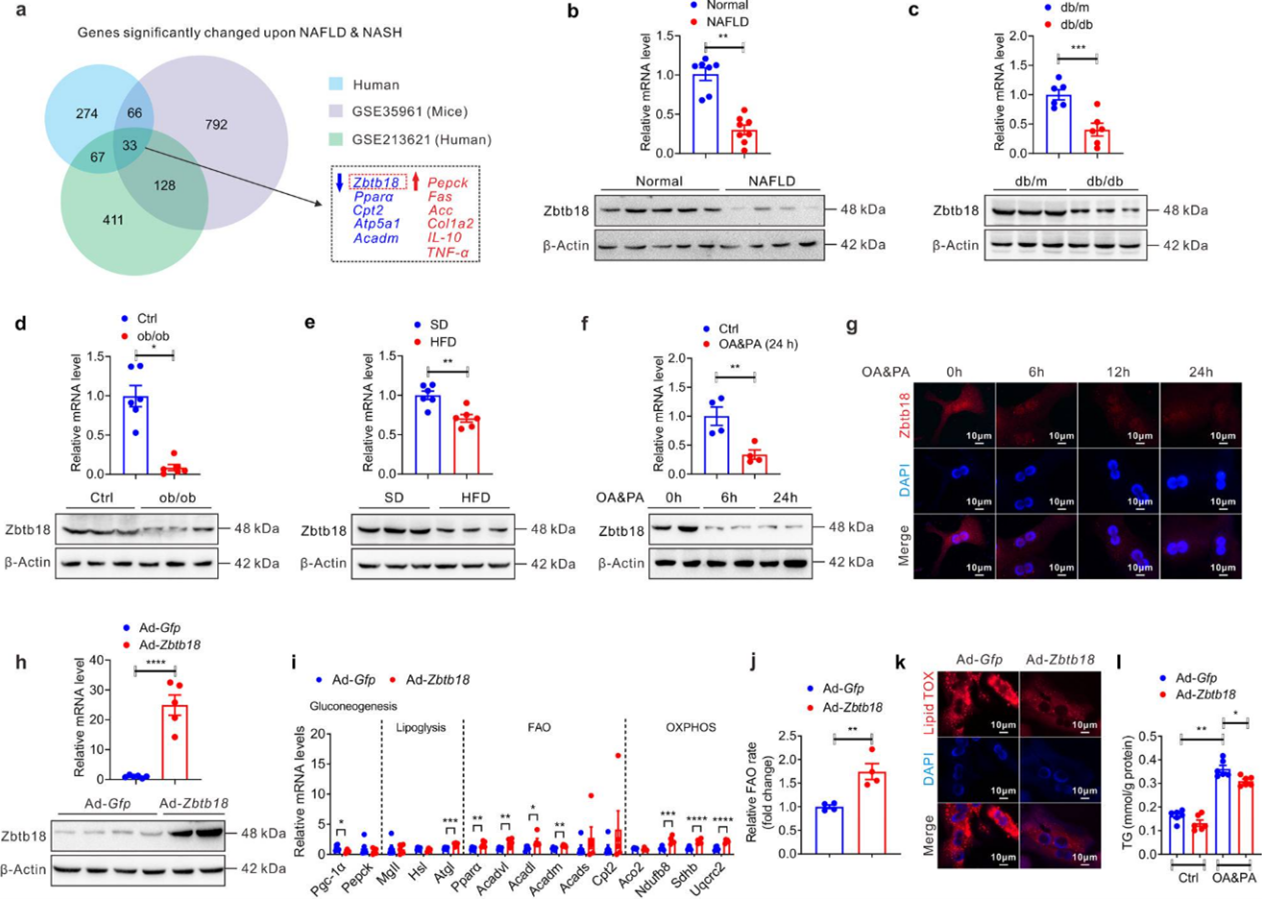
图1 肝脏Zbtb18下调与NAFLD的发生密切相关
随后,作者构建了肝细胞特异性Zbtb18敲除小鼠并进行高脂肪饮食(HFD)处理,来验证肝脏Zbtb18的功能。肝脏Zbtb18缺失导致小鼠在长期HFD处理后拥有更高的体重和脂肪量,HE染色显示主要脂肪组织的脂肪细胞肥大,qPCR结果提示产热基因表达抑制;肝脏Zbtb18缺失小鼠出现能量消耗、呼吸O2消耗量和CO2生产降低;空腹血糖和胰岛素水平增加、AKT和GSK-3β磷酸化蛋白表达减少进一步表明这些Zbtb18缺失小鼠的胰岛素敏感性受损;参与FAO和OXPHOS的基因下调,而糖原基因上调,共同增加了小鼠肝脏中的脂质沉积。
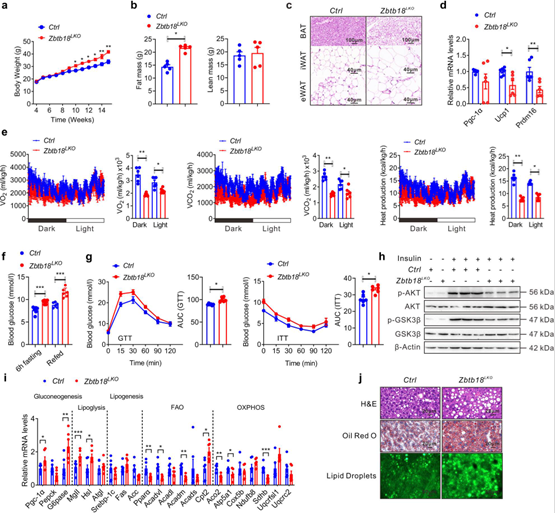
图2 肝脏Zbtb18的缺失加重了HFD小鼠的脂肪性肝炎
另一方面,作者构建了肝脏特异性Zbtb18过表达小鼠来探究该基因上调对HDF引起的肝炎是否具有缓解作用。与Zbtb18敲除小鼠结果相反,肝脏特异性过表达Zbtb18小鼠在HDF条件下体重和脂肪量减少,能量消耗增强,肝细胞脂肪变性改善,血清酮体水平升高、肝脏和血清TGs水平降低,脂肪分解、FAO和OXPHOS相关基因的表达增加。另一方面,肝脏特异性Zbtb18过表达下调了HDF小鼠炎症基因表达和血清ALT和AST水平,这减轻了炎症细胞的浸润和炎性细胞因子的释放,最终逆转了由HFD引起的肝炎并改善了肝功能。
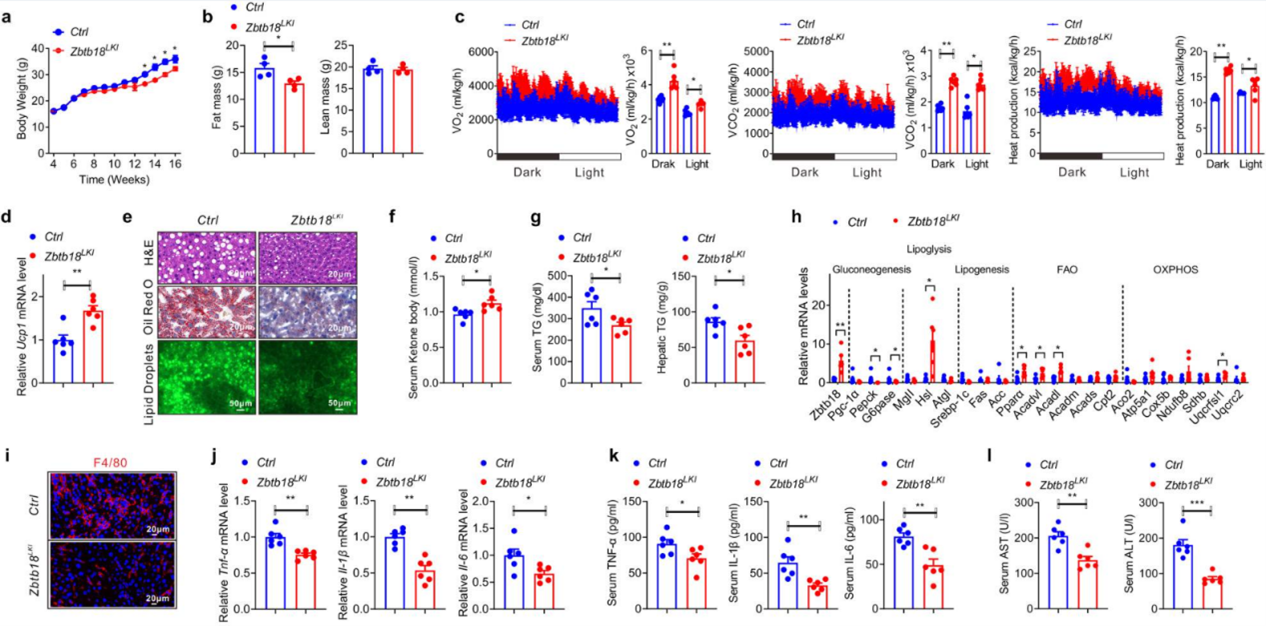
图3 肝脏Zbtb18过表达有助于肝脏对抗HFD诱导的脂肪变性
为了探究Zbtb18如何介导对肝脏的保护作用,作者对Zbtb18过表达的MPH进行了RNA-seq。Zbtb18过表达的MPH与NAFLD患者肝脏中鉴定的重叠DEG大多数与FXR靶基因相关,且具有明显的正相关。在Zbtb18过表达肝脏的FXR mRNA和蛋白水平存在显著上调,而MPH中过表达Zbtb18也上调了FXR表达及其靶基因的总表达水平和核表达水平。db/db小鼠和HFD小鼠的肝脏中,FXR启动子上Zbtb18转录因子的结合率显着降低。ChIP-seq结果表明FXR基因中有一个显著的Zbtb18结合启动子区域,荧光素酶验证Zbtb18的潜在结合位点位于−1074 bp到−677 bp,结合基序为AACTCACTCT。在体内实验中,FXR敲除显著削弱了Zbtb18过表达对脂质累积的保护作用和对FAO的刺激作用,而FXR的过表达则抵消了由Zbtb18缺乏导致的甘油三酯含量升高。
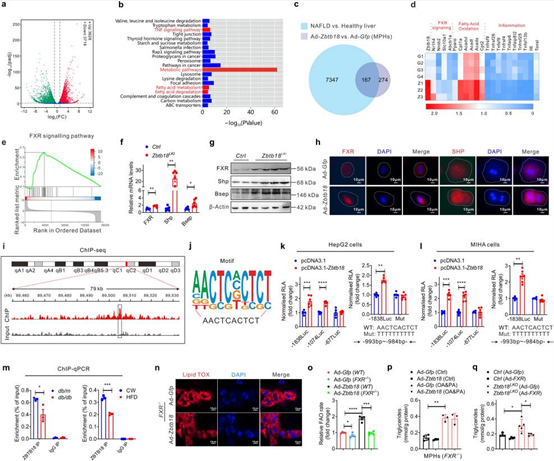
图4 Zbtb18通过转录激活FXR介导的FAO加速脂质分解代谢
为了全面探讨Zbtb18对NAFLD发展的影响,作者研究了NLRP3炎症小体组装和激活的变化。Zbtb18缺失显著增强了HFD诱导模型的肝脏炎症小体相关蛋白(NLRP3、ASC和Caspase-1)的表达,Zbtb18过表达则显著抑制了HFD模型和db/db模型这些蛋白的表达。FXR缺失有效地消除了Zbtb18对NLRP3炎症小体相关蛋白的抑制作用,而FXR过表达有效地在肝脏Zbtb18敲除小鼠中阻断了NLRP3炎症小体的异常激活。Zbtb18过表达肝细胞的条件培养基可抑制OA&PA&LPS诱导的巨噬细胞中NLRP3炎症小体相关蛋白的表达,而肝细胞中CLTC的缺失显著恢复了蛋白表达。
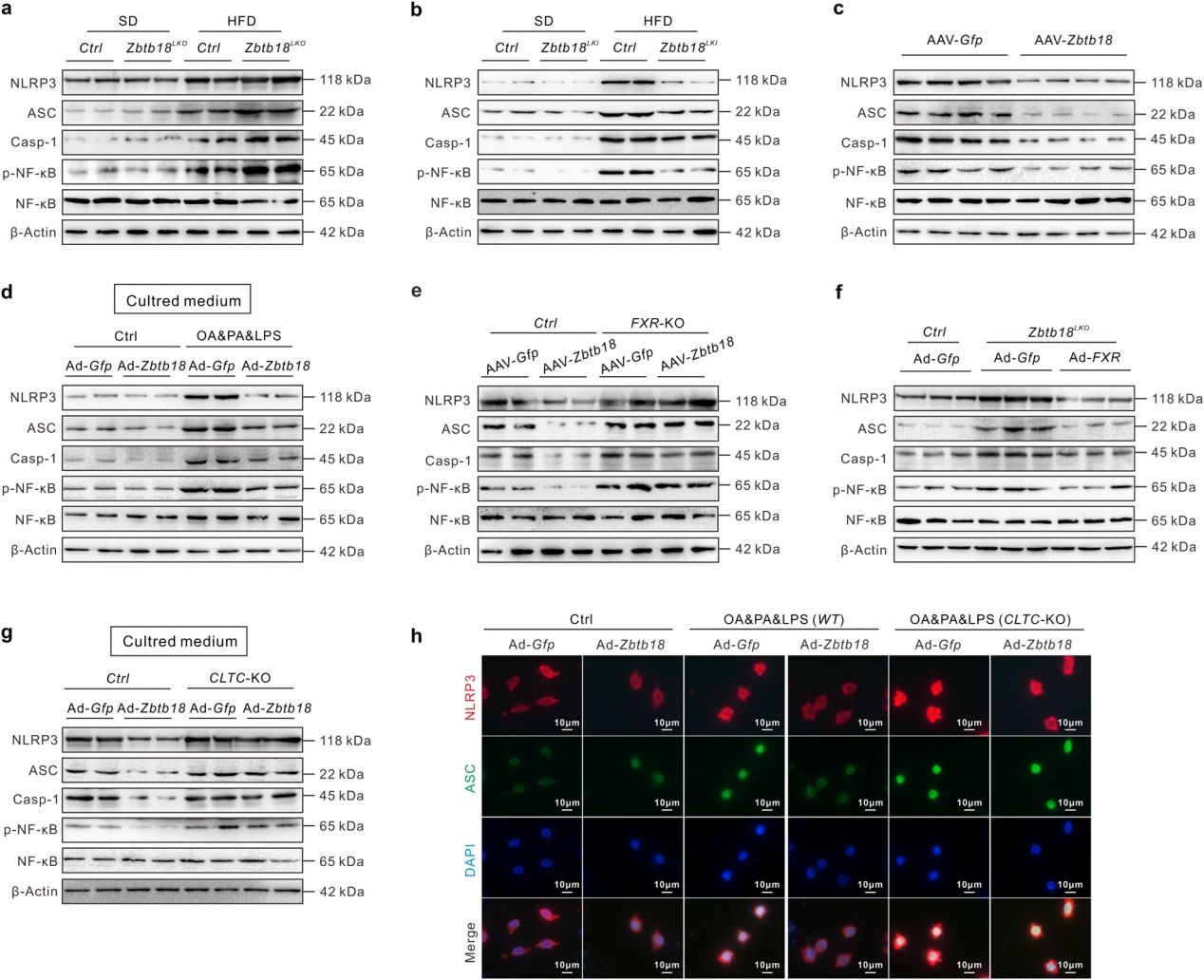
图5 肝脏Zbtb18-FXR-CLTC信号轴抑制巨噬细胞中NLRP3炎症小体的激活
随后,作者通过FXR敲除小鼠来验证FXR是否介导了Zbtb18对肝脏的保护作用。FXR缺失几乎消除了Zbtb18诱导的体重和脂肪量的减少、血清酮体水平的升高、FAO相关基因表达的升高,血清和肝脏中的TGs含量的下降,以及对肝细胞脂滴的减少。此外,AAV-Zbtb18感染的FXR缺陷小鼠的葡萄糖耐量和胰岛素抵抗相对于野生型小鼠没有显著性变化,AKT蛋白、GSK-3β磷酸化蛋白和糖源基因(如Pgc-1α和Pepck)mRNA水平无明显改变。Zbtb18未能降低FXR缺陷小鼠的血清炎性细胞因子,如TNF-α和IL-1β,以及ALT和AST水平。而FXR在Zbtb18肝特异性敲除小鼠体内的强制表达则逆转了由Zbtb18表达下调所带来的负面影响。
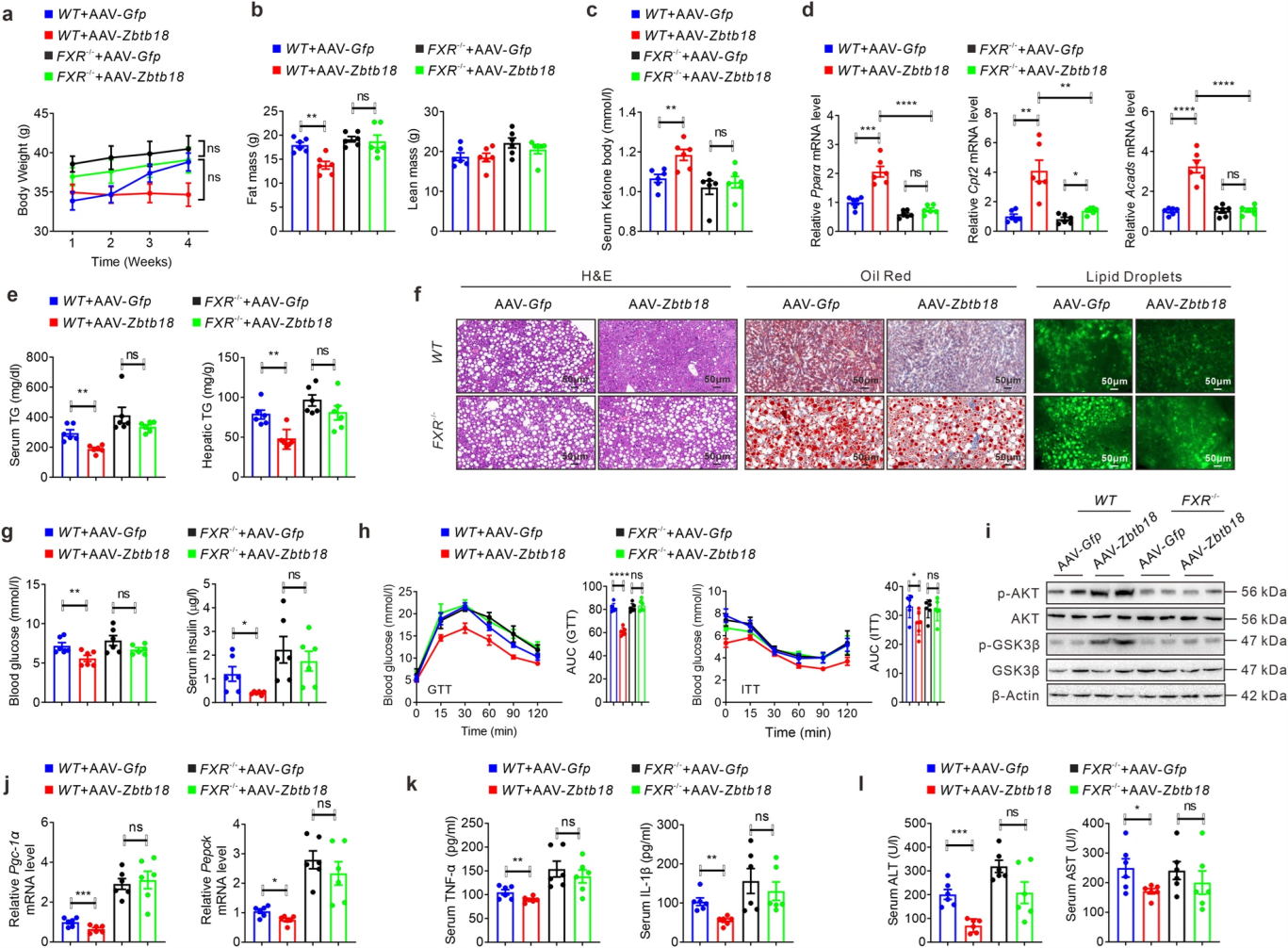
图6 FXR敲除抑制了肝脏Zbtb18对脂肪性肝炎的保护作用
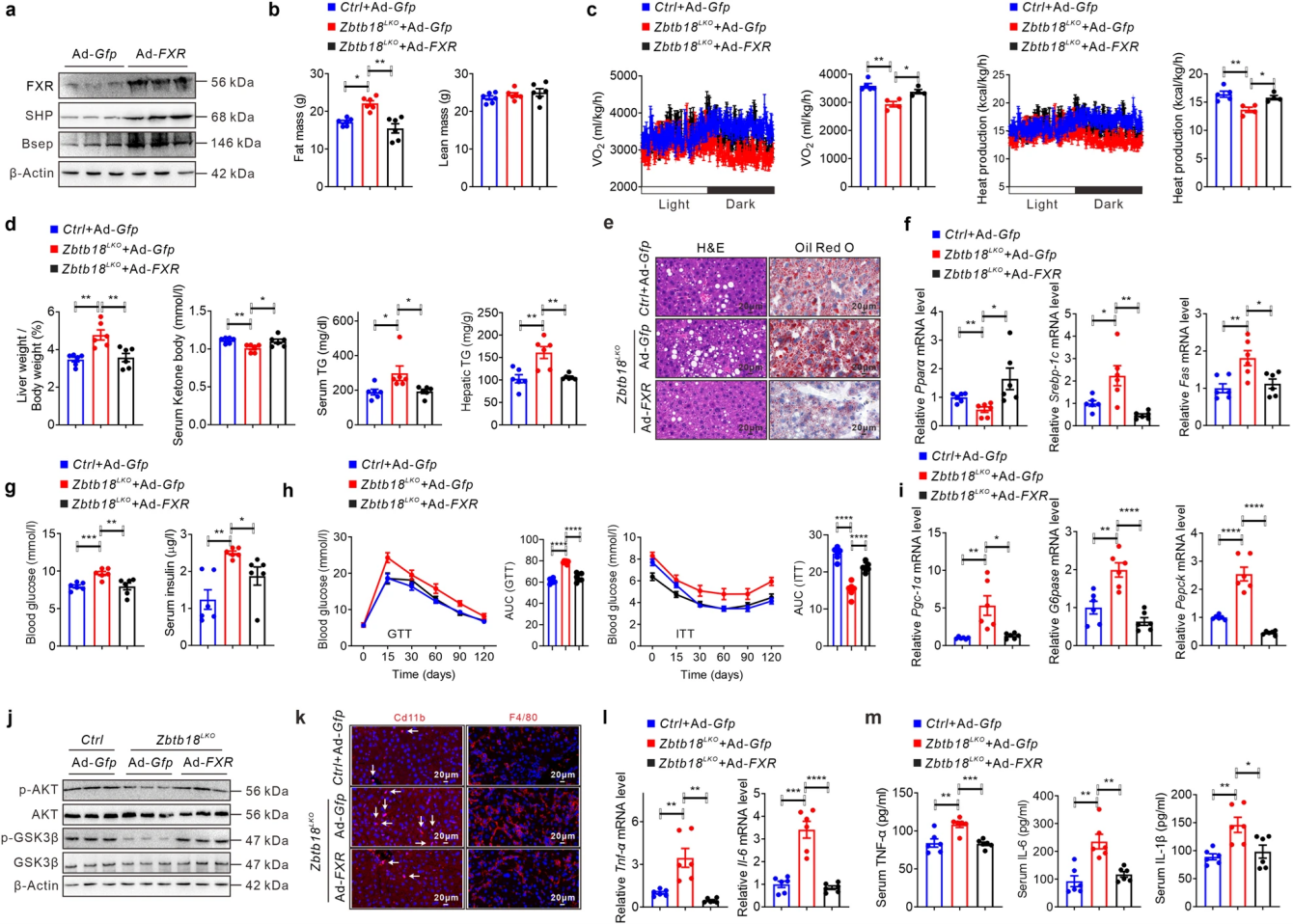
图7 肝脏FXR过表达缓解了肝脏Zbtb18缺失小鼠的NAFLD表型
最后,考虑到Zbtb18在减少肝脂质沉积方面的明显作用,作者探究了Zbtb18对MCD诱导肝纤维化的小鼠的保护作用。MCD饮食暴露后对照小鼠ALT和AST水平升高、TGs升高以及肝脂沉积过量,而肝脏Zbtb18过表达则削弱了这种变化。Zbtb18过表达有效改善了MCD饮食刺激的实质内细胞周围纤维化的发展,抑制了F4/80、TNF-α、CXCL1和CXCL10等炎症基因,降低炎性细胞因子的血清水平和炎症细胞的肝脏浸润,有助于改善脂肪性肝炎。
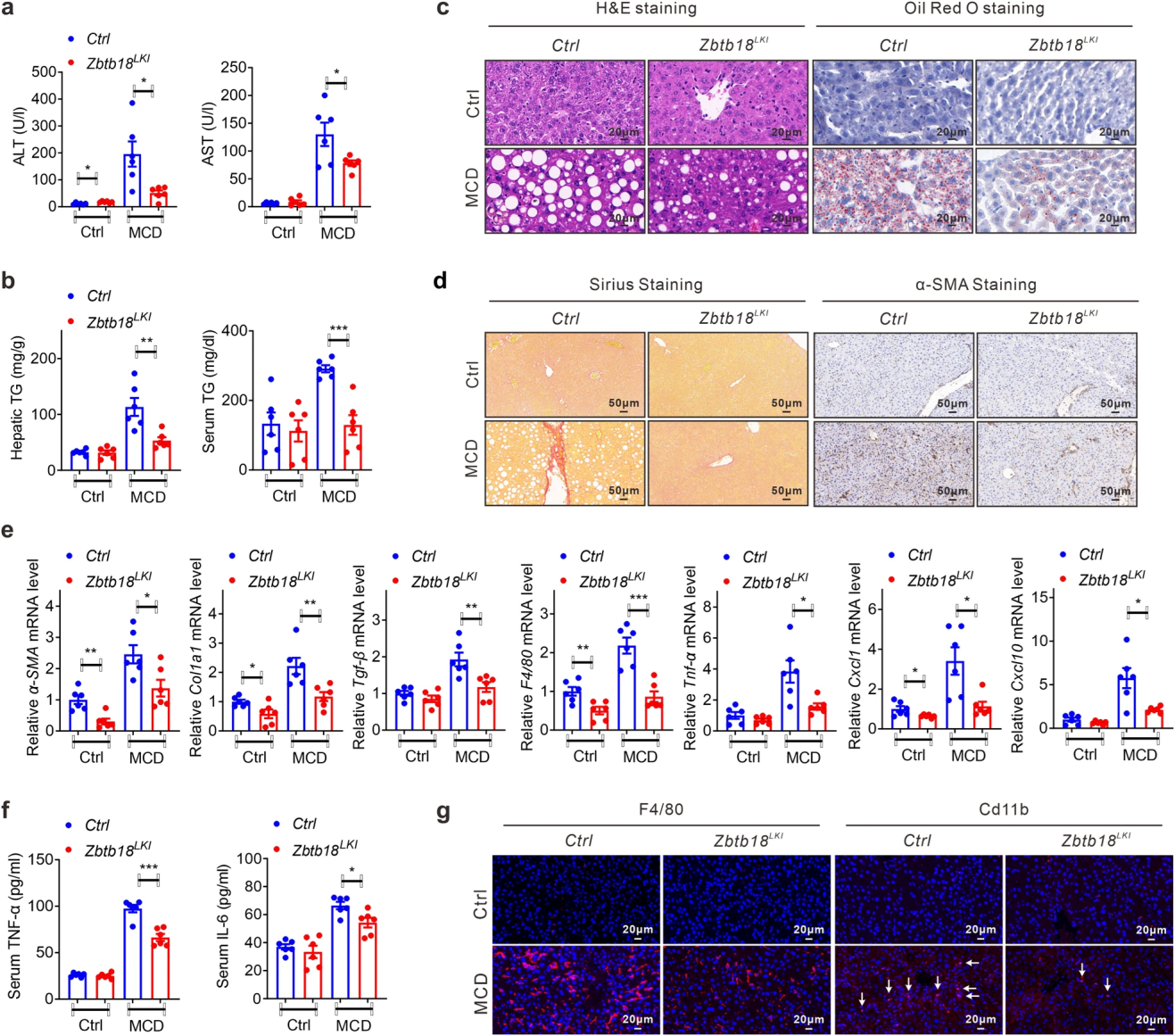
图8 Zbtb18通过转录激活FXR保护小鼠免受MCD诱导的肝纤维化
在本实验中,作者通过一系列研究发现,肝脏Zbtb18蛋白可以通过直接结合FXR启动子区域上的AACTCTCT元件来转录激活FXR及其下游靶基因,FXR可以刺激其靶基因以加速FAO和肝脏中过量脂质的消耗,从而防止NAFLD的发生和发展。此外,Zbtb18/FXR轴刺激的CLTC蛋白显着缓解了肝脏炎症浸润和纤维化。该实验强调了Zbtb18/FXR轴作为NAFLD和NASH治疗靶点的潜力。
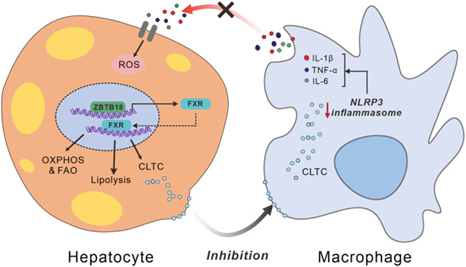
图9 Zbtb18激活FXR介导的肝脂质代谢,从而抑制NLRP3炎症小体的活性

查看更多

查看更多

查看更多

联系我们

返回顶部