查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期干货内容针对lncRNA进行了详细的介绍,本期继续为大家介绍既是功能性RNA分子,部分也具有编码蛋白能力的另一类非编码RNA,即本期的主角—circular RNAs(circRNAs)。

circRNAs是一类单链环状的非编码RNA,在病毒、植物和哺乳动物等各物种中广泛表达。区别于传统的线性RNA,circRNA不具有5‘帽子结构和3‘ poly(A)尾,并以共价键的形式闭合成环,对核酸外切酶不敏感,这种独特的结构赋予了circRNA高度的稳定性。
起初发现的少量circRNA,被认为是基因转录剪切过程中因剪接错误产生的一些副产物,不确定在生物学过程中是否发挥重要作用。随着高通量测序技术的应用发展,人们发现哺乳动物细胞中存在大量的circRNA。直到2013年,Nature杂志的两篇研究论文取得了突破性研究进展,首次证明circRNA可以通过充当miRNA海绵,参与基因表达调控而发挥生物学功能,进而迅速成为生物医学研究领域的焦点。我们本期将从circRNA分类及成环机制、circRNA生物学功能、circRNA常规研究思路及方法和常用数据库等方面带大家具体了解一下circRNA的“神秘”。
RNA的选择性剪接是真核细胞中基因转录表达过程的重要事件。mRNA前体经过剪接后将内含子去除,使外显子依次连接或跳跃式连接产生成熟的mRNA。CircRNA是mRNA前体经反向剪接产生,由下游剪接受体与上游剪接供体连接形成共价闭环结构。随后,主要可产生三种类型的circRNA:
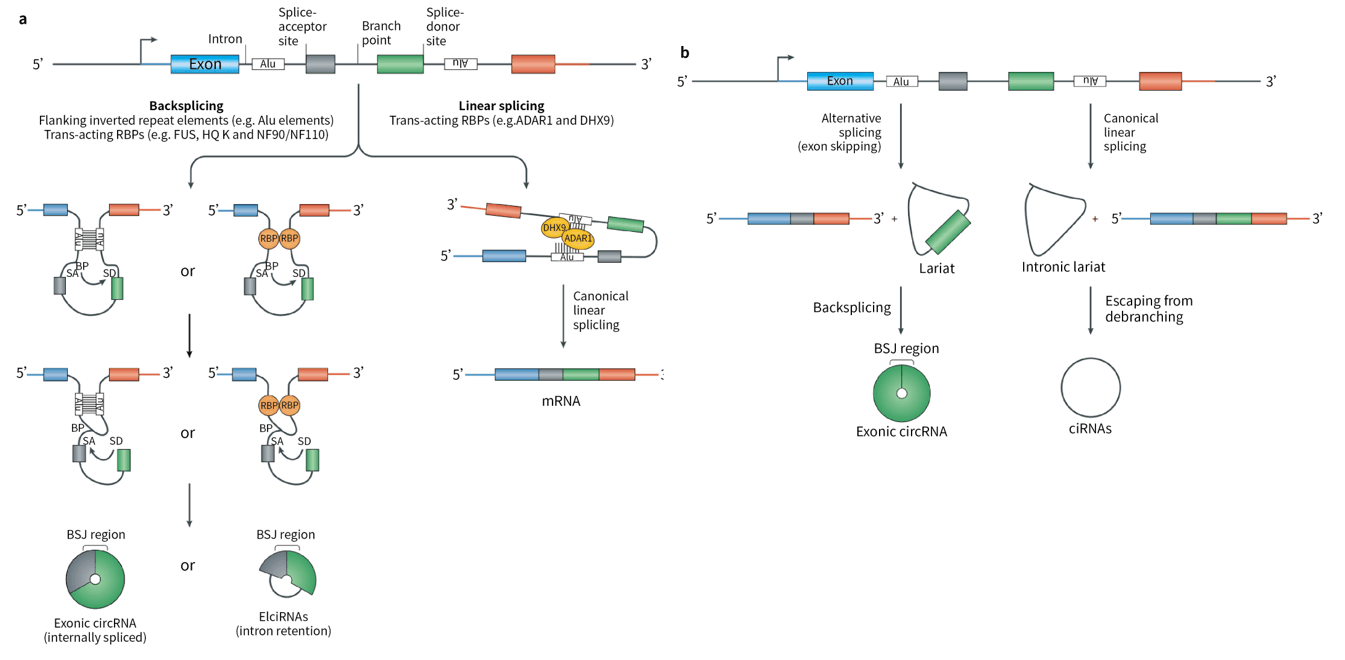
图1. circRNA成环机制示意图[1]
(BP:branch point,分支点;SA:splice-acceptor,剪接受体;SD:splice-donor,剪接供体;BSJ:backsplice junction,反向连接点)
1、由外显子构成的circRNA(exonic circRNA,EcircRNA)
目前研究认为EcircRNA有两种形成方式:套索驱动环化,内含子配对驱动环化。
① 套索驱动环化:这种环化方式是mRNA前体首先经过经典剪接作用和外显子跳读,生成具有多个外显子且包含内含子套索的线性RNA,然后经反向剪接,即内含子套索下游3’端的剪接受体与上游5’端的剪接供体连接成环,并将内含子切除后形成成熟的circRNA。
② 内含子驱动环化:内含子驱动环化也有两种方式。一是依赖外显子两端的内含子中具有一定长度的互补序列,经互补配对后,拉近了两端的剪接受体和剪接供体,此时内含子被切除,脱落的外显子连接成环;这是促进外显子环化的有效方法,短散在重复序列(SINE)家族成员Alu元件已明确是可促进circRNA成环,且已作为成环元件广泛应用于外源性表达circRNA。二是通过RNA结合蛋白(RBP)驱动环化,当外显子两端的内含子序列具有RBP结合位点时,RBP与之结合后形成二聚体,使两个剪接位点靠近,从而促进环化。
2、由内含子构成的circRNA(intronic circRNA,ciRNA)
ciRNA的形成过程与EcircRNA不同。正常情况下,经典剪接过程中释放的内含子套索会被降解;然而当其5’端剪接位点包含一段7nt富含GU碱基的序列以及3’端附近含有11nt富含C碱基的序列,使内含子套索受到保护,即会形成ciRNA。
3、外显子和内含子组合形成的circRNA(exon-intron circRNA,EIciRNA)
事实上,套索驱动和内含子驱动环化不仅可以产生EcircRNA,也可能会产生EIciRNA。
除此之外,tRNA和病毒RNA等也可环化产生circRNA。
从“垃圾”到明星分子,circRNA的功能得到不断发掘,circRNA不仅具有调控功能,部分还有其独特的翻译能力,且广泛参与机体的生理和病理机制。
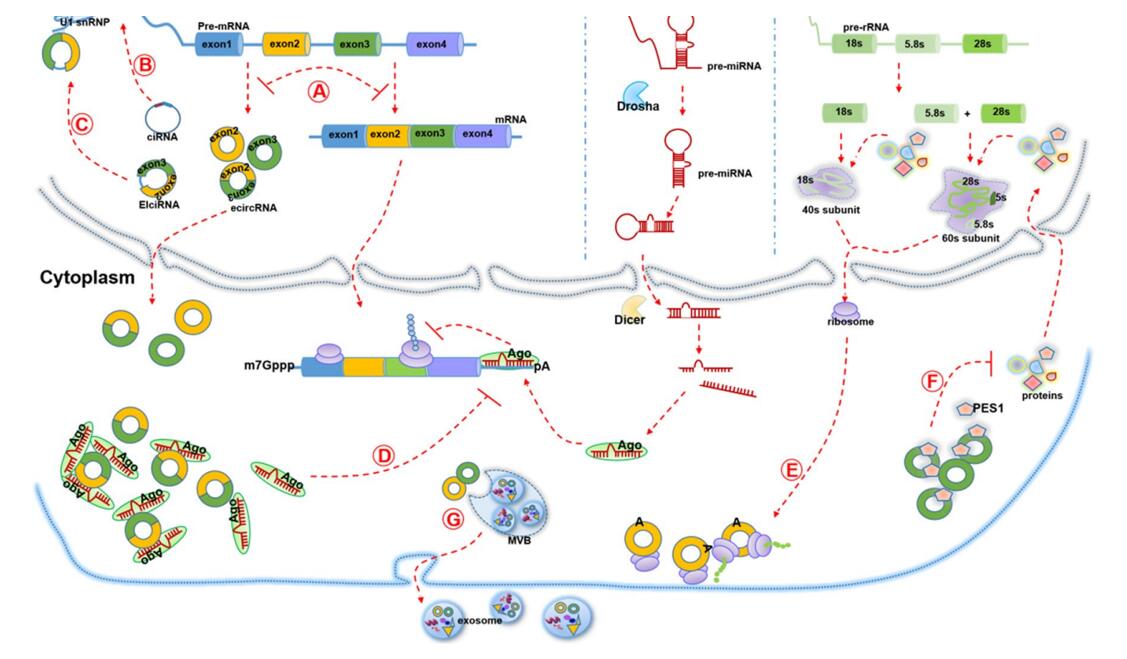
图2. circRNA功能示意图[2]
1、充当miRNA海绵
起初观察到一些circRNA有许多miRNA结合位点,后来大量研究证实了这一点。位于细胞质中的circRNA可以充当竞争性内源RNA(ceRNA),吸附miRNA发挥生物学功能。
2、circRNA翻译功能
真核细胞中mRNA通过5’端帽子结构附着到核糖体上,最终翻译出多肽。circRNA缺乏5’帽子,无法依赖这种方式进行启动翻译,但是含有内部核糖体进入位点(IRES)的circRNA可以直接募集核糖体并起始翻译,此类circRNA需同时拥有开放阅读框(ORF)且位于IRES下游。
3、转录调控功能
circRNA可以通过与相应DNA位点结合形成RNA-DNA杂交链或R环,导致结合处无法转录,发生外显子跳跃或转录终止,进而产生新的剪切体。另一方面,circRNA也可与转录因子相互作用以调节基因转录。
4、circRNA与蛋白质相互作用
除上述功能外,circRNA还可以与一种或多种蛋白相互作用,充当蛋白诱饵、支架或募集剂。具体而言,circRNA与蛋白结合可能产生多方面的影响:
① 改变蛋白间或蛋白与核酸分子的相互作用:一种模式是circRNA同时与两种蛋白相互作用,促进或解离这两种蛋白的互作;另一种模式是circRNA通过与一种蛋白相互作用,来影响该蛋白与另一蛋白的互作;还有一种则是circRNA只与一种蛋白结合,使其功能丧失或产生新的功能。
② 募集蛋白到染色质中:circRNA与顺式作用元件结合并招募转录因子或表观遗传修饰酶等,进而改变基因表达。
③ 改变蛋白的核内外分布:核定位或胞质中可入核的circRNA可促进蛋白的核易位,胞质定位或核内可输出到胞质中的circRNA则促进蛋白的胞质易位;此外还有部分可转运至膜或线粒体等。
从上一小节可知,目前发现circRNA发挥作用的功能机制分类繁杂,其中以ceRNA相关机制研究为主。这里总结了circRNA的一般研究思路尤其是ceRNA机制,以及对应的一些研究方法,供大家参考(图3)。
值得注意的是,与普通线性基因不同,circRNA的表达调控有其特别之处。
(1)circRNA过表达:内源性circRNA之所以能闭合成环,是因为circRNA序列外显子两侧的长侧翼内含子具有成环元件(如Alu),能够促进线性序列成环。因此使用质粒或病毒载体进行外源性表达,同样需要在circRNA序列两端加上成环元件,以确保序列成环。
(PS:汉恒生物circRNA成环载体系统可达到100%成环哦,且体内和体外实验均适用。)
(2)circRNA干扰:siRNA或shRNA即可用于敲低circRNA,但为避免干扰到其母本基因或线性序列的表达,需针对circRNA的接点处设计干扰靶点。
(3)circRNA敲除:使用CRISPR-Cas9技术敲除circRNA。考虑可能会影响到亲本基因的表达,一般是不会直接敲除circRNA的片段。通常采取敲除circRNA的成环元件Alu的方式,破环其成环能力,即针对circRNA两端长侧翼内含子中的Alu序列设计双gRNA进行敲除,此法难点在于内含子中可能存在不止一个Alu元件,需从中找出催化成环对应的序列。
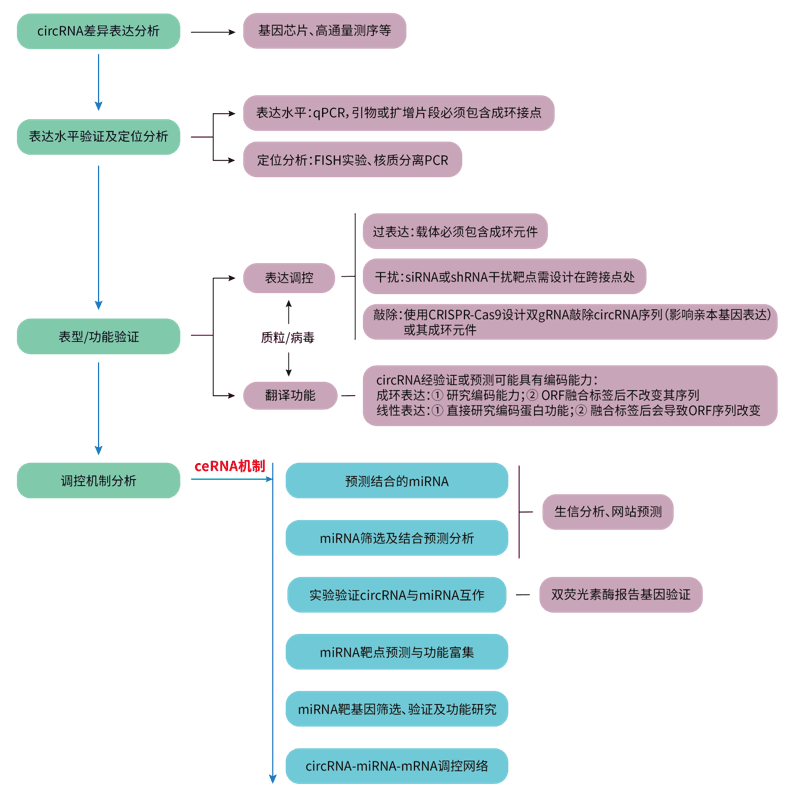
图3. circRNA研究思路及相关方法
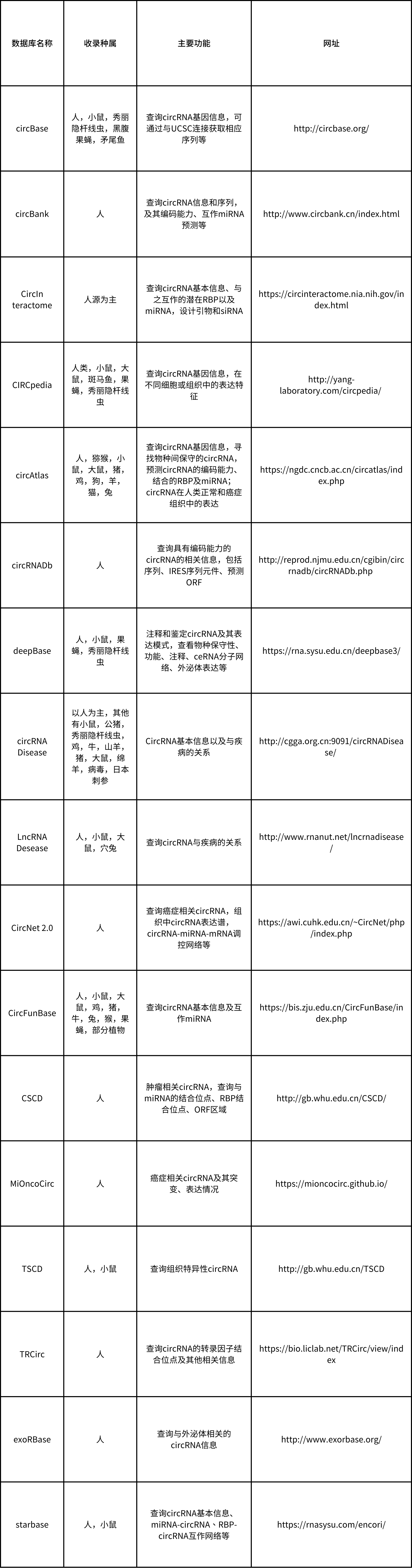
要想研究circRNA机制,通过数据库进行信息查询或预测相关功能是必不可少的,下面是一些circRNA研究常用到的数据库,可以查询circRNA的基本信息、互作靶点、与之相关疾病以及预测编码能力等(表1)。
表1. circRNA常用数据库汇总
本期内容从circRNA的分类、成环机制、主要生物学功能、研究思路及方法这几个方面进行了具体介绍,希望能帮助到想入门研究circRNA或涉及相关研究方向的小伙伴,有兴趣可以根据这些知识点深入拓展哦~另外,汉恒生物可以提供circRNA过表达、干扰和敲除载体的构建、与靶基因互作的双荧光素酶验证服务等,并拥有专业的技术服务团队为您答疑解惑,有意向的小伙伴欢迎与我们联系~下期我们将继续介绍另一种重要的非编码RNA—microRNA,敬请关注!
参考文献:
[1] Kristensen LS, Andersen MS, Stagsted LVW, Ebbesen KK, Hansen TB, Kjems J. The biogenesis, biology and characterization of circular RNAs. Nat Rev Genet. 2019 Nov;20(11):675-691. doi: 10.1038/s41576-019-0158-7.
[2] Li R, Jiang J, Shi H, Qian H, Zhang X, Xu W. CircRNA: a rising star in gastric cancer. Cell Mol Life Sci. 2020 May;77(9):1661-1680. doi: 10.1007/s00018-019-03345-5.

查看更多

查看更多

查看更多

联系我们

返回顶部