查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
前面两期为大家详细介绍了非编码RNA中的lncRNA和circRNA,本期继续为大家介绍一种非编码RNA:miRNA。本文将从miRNA的发现、结构、作用机制、功能、表达调控以及常用数据库几个方面为大家详细介绍非编码RNA调控系列之miRNA的调控。

microRNA(miRNA)是真核生物中一类内源性的小非编码RNA,长度约为17~25bp。自1993年被发现miRNA以来,小RNA领域的进展和发现颠覆了科学界对基因调控的认识。从胚胎发育开始,到细胞凋亡,乃至肿瘤生长,miRNA在一系列生理和病理过程中发挥着重要的作用,各种遗传、代谢、传染病和肿瘤相关的miRNA为科学家进行病理研究提供了新的角度,可能成为可靠的疾病生物标志物,科学家们也正积极地通过改变miRNA的功能、研发新的体内递送方法,寻求对疾病干预治疗的手段,miRNA近来还被发现用于介导跨物种的进化与适应,更多的miRNA还有待探索。
1993年,Victor Ambros和Gary Ruvkun分别领导的两个实验室在线虫中发现了一种名为lin-4的基因[1,2]。这种基因并不编码蛋白,而是表达一种长度为22nt的小RNA,并且这种小RNA可以抑制一种核蛋白LIN-14基因的表达从而调节线虫的发育。他们推测这种抑制的机制在于lin-4能够与LIN-14 mRNA的3’ UTR区域上独特的重复区域相互补。发生在线虫第一幼虫期末尾的这种抑制作用将启动线虫从第一幼虫期向第二幼虫期的发育转变,因此这种小RNA又被称为“小分子时序RNA(small temporal RNA,stRNA)”。
然而这一发现并未得到科学界的重视,只是被当做一个特例存在。下一个类似现象的报道,是在七年之后的2000年。第二个被发现的miRNA被命名为let-7,长21nt,由Gary Ruvkun在对线虫的研究中发现[3]。同lin-4类似,let-7也能通过结合在一些靶基因(lin-14、lin-28、lin-41、lin-42以及daf-12)mRNA的3’ UTR区域上,从而调节线虫的发育。Let-7的发现,以及当时RNAi领域的兴起,让人们意识到这种调节性小RNA可能是一种广泛存在的基因表达调控分子。在2001年10月,Thomas Tuschl、David Bartel和Victor Ambros三人分别领导的三个研究组在《science》杂志同期发文,将这种小RNA命名为microRNA,简称miRNA[4-6]。随后的几年里,成千上万的miRNA在各种物种(包括人类、小鼠、大鼠、果蝇、斑马鱼、拟南芥、水稻等动植物的几乎所有类群)中被发现,开辟了一片全新而广阔的科学研究领域。
鉴于miRNA的迅速发现以及功能的阐明,迫切需要一个统一的命名规则与统计规范。来自Sanger研究所的科学家们在2002年开发了microRNA Registry,后更名为miRBase,为miRNA的研究提供了规范和方便[7]。miRBase收录的miRNA条目数从2002年的218个增加到2023年的271个物种,几万条记录。而仅仅人类基因组所编码的miRNA已经达到1917个。现在依然不断有新的miRNA被发现。另外,我们从pubmed上梳理了miRNA从2001年重新被发现后该领域所发表的论文,如图1所示,年论文量从2001年的5篇增加到了2023年的13288篇,增加了2600多倍。
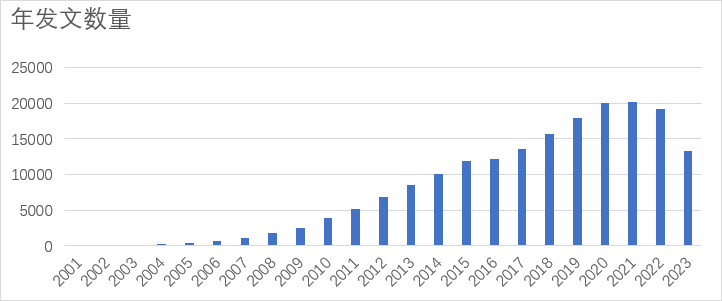
图1. miRNA 自发现以来相关论文的数量变化
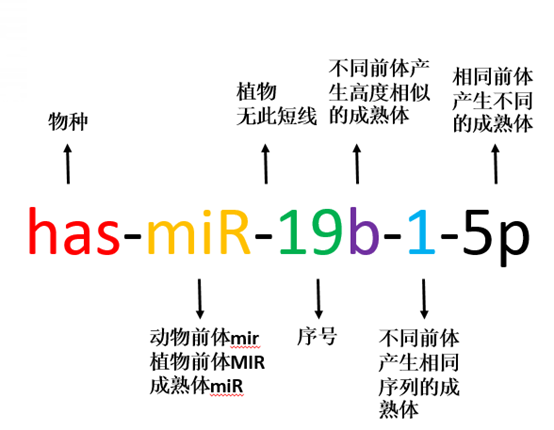
图2. miRNA 的命名规则
miRNAs在细胞内是怎么加工成熟的呢?miRNAs的加工成熟是一个经历了细胞核到细胞质空间转变、多种酶和辅助蛋白协调完成的受到多层次调节的多步骤精密反应[8]。
RNA聚合酶最先合成的是miRNA的初始转录本(primary transcript),称为primary miRNA(pri-miRNA)。Pri-miRNA一般长达数千nt,内部有茎环结构(stem-loop structure)。Pri-miRNA到最终的成熟体miRNA,需要经历“切两刀”。首先,pri-miRNA上的茎环结构会在细胞核中被RNaseIII型的核酸内切酶Drosha从初始转录本上切割下来,得到的长约65nt的小发卡结构称为pre-miRNA。随后,pre-miRNA被一个细胞核转运蛋白exportin5(EXP5)转运到细胞质中。来到细胞质的pre-miRNA会被细胞质中另一种核酸内切酶Dicer切第二刀,形成一个22nt左右的双链RNA。
需要特别说明的是,在miRNA的加工成熟中会发生一个链选择(strandselection)的过程:选择哪一条链被保留在RISC中去行使功能,哪一条链被丢弃。这个选择的基本原则是:两条链里,5’端双链相对更不稳定的那一条链倾向于被保留,而另一条链则会被丢弃然后降解。当然,这一规则并不严格,导致有的双链的两条链都可能被保留下来,这种时候需要在miRNA的序号后面加上5p或者3p加以区分。
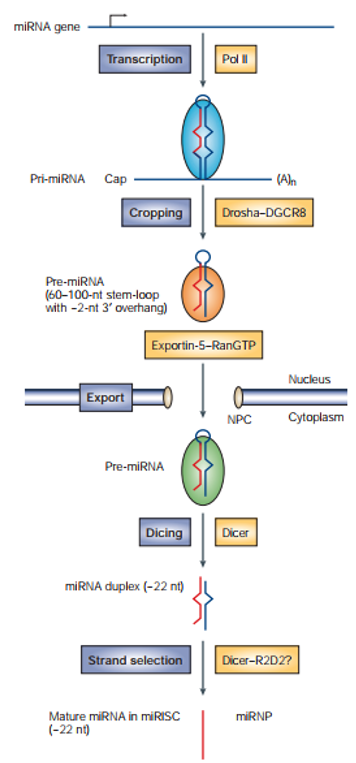
图3. miRNA的加工成熟途径
miRNA是一类在进化上非常保守的基因,55%的线虫miRNAs在人体内有同源分子,提示miRNA在进化上有重要意义,并且有着重要的生物学功能[9]。约有40%的miRNA的基因位于编码蛋白基因的内含子区域(内含子miRNA),与宿主基因(hostgene)共享启动子和调节元件。约50%的miRNA拥有独立的非编码转录本,其中约40%位于这些转录本的内含子区域,10%位于外显子区域。
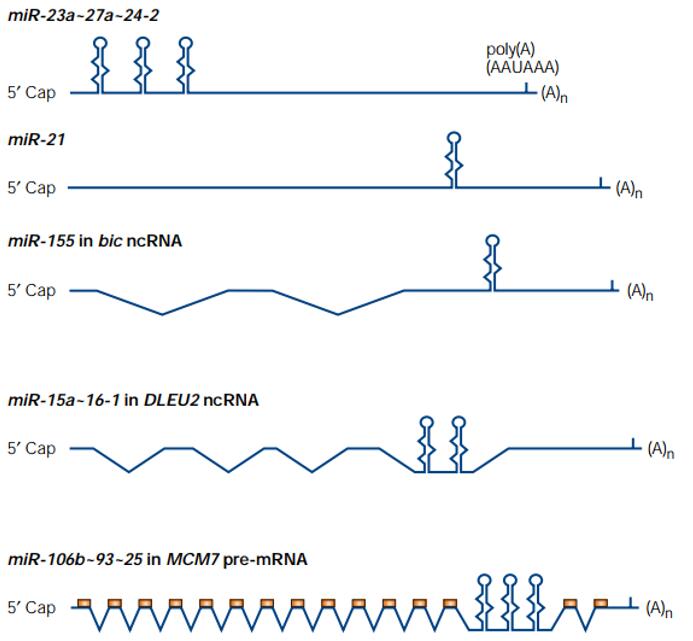
图4. 五种pri-miRNA的结构
当miRNA被装载到RISC复合物中后,便可以发挥其基因表达调控的作用。miRNA会通过其种子序列(5 ’端第2-8位核苷酸)识别靶基因mRNA 3’UTR上的结合位点,携带RISC发挥作用。miRNA的作用效果主要有三种:转录抑制(transcriptional repression),mRNA的切割或降解(mRNA cleavage or degradation)。
转录抑制涉及到一个重要的蛋白GW182。RISC有两个核心组件:AGO蛋白和AGO结合蛋白GW182。GW182可以通过N端的GW结构域结合AGO蛋白,而它的C端的沉默结构域(silencing domain)可以形成一个大的平台用以招募其它辅助蛋白,比如PABP、CCR4-NOT等。通过这些结合蛋白,可以在两个层面抑制mRNA的翻译。第一可以在转录起始之前,抑制40S核糖体小亚基和60S核糖体大亚基结合成80S的核糖体,从而阻止翻译的起始。第二可以在翻译延伸阶段,阻止核糖体的前进,导致翻译终止[10]。
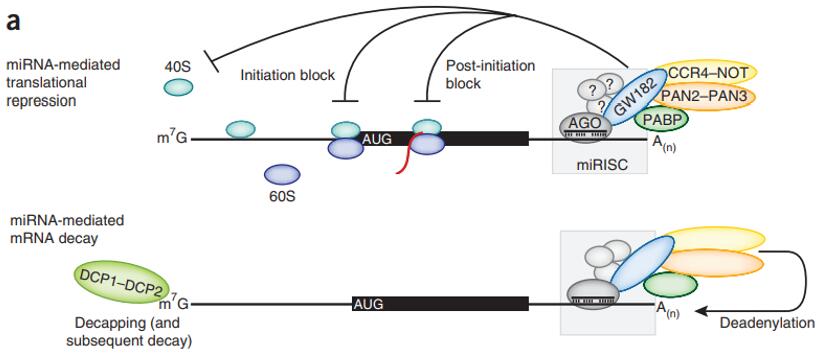
图5. miRNA影响mRNA的三种方式
第二种影响mRNA水平的作用方式是miRNA介导的mRNA切割,但这种调节方式在动物中并不常见。因为动物体内的miRNA一般与靶基因匹配程度不高(除种子序列之外),而mRNA的切割需要miRNA与靶基因尽可能地完美匹配。切割作用的执行者是AGO蛋白。哺乳动物有四种AGO蛋白,分别是AGO1-4,其中有切割功能的只有AGO2。由于miRNA装载到四种AGO蛋白的概率一致,所以要发生切割mRNA的反应,必须满足两个条件:miRNA被AGO2包裹并且能与靶基因很好的配对。
第三种影响mRNA水平的作用方式是 miRNA 介导的mRNA降解,这可能是miRNA 造成 mRNA 水平降低的主要方式。如图5所示,当mRNA的正常转录受到抑制时,可能引发mRNA的脱帽、脱尾反应,然后引起mRNA从5’端或者3’端开始降解。
关于miRNA在mRNA上的结合位置,主要认为是在3’ UTR上。但是后来的研究表明,有的miRNA也能结合到5’ UTR甚至CDS区上行使功能[11,12]。目前综合已有的证据来说,结合到5’ UTR的miRNA常常起到翻译激活的作用,这有可能是RISC复合物“撑”开了折叠的mRNA,方便负责翻译的起始因子或核糖体的进入。而结合到CDS区的miRNA则跟结合到3’ UTR的经典负调控方式相同。比如Tay等人找到多个miRNAs可以结合到Nanog、Oct4和Sox2的CDS区,并且抑制这些蛋白的表达[12]。
另外,关于 miRNA 的作用场所主要在细胞质,也有报道在细胞质加工成熟的miRNA可以重新进入细胞核发挥调节作用。
miRNA行使功能主要依靠上述方式抑制下游基因表达,以这种间接方式来实现对生理病理状态的调节。据估计,miRNA能调节人类近1/3的基因。而一个基因往往受到数个甚至数百个miRNA的调控(而这些估计主要是基于miRNA通过种子序列结合到靶基因 mRNA的3’ UTR这一基础,如果考虑不同的结合序列以及不同的结合位点,这一数字将更为可观)。因此,miRNA的基因调控作用将是一个复杂的网络状结构,如图6所示[13]。
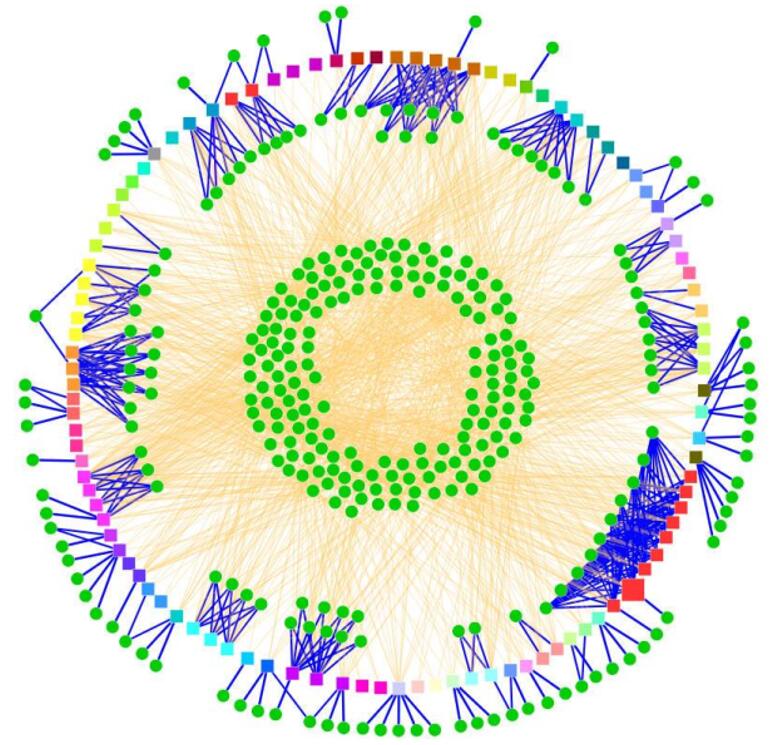
图6. miRNA调控网络示意图
这样的结构会带来两个结果:首先一个miRNA的功能将非常广泛,通过直接或者间接的调控,可以影响到很多生物学功能;而不同miRNA之间的相互配合又可以加强这种效果。但是,这样又会造成 miRNA 功能的稀释,使得每一个具体靶点能受到某个miRNA的影响可能会变得很小;而不同miRNA之间也可能存在功能的抵消。又如图7所示[14],作者区分了三类miRNA的靶点:“switch targets”、“tuning targets”以及“neutral targets”。其中 miRNA对于switch targets作用很强,抑制效率很高,为的是使这些靶点的表达维持在很低的水平。这些基因往往是特定时期需要表达的基因,一旦异常表达,危害很大。miRNA对于tuning targets只有较弱的抑制效果,为的是使这些靶点表达在一个合适的范围内,既不太高也不太低。miRNA对于neutral targets作用不明显,这些基因类似于管家基因,倾向于避免miRNA的调控。
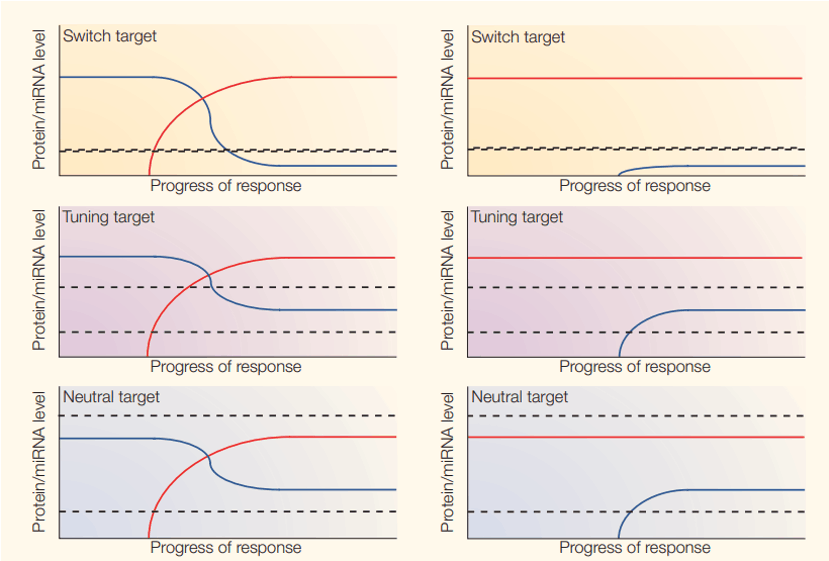
图7. miRNA和靶点调控关系的不同类型
miRNA的功能涉及到各种生理病理过程,包括:发育过程调节、抵抗病毒入侵、动物免疫功能调节、各器官/系统疾病以及肿瘤等。
1. miRNA与发育
miRNA最初就是在研究线虫发育过程中被发现的[15]。第一个miRNA,也是miRNA 调节发育过程的经典案例就是lin-4对它的靶基因lin-14的调节。除了lin-4,在线虫发育过程中还有许多miRNA参与,包括著名的let-7,miR-48,miR-84和miR-241等等。Dicer酶敲除的小鼠在发育的第7.5天会死亡,提示miRNA在发育中有重要作用。
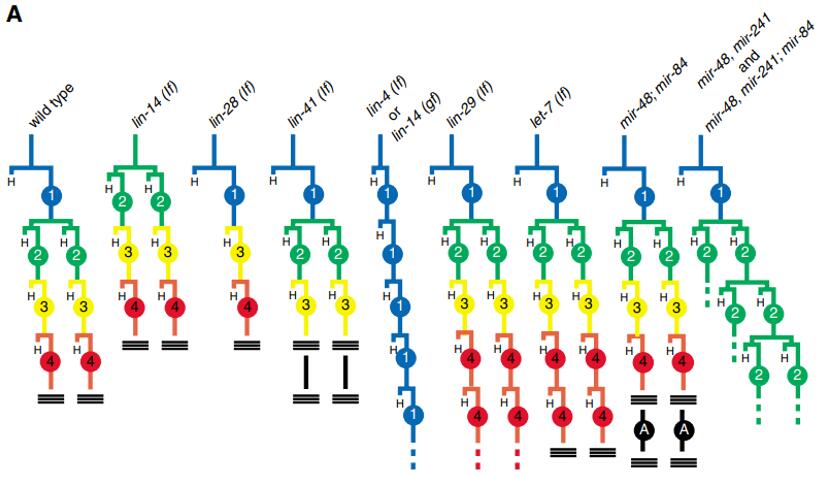
图8. 线虫发育过程中miRNA控制发育时序
2.miRNA与病毒
在长期进化过程中,有的miRNA发展出抵抗病毒入侵的功能。而作为对手,某些病毒也进化出自己的miRNA系统或者学会利用宿主现成的miRNA系统,来帮助自己感染、增殖或者潜伏。miR-122是肝特异性表达的一种miRNA,它在抵抗HBV中有重要作用。miR-122可以直接结合到HBV的前基因组RNA上,抑制HBV的复制与翻译。然而,miR-122却能结合到HCV RNA的5’ UTR,促进HCV的增殖。另外,还有的病毒本身可以编码miRNA,然后在宿主细胞内调节自身病毒基因或者宿主基因表达。
3. miRNA在代谢方面的作用
人体代谢反应的正常进行是生命活动得以发生的保障。miRNA在这一重要生命活动中也发挥着多种多样的重要功能。上文提及的肝脏特异性miRNA—miR-122是第一个发现与代谢调控有关系的miRNA,它可以调节肝脏胆固醇和脂质的代谢。在另一项研究里,在高脂喂食的肥胖小鼠里下调miR-122后,小鼠肝脏胆固醇和脂肪酸的合成减少,脂肪的β氧化增加,循环系统的胆固醇和甘油三酯也发生减少,脂肪肝情况有所改善。另外,miRNA在胰岛素和糖代谢方面也有重要作用,miRNA还可能调节胰岛的发育,miRNA也参与脂肪细胞的生成和功能调节。
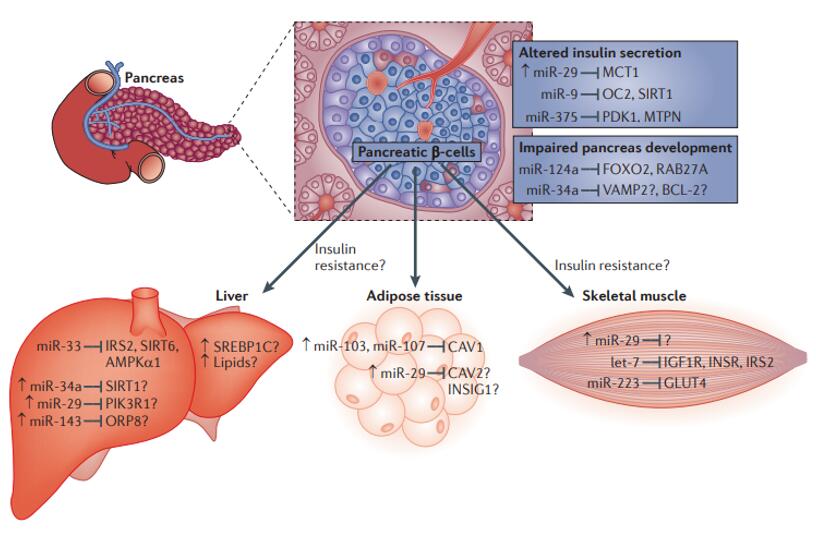
图9. miRNA参与胰岛素信号和葡萄糖代谢的调控
4. miRNA与肿瘤
miRNA参与了各种生命活动的调节,尤其在肿瘤发生发展中有很重要的作用。在肿瘤发生发展的每个环节,都有多种miRNA的参与[16]。如图10所示,在结肠癌中,miRNA的调控发生在肿瘤的增殖、凋亡、侵袭迁移、血管形成、能量代谢和免疫逃逸等各个方面。在肿瘤发生发展的不同阶段,肿瘤细胞和患者血清中的miRNA表达谱都会发生特异的变化,可以用于疾病的诊断、预后及药物效果的评估。
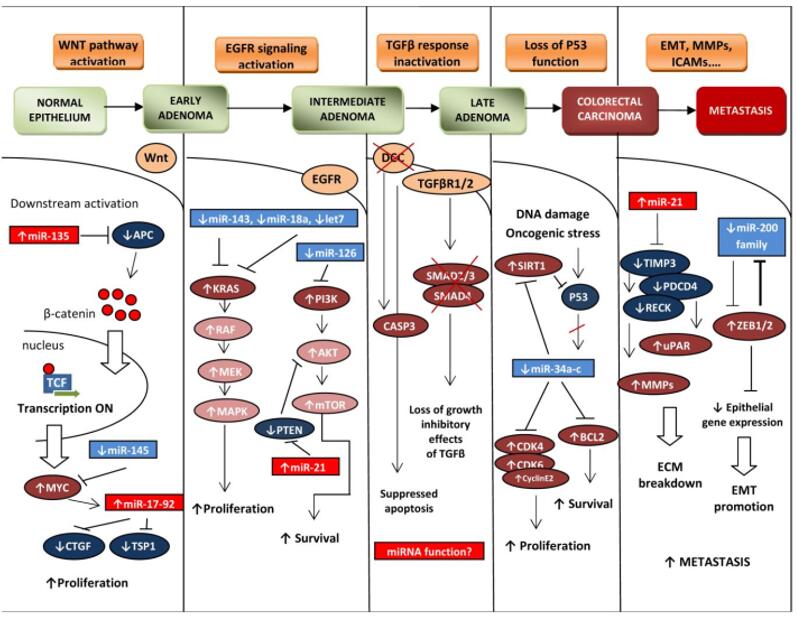
图10. miRNA参与胰岛素信号和葡萄糖代谢的调控
miRNA作为基因表达调控的重要开关,能参与几乎所有生理病理活动。研究miRNA的时候,找到合适的研究miRNA的gain of function或者loss of function是必要的,这将对于我们理解生理病理活动、开发应用miRNA提供巨大帮助。
1. mimic/inhibitor
实验室细胞实验最常使用的,当属miRNA的mimic和inhibitor了。miRNA的mimic和inhibitor是人工合成的RNA oligos,其中mimic是双链,inhibitor是单链。mimic两条链的3’端各带2nt的悬垂碱基TT,其余序列完全互补,模拟天然经Dicer酶切割后的miRNA双链;瞬转入细胞,可以提高miRNA的含量。而inhibitor则是与相应miRNA完全互补的单链,瞬转入细胞,可以结合细胞内的miRNA,从而达到封闭miRNA的目的,解除对靶基因的抑制。
但是这种方法也存在一定的局限性,瞬转mimic提高了miRNA的含量达数十到数千倍之多,可能会造成结果的不准确性;另外,inhibitor并不能降低miRNA的表达,只是封闭了miRNA的功能,对检测上有一定的难度。而有的功能可能需要较长时间段的miRNA含量改变才能表现出来,这时候,稳转的方法改变miRNA的含量就显得有了优势。
2. agomir/antagomir
agomir/antagomir是在mimic和inhibitor基础上,3’端增加了硫代膦酸和胆固醇的修饰,而每一个核糖也进行了2’-O甲基化修饰,提高了稳定性,也可以被用于体内实验。但上述局限性仍然存在。
3. 质粒/病毒载体
使用质粒载体表达产生pri-miRNA或者pre-miRNA,然后经切割产生成熟的miRNA。这种方法的优点在于模拟了天然miRNA的成熟途径,经过一系列细胞内的加工过程,使成熟的miRNA能有效地装载到RISC中发挥作用。除此之外,还可以直接做成熟体的过表达,但其因为不是天然的结构,可能会存在不能正确剪切的可能。质粒载体再经过病毒包装的步骤包出来病毒,就可以用在包含体内实验和体外实验等不同的实验过程中。
做miRNA封闭呢,也可以用质粒或者病毒载体做。目前常用的有miRNA sponge技术和miRNA antago技术。miRNA sponge是利用miRNA-mRNA的相互作用,设计出带有串联排列的miRNA结合位点的质粒载体,作为分子海绵吸附相应miRNA,解除对其靶基因的抑制。miRNA antago技术也是利用miRNA-mRNA的相互作用,但只设计含有一个miRNA结合位点的质粒载体。跟sponge比较,antago封闭miRNA的功能比较弱,正常情况下优先选择miRNA sponge。
4. miRNA的敲除调控
针对于编码基因的敲除,非3倍数碱基的插入/缺失会导致移码突变,编码提前终止等现象,实现编码基因的敲除,但这些通过影响编码基因正确编码的手段并不能对包含miRNA在内的非编码RNA达到敲除效果。因此,要想实现miRNA的敲除,则需要在基因组上对miRNA的上下游各设计sgRNA,通过片段敲除的方式,实现miRNA敲除[17]。
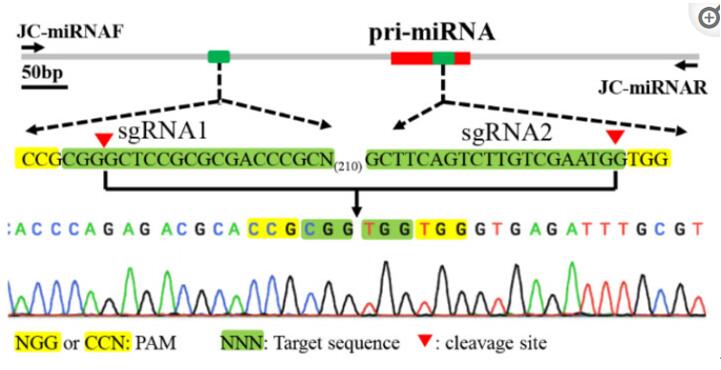
图11. 使用cirspr/cas9技术敲除miRNA
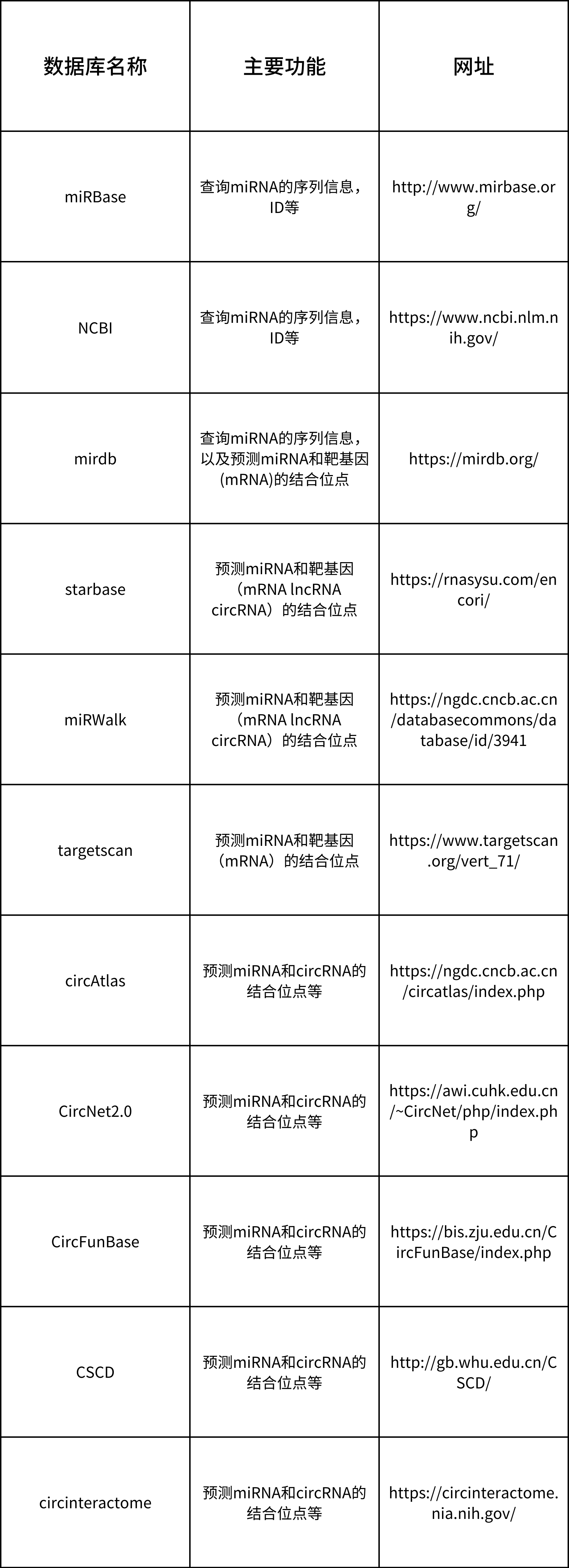
做miRNA的研究,通过数据库进行信息查询或预测相关功能是必不可少的,下面是一些miRNA研究常用到的数据库,可以查询miRNA的基因信息、互作靶点等相关信息(表1)。
表1. miRNA常用数据库汇总
本期内容从miRNA的发现和命名,结构,作用机制,功能以及调控等几个方面对miRNA进行了详细的介绍,希望能对研究miRNA的小伙伴有所帮助,有兴趣可以根据这些知识点深入拓展哦。汉恒生物可以提供各种形式的基因过表达和干扰载体的构建、病毒载体的包装,还可以提供miRNA与靶基因互作的双荧光素酶验证等服务,欢迎有意向的小伙伴与我们联系。到此,我们关于非编码RNA的介绍到这里就告一段落了,下期干货将为大家推送特异性基因表达调控干货知识,敬请期待!
参考文献
[1] Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998, 391:806-811.
[2] Lee RC, Feinbaum RL, Ambros V: The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993, 75:843-854.
[3] Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, Horvitz HR,Ruvkun G: The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature 2000, 403:901-906.
[4] Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T: Identification of novel genes coding for small expressed RNAs. Science 2001, 294:853-858.
[5] Lau NC, Lim LP, Weinstein EG, Bartel DP: An abundant class of tiny RNAs with probable
regulatory roles in Caenorhabditis elegans. Science 2001, 294:858-862.
[6] Lee RC, Ambros V: An extensive class of small RNAs in Caenorhabditis elegans. Science 2001, 294:862-864.
[7] Griffiths-Jones S: The microRNA Registry. Nucleic Acids Res 2004, 32:D109-111.
[8] Kim VN: MicroRNA biogenesis: coordinated cropping and dicing. Nat Rev Mol Cell Biol 2005, 6:376-385.
[9] Ibanez-Ventoso C, Vora M, Driscoll M: Sequence relationships among C. elegans, D. melanogaster and human microRNAs highlight the extensive conservation of microRNAs in biology. PLoS One 2008, 3:e2818.
[10] Fabian MR, Sonenberg N: The mechanics of miRNA-mediated gene silencing: a look under the hood of miRISC. Nat Struct Mol Biol 2012, 19:586-593.
[11] Orom UA, Nielsen FC, Lund AH: MicroRNA-10a binds the 5’ UTR of ribosomal protein mRNAs and enhances their translation. Mol Cell 2008, 30:460-471.
[12] Tay Y, Zhang J, Thomson AM, Lim B, Rigoutsos I: MicroRNAs to Nanog, Oct4 and Sox2 coding regions modulate embryonic stem cell differentiation. Nature 2008, 455:1124-1128.
[13] Huang JC, Babak T, Corson TW, Chua G, Khan S, Gallie BL, Hughes TR, Blencowe BJ, Frey BJ, Morris QD: Using expression profiling data to identify human microRNA targets. Nat Methods 2007, 4:1045-1049.
[14] Bartel DP, Chen CZ: Micromanagers of gene expression: the potentially widespread influence of metazoan microRNAs. Nat Rev Genet 2004, 5:396-400.
[15] Alvarez-Garcia I, Miska EA: MicroRNA functions in animal development and human disease. Development 2005, 132:4653-4662.
[16] Rottiers V, Naar AM: MicroRNAs in metabolism and metabolic disorders. Nat Rev Mol Cell Biol 2012, 13:239-250.
[17] Yayun Zuo, Zeyu Wang, Xuan Ren, Yakun Pei, Ahmed A. A. Aioub, and Zhaonong Hu: A Genetic Compensation Phenomenon and Global Gene Expression Changes in Sex-miR-2766-3p Knockout Strain of Spodoptera exigua Hübner (Lepidoptera: Noctuidae). Insects 2022, 13(11): 1075.

查看更多

查看更多

查看更多

联系我们

返回顶部