查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
非酒精性脂肪肝病(Non-alcoholic fatty liver disease, NAFLD)是指除酒精和其他明确的肝损害因素所致的,以肝脏脂肪变性为主要特征的临床病理综合征。包括非酒精性脂肪肝(也称单纯性脂肪肝)、非酒精性脂肪性肝炎、肝硬化和肝细胞癌,是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性损伤,与肥胖、糖尿病、高血压、高胆固醇和代谢综合征等代谢性疾病高度相关。NAFLD通常以胆汁酸(Bile acid,BA)稳态破坏为特征,然而,某些BA在NAFLD中的确切作用还知之甚少。猪去氧胆酸(Hyodeoxycholic acid, HDCA)是猪胆中一类重要的胆汁酸,已经被证实具有降低胆固醇和改善糖稳态的作用,但是在NAFLD中的作用还未被报道。
2023年9月6日,上海中医药大学中药学院李后开、盛丽莉联合曙光医院胡义扬及中国科学院上海药物研究所谢岑课题组在《Nature Communications》(IF=16.6/Q1)杂志上发表了名为“Hyodeoxycholic acid ameliorates nonalcoholic fatty liver disease by inhibiting RAN-mediated PPARα nucleus-cytoplasm shuttling”的研究论文,该研究揭示了HDCA通过直接与RAN蛋白相互作用来促进PPARα的核定位,进而靶向抑制RAN/CRM1/PPARα异源三聚体的形成,从而治疗NAFLD的新机制。
值得注意的是,在本研究中,作者使用了汉恒生物提供的AAV2/8-TBG-Cre和AAV2/8-TBG-ZsGreen病毒,成功获得了肝组织特异性PPARα敲除的小鼠。
在此项研究中,作者利用靶向代谢组学检测了健康人和NAFLD患者血清胆汁酸谱(HDCA、GHDCA、HCA、GHCA、THCA),发现NAFLD患者血清中HCA类胆汁酸(HDCA、GHCA、THCA)水平显著低于健康对照人群,且HDCA和GHCA水平与NAFLD临床指征显著负相关。此外,作者通过高脂高糖饲养获得NAFLD小鼠,研究结果发现NAFLD小鼠血清、肝脏和不同肠内容物中HCA类胆汁酸水平显著低于健康小鼠,并且HDCA在NAFLD小鼠血清和NAFLD患者血清中含量保持一致性,均低于正常对照。另外,研究发现血清HDCA的水平与肝脏重量、肝脏甘油三酯(TG)、血清 ALT 和 AST 呈负相关,由此表明,在人和小鼠中,血清HDCA水平与肝脂肪变性成负相关,提示膳食补充 HDCA 可能对NAFLD 具有保护作用。
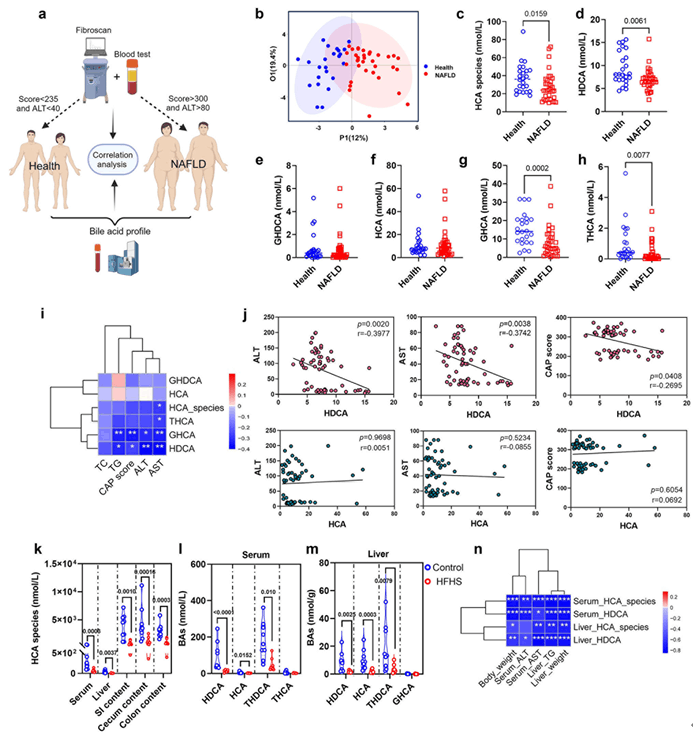
图1 NAFLD患者和饮食诱导的NAFLD小鼠血清HDCA水平降低
为了探究HDCA是否能改善NAFLD,作者,在NAFLD小鼠的饮食中添加HDCA,发现HDCA能够减轻NAFLD小鼠体重、肝脏重量、肝脏脂肪变性、炎症评分以及NAFLD活动度评分(NAS),但是,并不影响小鼠总能量的摄入。此外,饮食中补充HDCA也降低了NAFLD小鼠肝脏TG,血清ALT和AST水平,并逆转了由饮食诱导的肝脏炎症因子的高表达及改善了NAFLD小鼠体内的葡萄糖平稳态。由此表明,饮食中添加HDCA可以显著改善NAFLD及各种代谢异常。
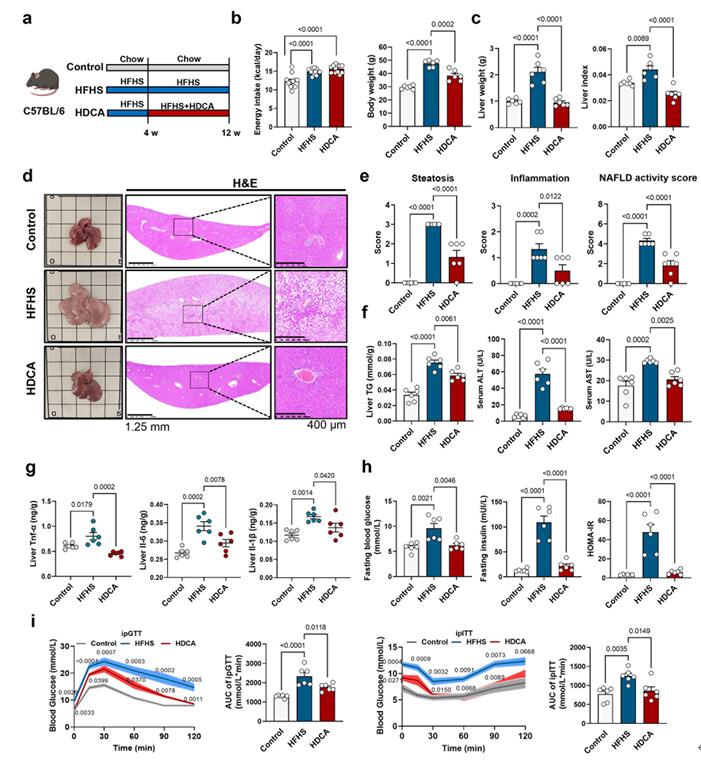
图2 补充HDCA改善NAFLD
为了进一步探究HDCA改善NAFLD的作用机制,作者利用串联质谱分析了小鼠肝组织的蛋白质组学特征。对照组(正常小鼠)和模型组(NAFLD小鼠)中共筛选到1190个差异蛋白质,模型组和治疗组(HDCA处理)中共筛选到623个差异蛋白质(P<0.05,大于1.2倍),有430个差异蛋白重叠,其中420个蛋白的表达被HDCA逆转。对420个差异蛋白进行KEGG分析,差异蛋白主要富集在代谢、氧化磷酸化、NAFLD和PPAR信号通路中,与肝脏脂肪酸代谢密切相关。脂肪酸代谢相关蛋白热图显示,大多数脂肪酸氧化(Fatty acid oxidation,FAO)相关蛋白在模型组组中表达下调,在治疗组中表达上调。
接着,作者对小鼠肝组织进行了转录组学分析,在对照组和模型组中共筛选到2039个差异基因,模型组和治疗组中共筛选到1121个差异基因(P<0.05,大于2倍);有769个差异基因重叠,其中762个基因的表达被HDCA逆转。对762个差异基因进行KEGG和GSEA分析,KEGG分析显示差异基因主要富集在视黄醇代谢、类固醇激素合成、脂肪酸降解以及PPAR信号通路;GSEA分析显示HDCA组(治疗组)中差异基因主要富集在FAO和PPARα靶基因。另外,研究结果显示,HDCA显著抑制脂肪酸摄取蛋白CD36的表达,但激活了细胞内脂肪酸结合蛋白1(FABP1)和肉碱棕榈酰转移酶2(CPT2)的表达,导致脂肪酸向线粒体的运输增加;此外,5种关键的β氧化酶(ACADL、ACADVL、HADHA、HADHB和ACAA2)在HDFA干预后表达均上调,以及酮生成的限速酶HMGCS2的表达也被HDFA促进;由此推测,HDFA的抗NAFLD作用主要与活化肝细胞脂肪酸氧化信号通路有关。
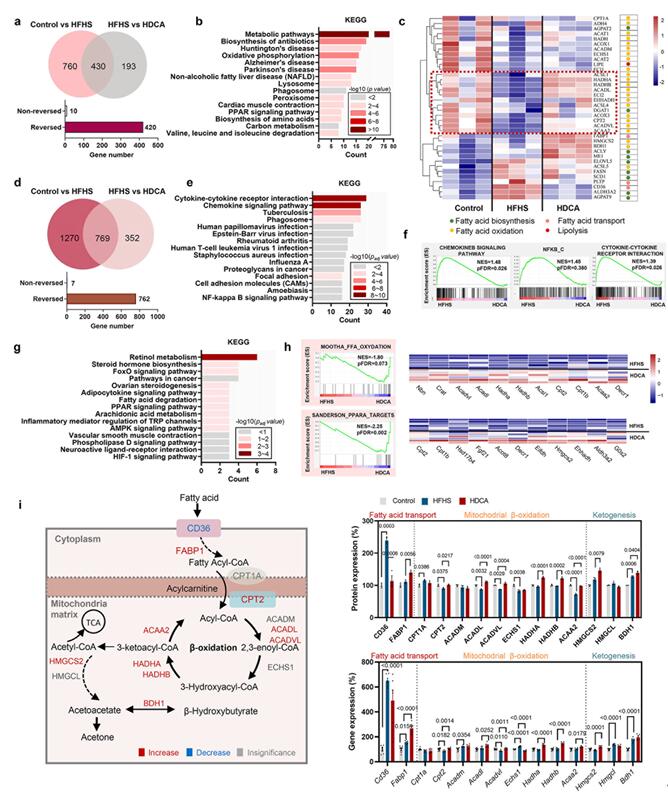
图3 HDCA激活肝细胞脂肪酸氧化
PPARα是脂肪酸氧化的关键调节因子,触发核内脂肪酸氧化相关基因的转录。WB检测结果显示HDCA摄取不影响PPARα蛋白的总含量,但是能够促进PPARα的入核;而模型组中PPARα蛋白的入核被抑制;同时,与蛋白质组学数据一致,HDCA组中PPARα靶标蛋白如FABP1、CPT2和HMGCS2的蛋白表达显著升高,CD36的表达显著降低。此外,HDCA能够减轻炎症。为了进一步探究HDCA能否直接调控PPARα的核定位,作者用2种不同剂量的HDCA处理AML12细胞,研究结果显示,HDCA呈剂量依赖性的调节PPARα的入核,同时促进了CPT1、CPT2以及FABP1的表达,但是不影响PPARα的总表达量。与此同时,HDCA降低了AML12细胞和RAW264.7细胞中趋化因子和细胞因子的表达,这表明HDCA具有抗炎作用;综上表明HDCA能促进PPARα的核定位,并且通过激活PPARα介导脂肪酸氧化和抑制炎症。
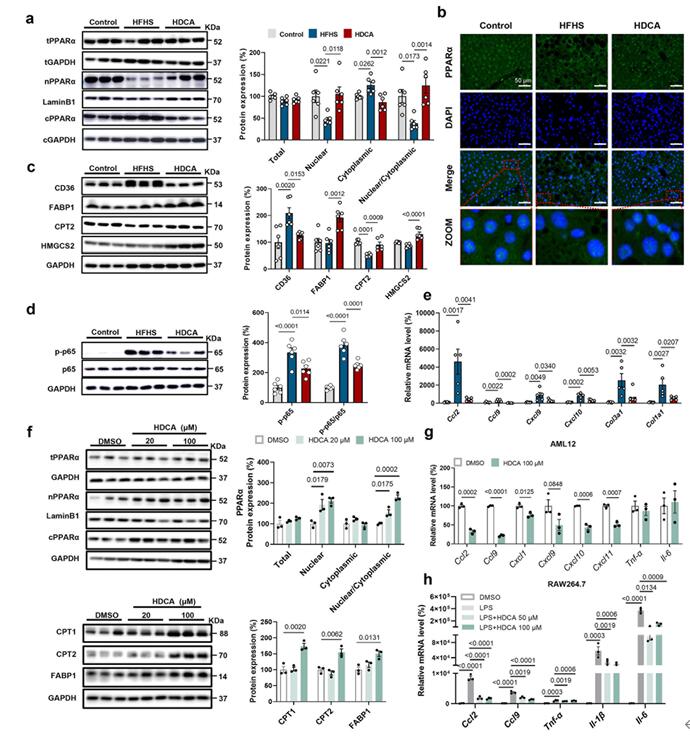
图4 HDCA促进PPARα的核定位和PPARα靶基因的表达
接着,作者构建了PPARα敲除小鼠进一步探究HDCA的抗NAFLD保护作用是否依赖于PPARα。与野生NAFLD小鼠比较,HDCA干预未能改善PPARα-/-小鼠的NAFLD相关指标,如体重、肝脏TG、肝脏脂肪变性评分和NAS;并且HDCA没有改变PPARα-/-小鼠体内FABP1、CPT2和HMGCS2的表达以及肝脏炎症因子(TNF-α、IL-6、IL-1β)的水平。为了进一步确认HDCA抗NAFLD的保护作用依赖于肝脏PPARα,作者通过在PPARαfloxp/floxp小鼠体内注射AAV2/8-TBG-Cre病毒,构建了肝脏特异性PPARα敲除的小鼠;与PPARα全身敲除小鼠的研究结果相似,HDCA干预未能改善PPARα肝脏特异性敲除的小鼠的NAFLD相关指标以及相关基因的表达;由此提示HDCA的抗NAFLD作用依赖于肝脏PPARα的表达。
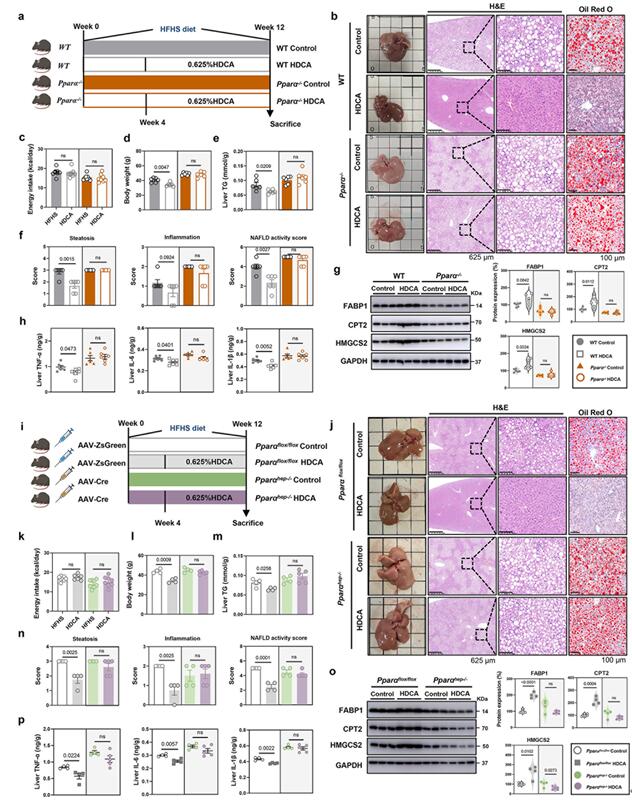
图5 PPARα缺陷消除HDCA介导的抗NAFLD作用
法尼酯X受体(Farnesoid X receptor, FXR)是全身能量代谢的关键调节器,FXR-SHP通路是肝脏调节胆汁代谢的关键通路。双荧光素酶结果显示,HDCA能够轻度激活HEK293T细胞中FXR的转录活性;此外,HDCA能促进AML12细胞中SHP基因的表达;但是,FXR拮抗剂并不影响HDCA对PPARα的核定位以及PPARα靶基因的促进作用。由此表明,HDCA对PPARα的作用并不依赖于FXR。之后,作者通过在细胞中加入异丙硝唑(IPZ)阻断了PPARα的核输入,导致细胞质中PPARα的积累,而在IPZ存在的情况下,HDCA仍然能够促进核PPARα的积累,但是在细胞中加入莱普霉素B(LMB)(一种出核转运抑制剂)后,HDCA不能促进核PPARα的积累,由此表明,HDCA主要是通过抑制PPARα的出核而不是入核影响PPARα的核定位。此外,HDCA能显著增加细胞核中出核受体CRM1的表达,而降低细胞质中CRM1的表达(细胞内总量不发生变化),这一实验结果也在体内水平得到验证。以上实验结果表明,HDCA通过抑制CRM1介导的核输出过程来促进PPARα的核定位。
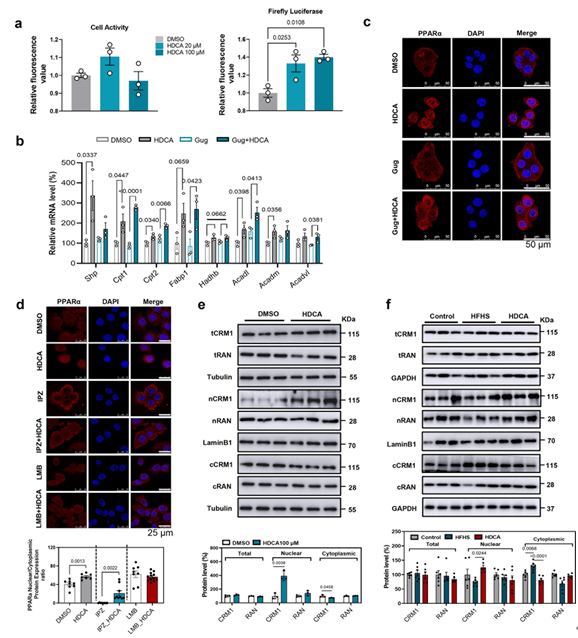
图6 HDCA以不依赖FXR的方式抑制PPARα的核输出
为了探究HDCA介导的PPARα核积累的分子机制,作者利用蛋白质组学筛选了参与核转运与HDCA结合的潜在蛋白质,筛选结果显示HDCA与RAN结合,而不是与CRM1和PPARα结合;接着,作者通过细胞热转移实验(CETSA)证实了HDCA与RAN的直接相互作用;之后作者利用免疫共沉淀、邻位连接技术以及分子对接等技术对HDCA/RAN/CRM1/PPARα四者之间的关系进行了验证,实验结果显示HDCA通过与肝细胞内RAN蛋白(属于小G蛋白家族)结合,进而干扰RAN和出核转运蛋白CRM1的结合,从而抑制RAN/CRM1/PPARα异三聚体的形成,抑制PPARα出核,增加肝细胞核内PPARα蛋白含量。
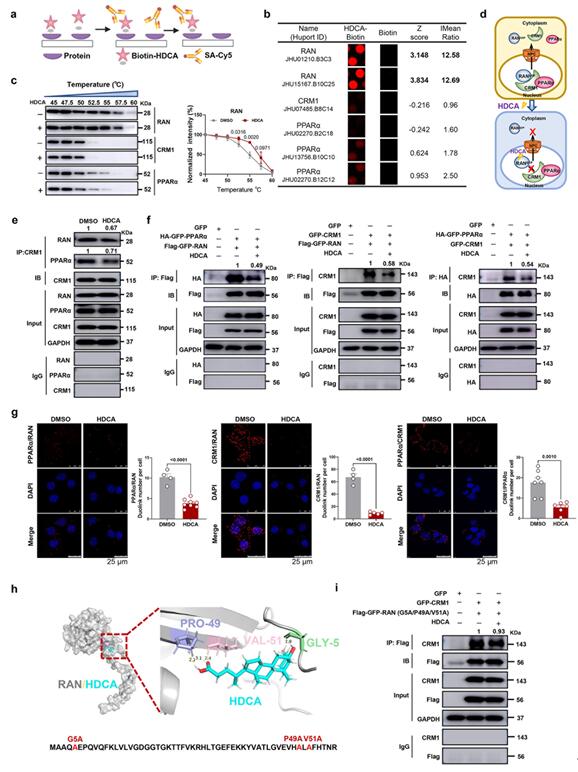
图7 HDCA直接与RAN结合以抑制RAN/CRM1/PPARα输出异三聚体的形成
综上所述,该研究阐明了HDCA抵抗NAFLD的分子机制,即HDCA进入肝细胞后通过与RAN蛋白直接结合,抑制RAN/CRM1/PPARα异源三聚体的形成,导致核内PPARα的积累。这提示HDCA是一种有前景的NAFLD治疗药物,并且通过靶向PPARα的核定位为对抗NAFLD提供了一种治疗策略。
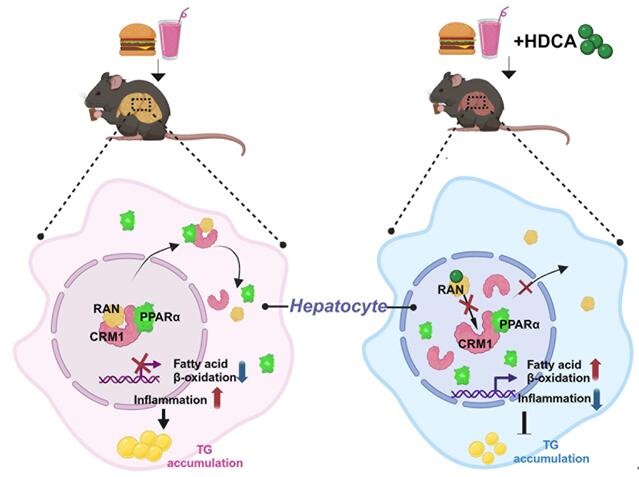
图8 作用机制模式图

查看更多

查看更多
查看更多

联系我们

返回顶部