查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
前几期特异性基因调控干货文章介绍了靶向心血管系统、神经系统、肾脏等组织和器官的基因调控策略,今天我们继续介绍特异性的基因调控。眼睛作为机体观察外界的主要器官,自然也是科研热点之一,而视网膜是眼睛后部的透明感光结构,在成像功能方面起关键作用。本期小恒就为大家详细介绍视网膜研究中的特异性调控策略。

视网膜位于眼球的最内层,由色素上皮层和视网膜感觉层组成,是一层透明的薄膜,因脉络膜和色素上皮细胞的关系,使眼底呈均匀的橘红色。可以将其想象成照相机里的感光底片,专门负责感光成像。外界的画面通过屈光系统落在视网膜上,形成视觉神经冲动,随后画面信息通过视神经被传递至视中枢,最终在我们的大脑中建立起图像。
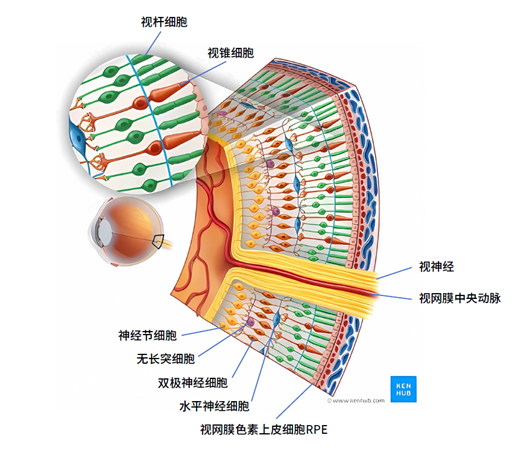
图1. 视网膜结构(图源:www.kenhub.com)
腺相关病毒载体(adeno-associated virus,AAV)安全性高、宿主范围广、免疫原性低、在体感染特异性强,被认为是基因治疗的利器。眼部疾病错综复杂,且由于眼球具有免疫赦免特性,所处位置相对封闭,手术操作空间有限,治疗难度极大,基因治疗的兴起为遗传性眼部疾病(如视网膜色素变性、Leber先天性黑朦症等),病理性眼部疾病(如视网膜病变等),以及其他眼部疾病的治疗带来希望。那么如何用AAV去靶向视网膜细胞呢?本文将详细介绍针对不同种类的视网膜细胞,从特异性血清型和特异性启动子两个方面详细介绍利用AAV载体实现视网膜细胞特异性基因调控的策略,并结合相关案例进行注射方式的介绍,希望能够为做相关研究的老师提供帮助。
一、血清型的选择
重组AAV通过改变包装质粒中的cap基因来改变血清型,使其具有不同的组织趋向性或易感细胞类型。AAV2、AAV5、AAV8、AAV9等野生型的血清型可有效感染视网膜,但为了更高效更特异的的感染视网膜及视网膜穆勒细胞,科学家通过对现有血清型的衣壳蛋白进行改造,研发出了视网膜特异性血清型AAV-anc80L65、AAV-GL和AAV-NN及视网膜穆勒细胞特异性血清型AAV-shH10和AAV-shH10Y。
1、AAV-anc80L65
2018年Livia S. Carvalho等[1]利用系统发育和统计模型对75种灵长类AAV的衣壳蛋白氨基酸序列进行分析,建立了病毒家族的进化树,Anc80是通过祖先序列重建(ASR)推断出的最远进化节点,最终获得三种Anc80变体Anc80L27、Anc80L65、Anc80L121。作者分别在小鼠视网膜下腔注射了AAV2、AAV8以及三种Anc80变体,发现Anc80L27、Anc80L65和AAV8的转导效率较高(图2)。接着作者比较了不同血清型对视锥光感受器的感染效率(图3)、起效时间及作用时长(图4),与其他血清型相比,Anc80L65对视锥光感受器具有更高的亲和力、起效时间最短,在第1天就可见表达,第3天表达量明显上升,表明Anc80L65可准确靶向视网膜且有助于目的基因迅速表达,显示出治疗视网膜相关疾病的巨大潜力。
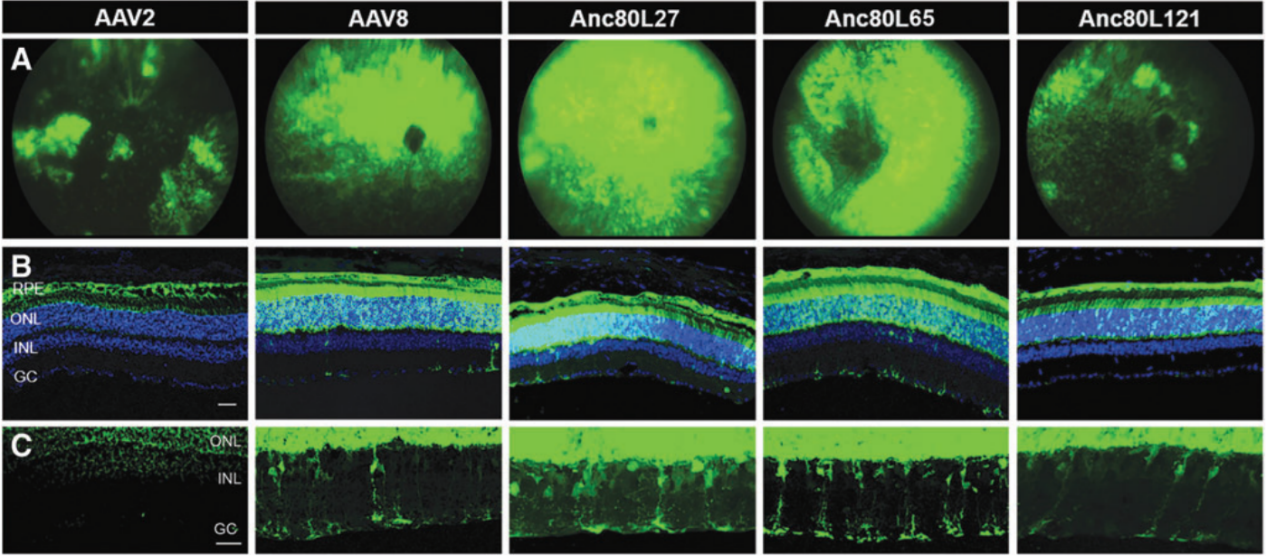
图2. 不同血清型对视网膜的转导效率
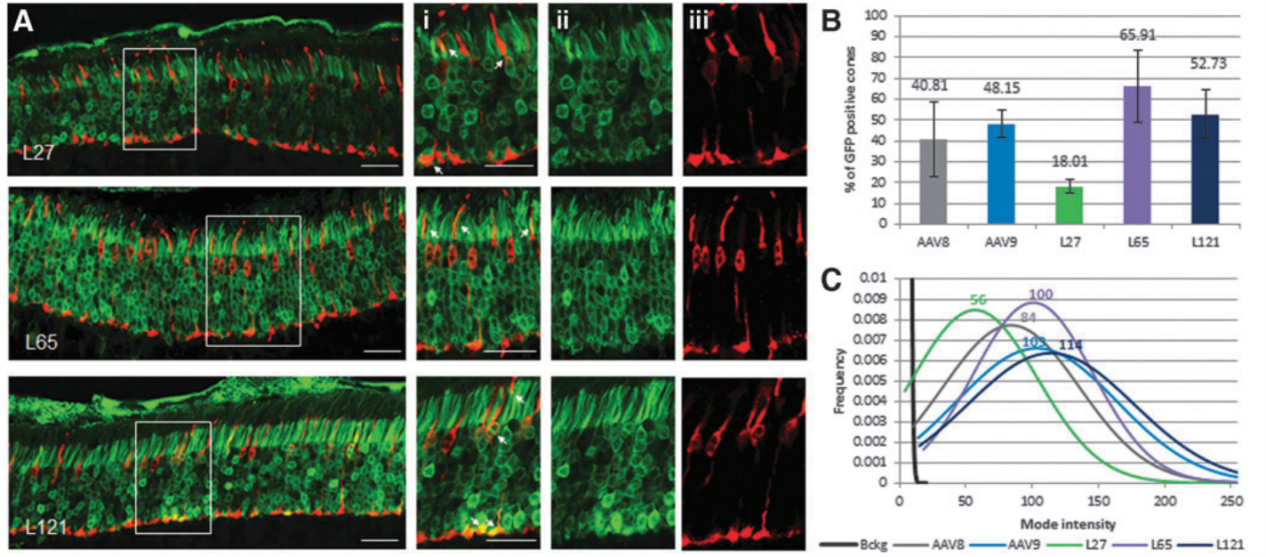
图3. 不同血清型对视锥光感受器的转导效率
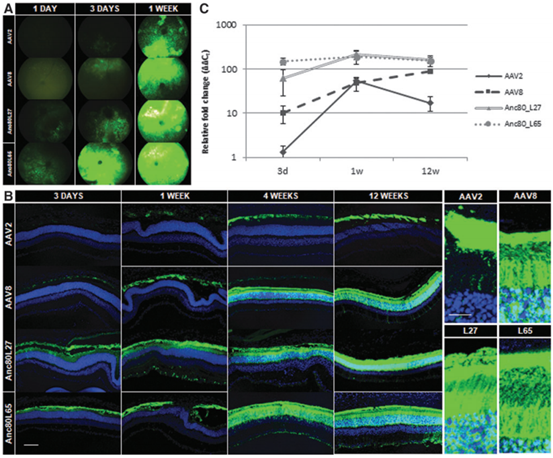
图4. 不同血清型起效时间及维持时长
2、AAV-GL&AAV-NN
2021年Marina Pavlou等[2]在AAV2的基础上改造获得了新的血清型AAV-GL和AAV-NN。作者分别在2月龄的小鼠玻璃体腔注射携带GFP的AAV2、AAV7m8、AAV-GL、AAV-NN。实验结果显示AAV-GL、AAV-NN的感染效率优于AAV2、AAV7m8,且在注射后第一周AAV-NN-GFP在视网膜内的表达量明显高于其他3种血清型。作者也在犬类、灵长类动物和人视网膜外植体中测试了AAV-GL、AAV-NN对视网膜的感染效率,结果显示效果良好(图5)。可见AAV-GL和AAV-NN是研究眼部疾病的潜在强力工具。
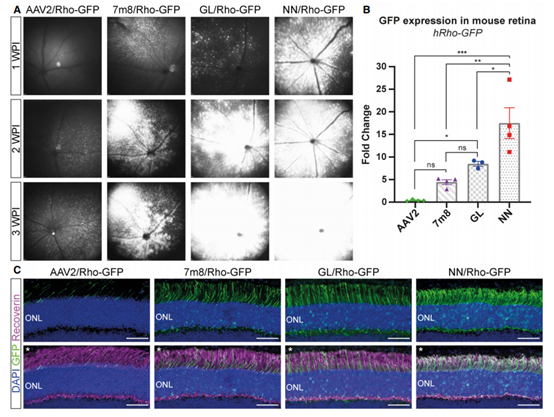
图5. 不同血清型的感染效率
3、AAV-shH10
AAV-shH10血清型主要感染视网膜穆勒细胞,该细胞是哺乳动物视网膜上的主要神经胶质细胞,任何干扰视网膜内环境的因素都会激活穆勒细胞,因此特异性感染穆勒细胞有助于研究视网膜损伤的机制,对视网膜致病的治疗具有重要意义。Ophélie Vacca等[3]研发出了AAV-shH10血清型,研究中作者使用携带Dp71基因的AAV-shH10玻璃体腔注射Dp71缺失小鼠。结果显示ShH10血清型腺相关病毒,能够有效和特异性的在Dp71缺失的小鼠视网膜上靶向穆勒细胞,恢复穆勒细胞中Dp71的表达,从而增加视网膜血管通透性(图6)。
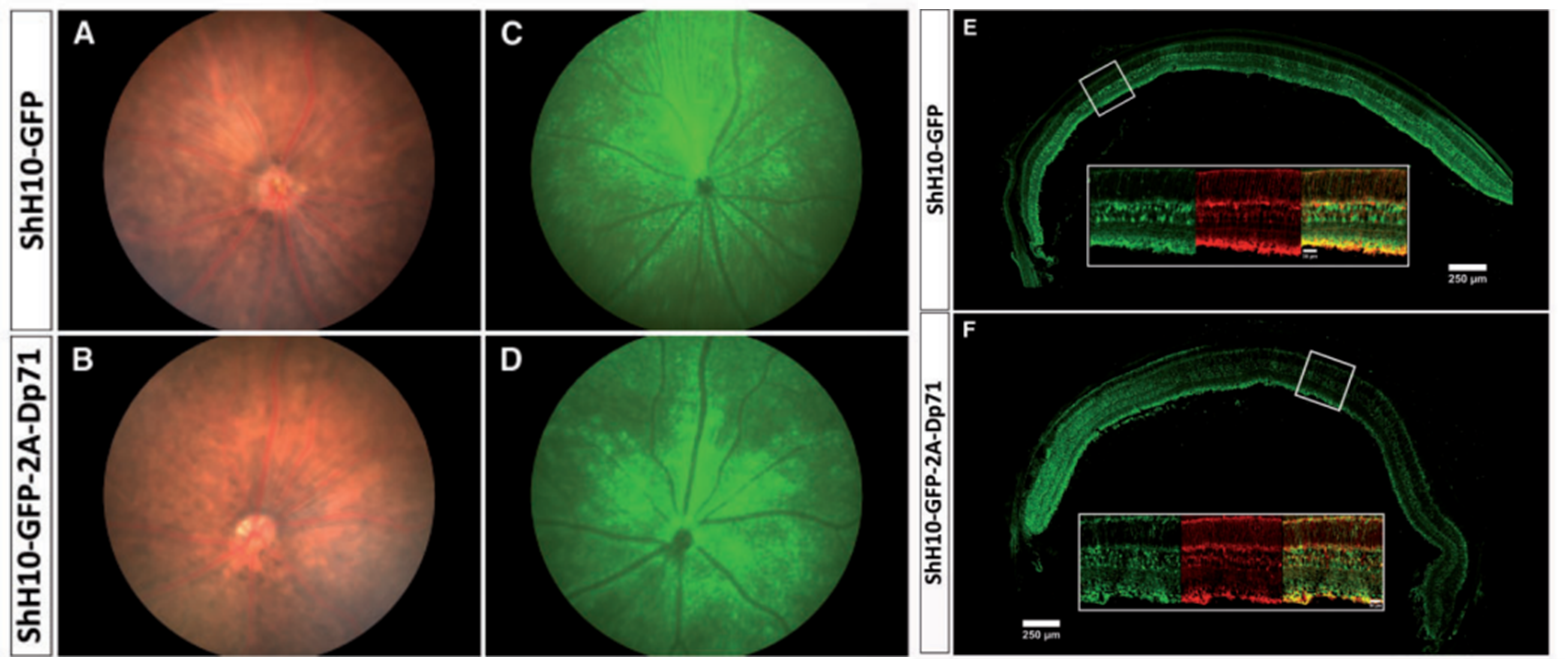
图6. AAV-shH10感染视网膜结果图
4、AAV-shH10Y
除AAV-shH10外,2014年Pellissier[4]在AAV2基础上改造得到的AAV-shH10Y可以更高效的感染视网膜穆勒细胞。研究人员将携带GFP的AAV6、AAV-shH10和AAV-shH10Y三种AAV病毒通过玻璃体腔注射感染小鼠视网膜。结果显示,与AAV6和AAV-shH10相比,AAV-shH10Y感染穆勒细胞的能力更强,在病毒注射总量为109和1010gc的情况下,AAV-shH10Y感染效率在60%以上,且主要在穆勒细胞中表达,特异性较好。
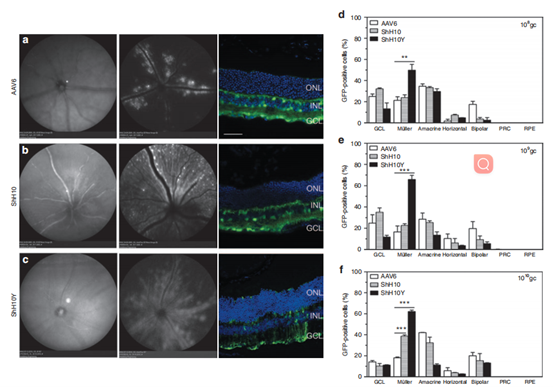
图7. AAV6、AAV-shH10和AAV-shH10Y感染穆勒细胞结果图
表1. 靶向视网膜的特殊血清型
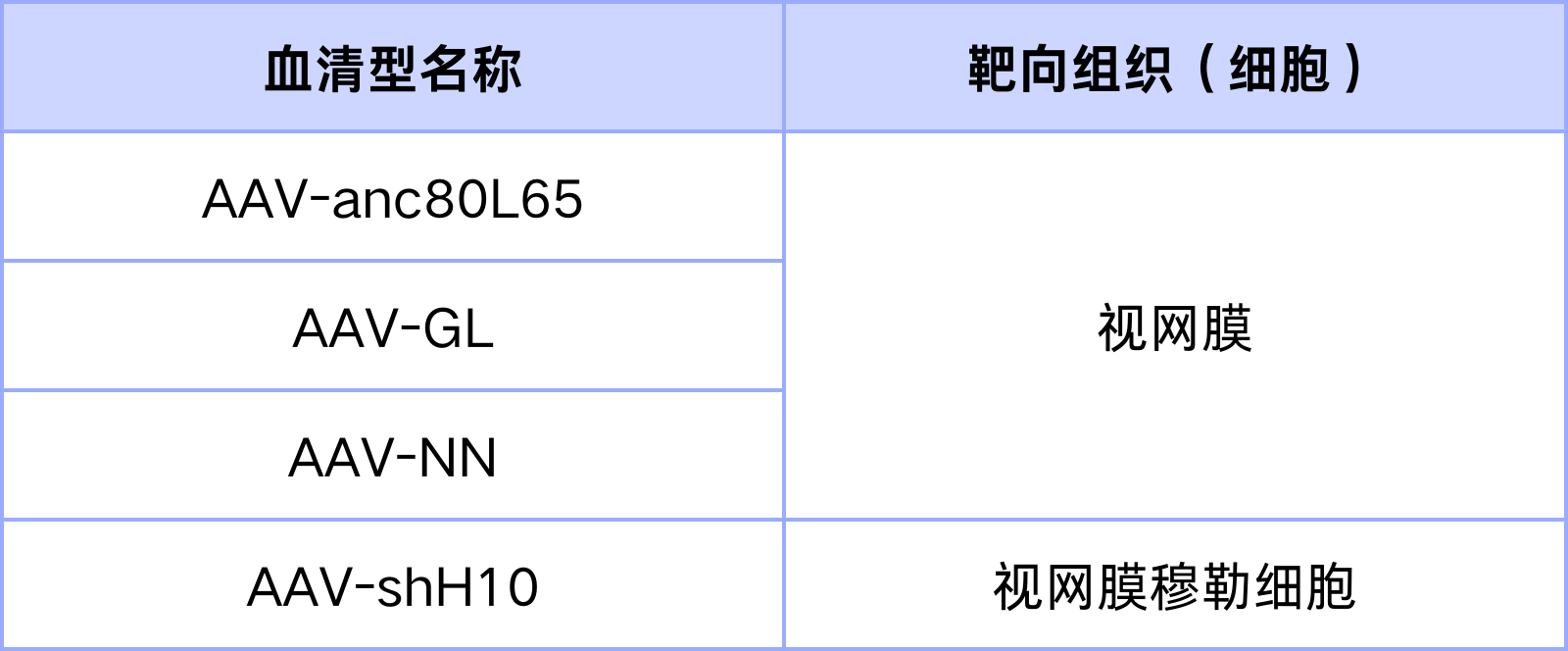
汉恒生物可提供表内的特异性血清型,并有试用装可供试用,欢迎咨询试用。
二、特异性启动子的选择
特异性血清型AAV可以靶向不同组织实现组织特异性感染,然而利用特异性血清型靶向的范围仍然较宽,如果想要在某种特定细胞上实现基因表达调控,还需要搭配特异性启动子一起使用。特异性启动子是指在这类启动子的作用下,基因的表达往往只限于特定的组织细胞,避免了广谱型启动子启动的外源基因在实验动物中非特异性、持续表达所造成的浪费,可增强外源基因的表达效果。科学家发现了多种仅在视网膜中大量表达的蛋白,并将其改造成了特异性启动子,接下来小编将对这些启动子进行详细介绍。
1、RPE65和VMD2视网膜特异性启动子
RPE65基因编码类视黄酸循环中心蛋白,是合成视觉色素发色团11-顺式视网膜所必需的,Meur等[5]研究人员使用带有RPE65特异性启动子的AAV载体发现其可以有效感染视网膜色素上皮细胞。BEST1基因在人视网膜色素上皮中表达,BEST1(也称为VMD2)突变会导致黄斑营养不良症,也是靶向视网膜的潜在启动子。基于以上研究发现,王海波等[6]构建了scAAV2-RPE65-GFP 和 scAAV2-VMD2-GFP载体,通过视网膜下腔注射小鼠,结果显示scAAV2-RPE65和scAAV2-VMD2均能有效感染视网膜色素上皮细胞(图7)。
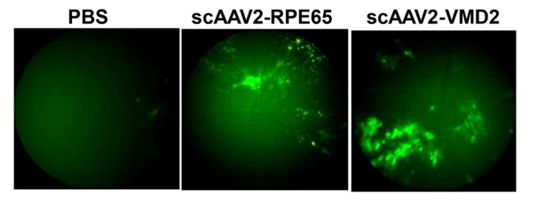
图8. AAV感染视网膜色素上皮细胞结果图
2、Arr3视网膜视锥细胞特异性启动子
Arr3是一种锥体抑制蛋白,其启动子可作为高效感染视网膜视锥细胞的候选启动子。M. Dominik Fischer等[7]构建了AAV8-Arr3-CNGA3载体,在验证载体的感染效果和安全性后通过视网膜下腔注射递送至色盲患者视网膜中。实验结果显示载体靶向色盲患者富含锥体的黄斑(图8),接受治疗的患者的视锥细胞功能(包括视力、对比敏感度和色觉)均有一定程度的改善。
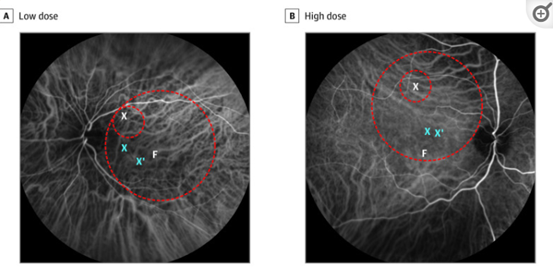
图9. 2例色盲患者接受低剂量和高剂量的基因治疗(载体靶向富含锥体的黄斑)
3、hrk视网膜视锥细胞和视杆细胞特异性启动子
人类视紫红质激酶(RK)基因在视杆细胞和视锥细胞中表达。Shahrokh C. Khani等[8]构建了人RK(hrk)特异性启动子并进一步验证hrk启动子的特异性,作者构建了AAV2/5-hrk-GFP和AAV2/5-mOps(视杆细胞特异性启动子)-GFP载体通过视网膜下腔注射感染野生型小鼠、全锥体Nrl -/-小鼠和富含锥体的尼罗河草大鼠,结果显示hrk启动子对视网膜视锥细胞和视杆细胞都具有良好的活性和特异性(图9)。
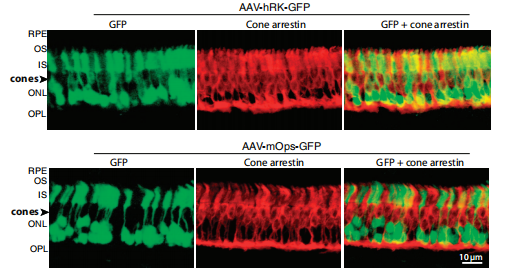
图10. 视网膜中GFP报告基因的表达分析(红色为视锥细胞标记物)
4、RLBP1穆勒细胞特异性启动子
视黄醛结合蛋白1(RLBP1)是穆勒细胞的关键蛋白之一,参与视网膜血管相互作用的调节、血视网膜屏障的建立和光色素的视觉循环。研究人员构建了RLBP1启动子通过玻璃体腔注射和视网膜下腔注射AAV2/shH10Y-RLBP1-GFP感染小鼠视网膜以验证RLBP1启动子的特异性[4]。结果显示,通过玻璃体腔注射GFP仅在穆勒细胞中表达,而视网膜下腔注射GFP则在视网膜色素上皮细胞和穆勒细胞中表达,表明RLBP1特异性启动子能够应用于穆勒细胞的特异性感染。
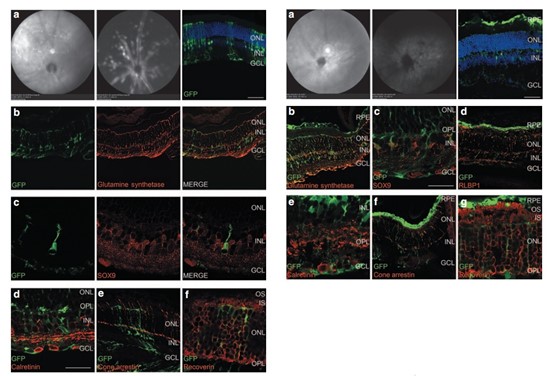
图11. AAV2/shH10Y-RLBP1-GFP感染小鼠视网膜结果图(红色为穆勒细胞marker)
左a-f:玻璃体腔注射;右a-g:视网膜下腔注射
表2. 靶向视网膜的特异性启动子
汉恒生物可提供表内的特异性启动子,并有试用装可供试用,欢迎咨询试用。
三、注射方式和剂量
向视网膜递送AAV的方式主要有两种:玻璃体腔注射和视网膜下腔注射(图10)。玻璃体腔注射对神经节细胞层(主要包括神经节细胞和穆勒细胞)以外的细胞无效,研究发现使用该注射方法给药会引起炎症和免疫浸润增加[8]。而视网膜下腔注射感染的范围较广,不会引起机体免疫反应,但由于其侵袭性较大,一些疾病导致视网膜较为脆弱,使用该方法给药可能会使视网膜情况恶化。小编根据不同注射方法的感染范围、注射剂量和注意事项整理了如下表格(表3),并附视频教程链接,大家可根据实验目的选择合适的注射方法。小Tip:无论选择哪种注射方式,建议拿到病毒后先做预实验,选择最适合自己的操作方式和病毒类型。
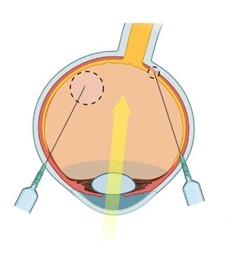
图12. 视网膜常见注射方法[9]
表3. 视网膜注射方法

至此,本期内容就结束了,主要从AAV的血清型、启动子及注射方式三个方面介绍了特异性调控视网膜的策略,相信大家对AAV在视网膜方面的应用有了一个初步的了解,在下期的内容中我们将会继续分享在肌肉方面的特异性基因调控策略,敬请关注。
参考文献:
[1] Carvalho L S, Xiao R, Wassmer S J, et al.Synthetic Adeno-Associated Viral Vector Efficiently Targets Mouse and Nonhuman Primate Retina In Vivo[J].Human Gene Therapy, 2018, 29(7).DOI:10.1089/hum.2017.154.
[2] Marina P, Christian S, M L O, et al. Novel AAV capsids for intravitreal gene therapy of photoreceptor disorders[J]. EMBO Molecular Medicine,2021,13(4).
[3] Ophélie V, Hugo C, Brahim M E, et al. AAV-mediated gene therapy in Dystrophin-Dp71 deficient mouse leads to blood-retinal barrier restoration and oedema reabsorption.[J]. Human molecular genetics,2016,25(14).
[4] Pellissier LP, Hoek RM, Vos RM, Aartsen WM, Klimczak RR, Hoyng SA, Flannery JG, Wijnholds J. Specific tools for targeting and expression in Müller glial cells. Molecular therapy. Methods & clinical development, 2014, 1:14009.
[5] Meur G L , Stieger K , Smith A J ,et al.Restoration of vision in RPE65-deficient Briard dogs using an AAV serotype 4 vector that specifically targets the retinal pigmented epithelium[J].Gene Therapy, 2007, 14(4):292-303.
[6] Haibo W, Eric K, J G S, et al. Optimal Inhibition of Choroidal Neovascularization by scAAV2 with VMD2 Promoter-driven Active Rap1a in the RPE.[J]. Scientific reports,2019,9(1).
[7] Fischer D M, Michalakis S, Wilhelm B, et al. Safety and Vision Outcomes of Subretinal Gene Therapy Targeting Cone Photoreceptors in Achromatopsia: A Nonrandomized Controlled Trial[J]. JAMA Ophthalmology,2020,138(6).
[8] Khani S C, Pawlyk B S, Bulgakov O V, et al.AAV-mediated expression targeting of rod and cone photoreceptors with a human rhodopsin kinase promoter.[J].Invest Ophthalmol Vis, 2007, 48(9):3954-3961.DOI:10.1167/iovs.07-0257.
[9] Peters C, Maguire C, Hanlon K. Delivering AAV to the Central Nervous and Sensory Systems.[J]. Trends in pharmacological sciences, 2021, 42(6): 461-474.

查看更多

查看更多

查看更多

联系我们

返回顶部