查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
上期我们系统的介绍了腺相关病毒在胰腺相关研究中的应用,本期我们将系统的介绍腺相关病毒在肝脏中的应用。
肝脏是人体最大的实体器官,是器官特异性和全身性疾病的多发部位,也是肿瘤转移的常见部位。在肝脏生物学中,研究肝细胞尤为重要,肝脏由几种不同胚胎起源的细胞类型组成,包括肝细胞、胆道上皮细胞(胆管细胞)、星状细胞、Kupffer细胞和肝窦内皮细胞等。肝细胞是肝脏中最常见的细胞类型,约占肝脏细胞总数的60%~80%,具有多种功能,包括合成、分解和分泌多种物质,如胆汁、胆固醇、脂肪酸、葡萄糖和氨等,还能够储存和释放铁、铜、锌等金属离子,以及维生素A、D、K等脂溶性维生素。胆管细胞是肝脏中第二丰富的上皮细胞群,作为胆管腔内的细胞,具有传统的上皮功能和胆汁的分泌功能。肝星状细胞是一种特殊的肝细胞,主要分布在肝脏的外层。肝星状细胞具有分泌和吞噬作用,参与肝脏的修复和细胞外基质的积累。Kupffer细胞是肝脏的常驻巨噬细胞群,这些细胞可以识别许多致病刺激,并在发挥促/抗炎作用,这取决于许多促成因素。肝窦内皮细胞是一种特殊的内皮细胞群,这些细胞在窦腔形成有孔的筛板,对于血浆和肝脏细胞类型之间物质交换存在筛选作用,同时保持一定的屏障功能。

重组腺相关病毒(recombinant adeno-associated virus, rAAV)是一种非致病性病毒载体,既能感染分裂细胞,又能将基因递送到非分裂细胞,是目前用于向肝细胞传递基因的载体之一。选择合适的血清型、特异性启动子和注射方式可以有效提高外源基因在肝组织特异性表达效率,接下来,和大家一起学习AAV在肝在疾病研究中的靶向递送策略。
一、关于血清型
不同的血清型对AAV的感染倾向有很大的影响,根据自己的实验需求选择合适的血清型是决定实验效果的重要影响因素。在首次发现AAV2并研究和改造后,研究者陆续发现多种野生血清型,并在其基础上进行衣壳蛋白Cap基因的修改开发出新的血清型以提高对不同组织的靶向性,其中8型和9型在肝脏上都有较强的倾向性。
AAV8是为改善当时已有血清型对肝脏低转染效率开发的血清型[1], AAV8的感染效率要远高于AAV2。在动物实验中,相对于操作难度较大的门脉注射,AAV8通过尾静脉注射也能达到近似的效果[2]。
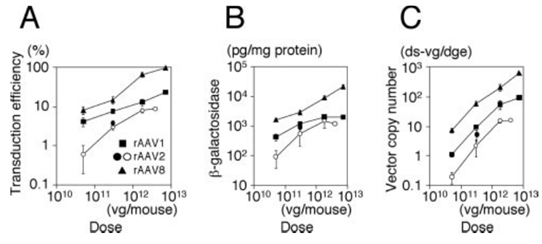
图1.AAV8感染效果对比
对比肝脏的感染效果,AAV9也能出达到类似AAV8的效果[3,4],在我们收到的反馈中AAV9的感染效果要优于AAV8。
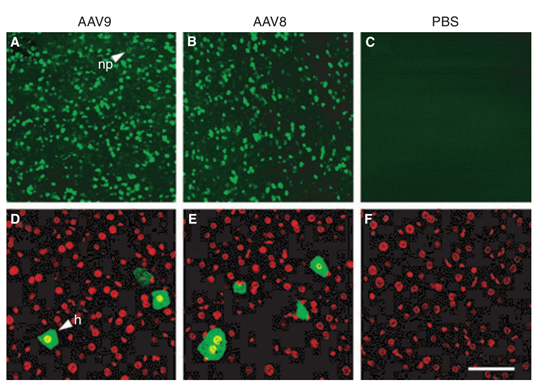
图2. AAV8和AAV9感染效果对比
二、关于启动子
影响AAV的递送效率和特异性的关键因素一个是血清型,另一个就是启动子。启动子是表达载体设计中的一个主要顺式作用元件,决定了目的基因表达的特异性。比如最常见的广谱启动子CAG(CMV immediate-early enhancer chicken β-actin promoter),是通过将一个病毒的增强子序列和一个基因启动序列融合在一起,构建的启动子序列,能高效、广泛、长期的在动物细胞和组织中表达[5,6]。但如果我们希望目的基因过表达/敲低的效果只发生在我们要研究的细胞或者组织中,就可以将AAV启动子替换为特异启动子,以减少对试验结果的干扰,目前应用在AAV上的肝脏特异启动子有TBG、Alb和APOE。
1. 肝细胞特异启动子- TBG(Thyroxine binding globulin)
TBG(Thyroxine binding globulin)是肝脏特异表达的一个54 kDa的酸性糖蛋白,主要功能是在循环系统中结合携带甲状腺激素,这个基因的启动子结构早在三十年前就已经研究透彻[7],在此理论基础上精简后的TBG启动子被广泛应用在AAV的载体上。
TBG作为AAV的启动子能在肝细胞中长期的持续过表达[8]。TBG特异性使目的基因或者干扰序列低表达在其他组织,可以减少对其他组织器官的影响,同时也降低了对其他器官的毒性或者免疫原性,降低实验的干扰[9]。和常用的广谱过表达启动子相对比,TBG的在肝细胞的过表达效率和CMV、CAG相当[10]。
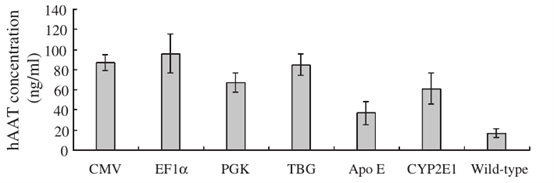
图3.TBG启动子和常规广谱启动子转录活性对比
以《Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal》这篇文章为例。
图4.文章首页
作者在研究发现胆汁酸的水平和结肠炎存在一定的关联,参与胆汁酸代谢中的一个基因——CYP8B1,可能参与了疾病发生发展。为了验证CYP8B1在结肠炎中发挥的作用,作者委托汉恒构建了AAV2/8-TBG-m-Cyp8b1-3xflag,通过尾静脉注射1×1011 vg的病毒量到6周龄小鼠,4周后进行模型的构建。WB结果显示AAV2/8-TBG-m-Cyp8b1-3xflag能显著上调肝脏的Cyp8b1。

图5.AAV2/8-TBG过表达效果
2. 肝细胞特异启动子- Alb(albumin)
与TBG相同,Alb(albumin)也是肝脏特异表达一个基因,Alb是人类血液中最丰富的蛋白质。该蛋白在调节血浆胶体渗透压中起作用,并作为多种内源性分子的载体蛋白,包括激素、脂肪酸、代谢物以及外源性药物。目前,Alb启动子的应用鲜有报道,Alb启动子的特异性和过表达效率等功能需要进一步的阐明。
3. 肝细胞特异启动子-ApoE(apolipoprotein E)
ApoE(apolipoprotein E)作为特异性启动子在文献上的出现频率也少于TBG,主要应用在动脉粥样硬化模型的构建上[9]。使用Pcsk9-D377Y作为造模工具,是近几年新出现的动脉粥样硬化急性模型构建方法。利用ApoE启动子使PCSK9在肝脏中高度表达。在正常生理情况下,PCSK9能结合LDLR并促进其在肝细胞中的降解。研究发现过表达突变的Pcsk9D377Y,能加速LDLR的降解,严重影响血浆中LDL-C的清除能力,最终导致高脂血症,诱导动脉粥样硬化的发生。
野生型C57小鼠通过尾静脉注射1~5×1012v.g.总量的AAV8-Pcsk9-D377Y,即可构建成功,因此,这种方法构建的动物模型十分简便,见效快,而且效果能维持很久,病毒注射后1周时间血浆胆固醇的水平能显著升高,这种效果能维持1年以上[11],不需要繁琐耗时的转基因小鼠的配种,极大地缩减了实验流程。
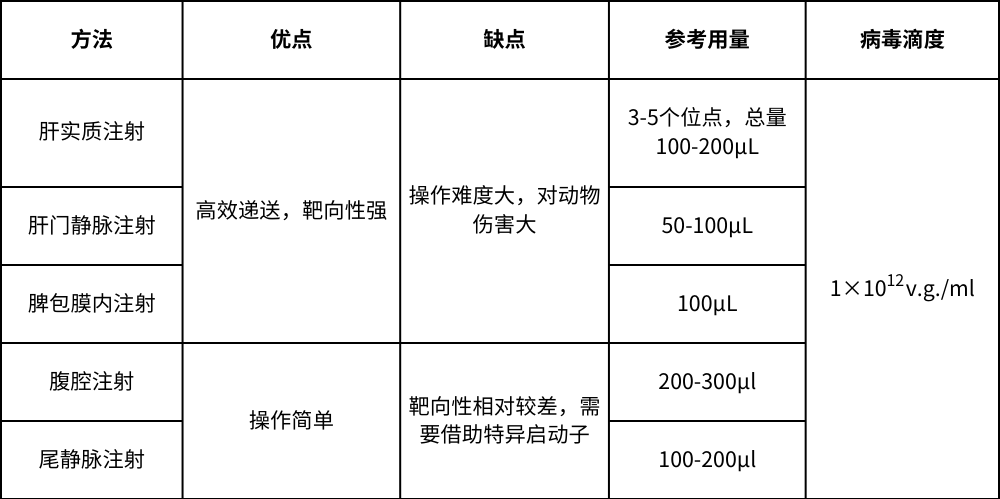
三、关于病毒在注射方式
AAV感染肝脏在在注射方式上有很多种,需要手术参与的有肝实质注射、肝门静脉注射和脾包膜内注射,非手术参与的注射方法有腹腔注射和尾静脉注射:
肝实质注射,注射前需要手术暴露小鼠的肝左外叶,使用29G针头胰岛素注射器将病毒注射到肝实质中,选择3-5个不同的位点注射,总量100-200μL;
肝门静脉注射,需要先用手术刀划开小鼠的第二肋骨和第四乳头之间的区域,长度约3cm,用消毒棉签小心把大小肠等内脏拉出来,找到肝门静脉,用32G针头注射器吸入50-100μL病毒液,在肝脏下方距离约1cm的位置,以小于5°的夹角沿着肝门静脉缓缓插入注射病毒液;
脾包膜内注射,首先用手术刀在小鼠的腹部左侧划开一个长度约1cm的切口,暴露脾脏,用30G针头注射器吸入100μL病毒液,于脾包膜下注射;
相对上述的注射发生,腹腔注射和尾静脉注射操作简单,且不需要开腹腔,是较为常见的递送方法,12次方滴度以上的病毒,小鼠腹腔注射需要200-300μl,尾静脉注射体积大约100-200μl。
无论是基因干扰还是基因的过表达,可以选择血清型8或者9,启动子可以选择具有肝细胞特异性的TBG启动子,或者广谱启动子,比如用于过表达的CMV和干扰的U6启动子。
注射后3-4周到表达高峰,高表达效果能维持1.5个月左右,如果模型构建时间超过1.5个月,建议在注射1.5个月后补充注射一次病毒,以维持高表达的状态。
表1.AAV感染肝脏注射方式
四、结语
本期干货内容主要为大家介绍了使用AAV感染肝脏时,血清型/启动子的选择、病毒的使用方法和案例介绍等内容,希望对正在做这方面实验的小伙伴有所帮助。需要购买或者试用AAV8/9-TBG,或AAV8/9-Pcsk9-D377Y构建动脉粥样硬化模型的老师,可以致电我们的热线400 092 0065咨询。接下来小恒将为大家带来更多干货内容,欢迎大家关注~
参考文献
[1] Nakai H, Thomas CE, Storm TA, et al. A limited number of transducible hepatocytes restricts a wide-range linear vector dose response in recombinant adeno-associated virus-mediated liver transduction. Journal of virology. 2002;76(22):11343-11349.
[2] Nakai H, Fuess S, Storm TA, Muramatsu S, Nara Y, Kay MA. Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. Journal of virology. 2005;79(1):214-224.
[3] Bish LT, Morine K, Sleeper MM, et al. Adeno-associated virus (AAV) serotype 9 provides global cardiac gene transfer superior to AAV1, AAV6, AAV7, and AAV8 in the mouse and rat. Human gene therapy. 2008;19(12):1359-1368.
[4] Vandendriessche T, Thorrez L, Acosta-Sanchez A, et al. Efficacy and safety of adeno-associated viral vectors based on serotype 8 and 9 vs. lentiviral vectors for hemophilia B gene therapy. Journal of thrombosis and haemostasis : JTH. 2007;5(1):16-24.
[5] Daly TM, Okuyama T, Vogler C, Haskins ME, Muzyczka N, Sands MS. Neonatal intramuscular injection with recombinant adeno-associated virus results in prolonged beta-glucuronidase expression in situ and correction of liver pathology in mucopolysaccharidosis type VII mice. Human gene therapy. 1999;10(1):85-94.
[6] Kosuga M, Enosawa S, Li XK, et al. Strong, long-term transgene expression in rat liver using chicken beta-actin promoter associated with cytomegalovirus immediate-early enhancer (CAG promoter). Cell transplantation. 2000;9(5):675-680.
[7] Hayashi Y, Mori Y, Janssen OE, et al. Human thyroxine-binding globulin gene: complete sequence and transcriptional regulation. Molecular endocrinology (Baltimore, Md). 1993;7(8):1049-1060.
[8] Carrillo-Carrasco N, Chandler RJ, Chandrasekaran S, Venditti CP. Liver-directed recombinant adeno-associated viral gene delivery rescues a lethal mouse model of methylmalonic acidemia and provides long-term phenotypic correction. Human gene therapy. 2010;21(9):1147-1154.
[9] Yan Z, Yan H, Ou H. Human thyroxine binding globulin (TBG) promoter directs efficient and sustaining transgene expression in liver-specific pattern. Gene. 2012;506(2):289-294.
[10] Kang J, Huang L, Zheng W, et al. Promoter CAG is more efficient than hepatocyte‑targeting TBG for transgene expression via rAAV8 in liver tissues. Molecular medicine reports. 2022;25(1).
[11] Kumar S, Kang DW, Rezvan A, Jo H. Accelerated atherosclerosis development in C57Bl6 mice by overexpressing AAV-mediated PCSK9 and partial carotid ligation. Laboratory investigation; a journal of technical methods and pathology. 2017;97(8):935-945.

查看更多

查看更多

查看更多

联系我们

返回顶部