查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2型糖尿病(T2DM)是一种以高血糖和全身代谢紊乱为特征的慢性疾病,严重干扰以骨和皮肤为代表的组织愈合过程,包括对牙周的有害影响。细胞外囊泡,尤其是外泌体,在T2DM的相关代谢性疾病中引起了越来越多的关注,其中包括对组织愈合的影响。肝脏作为代谢的中枢,在调节骨稳态中起关键作用。T2DM是一种慢性代谢性疾病,与肝纤维化、肝硬化、非酒精性脂肪性肝病(NAFLD)等多种肝损伤密切相关,并进一步促进体内炎症的发展。这些发现提示糖尿病和牙周炎中存在一种潜在的机制,即外泌体介导肝脏和牙槽骨之间的可能存在关联。
近期,浙江大学医学院医学院附属口腔医院的陈谦民和空军军医大学第三附属医院李蓓团队发表了一篇名为《Exosomes derived from impaired liver aggravate alveolar bone loss viashuttle of Fasn in type 2 diabetes mellitus》研究,系统性的阐明了2型糖尿病和压槽骨丢失的分子机制。在本研究中,作者发现T2 DM导致PDLCs的上睑下垂,而PDLCs的下垂通过循环外渗体加重牙周骨丢失。T2 DM患者以肝脏损害为主的循环外切体在牙周区显著蓄积,外切体转移的脂肪酸合成酶(FASN)导致脂肪酸的异位合成,进而导致PDLCs的下垂。而通过遗传或药物手段抑制肝源性外切体和FASN可显著防止细胞下垂和减轻牙周骨丢失。这项研究提出了糖尿病和牙周炎之间的新关系,重点是一种未知的机制,即外切体介导的肝脏-骨轴相互作用。受损肝脏释放的外切体引起的脂代谢异常导致骨破坏,解释了病理状态下骨再生障碍的新机制,丰富了肝骨轴的特定通讯途径。这些发现也强调了FASN诱导的下垂在糖尿病引起的骨形成减弱中的中心作用,这为糖尿病骨疾病的预防和治疗提供了先进的策略。文章中,汉恒生物构建腺相关病毒AAV-CD63-Luc和AAV-CD63-GFP用来标记肝脏的外泌体,通过活体成像和荧光显微镜观察,外泌体的分布情况。

研究团队首先在糖尿病并发牙周炎的小鼠模型(db/db+Lig)上明显的观察到牙槽骨丢失。进一步对牙周组织研究发现,焦亡相关的蛋白HMGB1在细胞质的水平显著上调,Western blot证实了小鼠牙周组织中NLRP3炎症小体的激活和gasdermin D (GSDMD)的裂解。牙周韧带细胞(Periodontal ligament cells, PDLCs)作为维持牙周组织尤其是牙槽骨组织的平衡起着重要作用的细胞,在动物实验上发现焦亡水平也是明显上调的。说明糖尿病小鼠的牙周组织存在着细胞的焦亡,推测糖尿病诱导的PDLCs焦亡可能是糖尿病牙周炎患者成骨能力下降、牙槽骨流失加重的重要原因(图1)。
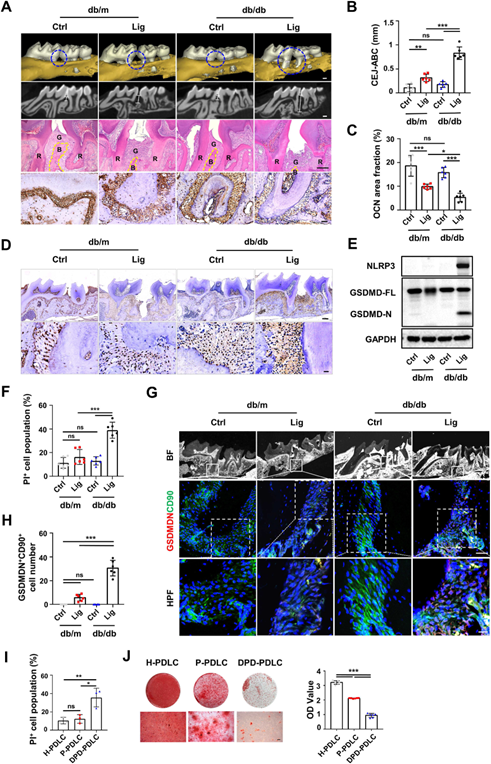
图1 T2DM可导致牙周炎患者牙槽骨坏死,并加重牙周炎患者牙槽骨丢失
以往的研究发现,外泌体和糖尿病的并发症密切相关,而糖尿病并发牙周炎的小鼠外泌体情况还是未知。研究团队发现,糖尿病小鼠的血浆中,外泌体显著上调,但仅结扎血糖正常的小鼠诱导牙周炎对外泌体的水平没有影响。使用外泌体的抑制剂GW4869能够下调血浆中的外泌体水平,抑制牙槽骨骨量的下调和PDLCs的焦亡。说明糖尿病患者循环外泌体通过诱导PDLCs的焦亡降低成骨能力,增加骨吸收。
为了进一步证实循环外泌体在牙槽骨丢失中的作用,研究团队通过尾静脉给非糖尿病的牙周炎小鼠注射糖尿病循环外泌体,观察外泌体的分布和牙周变化。体内示踪实验表明,随着时间的推移,外泌体除了常规存在于肝脏外,主要存在于牙槽骨中。免疫荧光实验证实糖尿病循环外泌体能靶向PDLCs。此外,小鼠接受糖尿病外泌体后,牙槽嵴高度降低,成骨能力下降,PDLCs的焦亡水平升高。这些结果表明,T2DM会诱导血液循环外泌体升高,并向牙周炎的牙槽骨转移富集,导致PDLCs焦亡,造成牙槽骨的骨丢失(图2)。
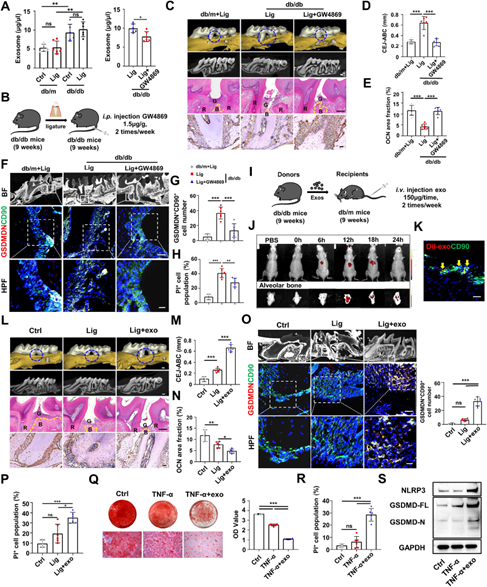
图2 T2DM循环外泌体诱导PDLCs焦亡,加重牙周炎引起的牙槽骨丢失
为了明确T2DM损伤下循环外泌体的来源,作者从db/db小鼠(一种自发糖尿病的小鼠)的肝脏、胰腺和脂肪组织中提取外泌体,对其进行表征并注射到db/m小鼠体内,观察其对牙槽骨丢失的影响。对比发现,只有来肝脏的外泌体能导致小鼠严重的骨吸收。为了确定循环外泌体是否来源于肝脏,作者使用了特定的肝细胞标记物来鉴定它们,结果表明近三分之一的循环外泌体来自于糖尿病宿主的肝脏,同时也在牙周的PDLCs检测到来自肝脏的外泌体。为了验证作用PDLCs的外泌体来源,随后利用腺相关病毒AAV-CD63-Luc和AAV-CD63-GFP来标记肝脏的外泌体。通过活体成像和荧光显微镜观察,小鼠在肝脏和牙槽骨具有强烈的荧光信号。
为了进一步探索外泌体造成骨流失的原因,作者对T2DM模型收集来的外泌体进行组学的分析,发现脂肪酸代谢和生物合成途径相关的蛋白差异最显著。由于脂质代谢失调常见于T2DM患者,因此,作者认为这些脂质代谢相关的蛋白很可能参与了牙槽骨的骨流失。通过生信分析,作者发现Fasn (fatty acid synthase)是表达差异最大的基因。Fasn是主要表达于肝脏、脂肪组织和乳腺中,在脂肪酸合成中起着至关重要的作用。
这些数据表明,糖尿病肝脏代谢受损促进了携带Fasn的外泌体的释放,这些外泌体被招募到牙周区域以调节PDLCs的功能(图3)。
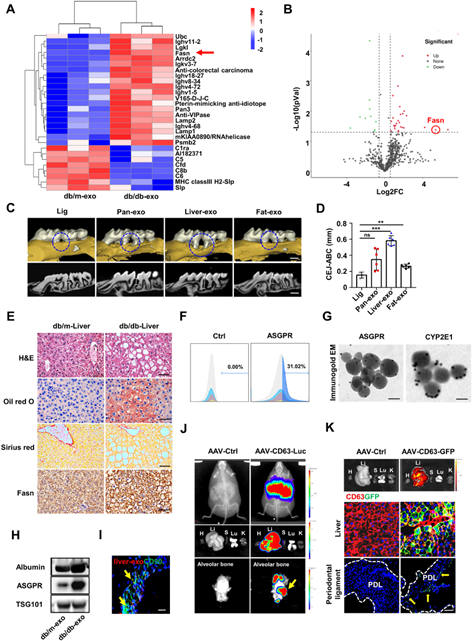
图3 T2DM引起代谢受损的肝脏分泌的外泌体迁移到牙周组织
从上述的研究推测Fasn可能是肝来源的外泌体的关键致病因子之一,因此后面的任务就是研究Fasn造成牙槽骨骨丢失的分子机制。研究团队委托汉恒生物科技有限公司构建敲低Fasn的腺相关病毒(AAV-shFasn),通过尾静脉注射AAV可以使病毒富集在肝脏,敲低肝脏中Fasn的表达,进而影响到血液外泌体中Fasn的水平。通过敲低db/db + Lig小鼠的Fasn,发现能对牙周病变产生有益的影响,能减少骨吸收,提高成骨能力,缓解HMGB1的释放,抑制PDLCs的焦亡和改善牙周细胞的功能。因此明确了Fasn是导致PDLCs发生焦亡的关键基因。因为Fasn参与脂肪酸的代谢,因此作者收集了小鼠的PDLCs细胞的脂肪酸,色谱分析,共检测到37种脂肪酸,其中棕榈酸、硬脂酸和油酸丰度居前三位,而抑制Fasn的功能后能抑制脂肪酸的生成,尤其是棕榈酸。棕榈酸是已知多个焦亡相关疾病的参与者。体外实验证实,棕榈酸能降低了PDLCs的成骨分化能力,激活NLRP3炎症小体和GSDMD的剪切,进而导致PDLCs的焦亡(图4)。
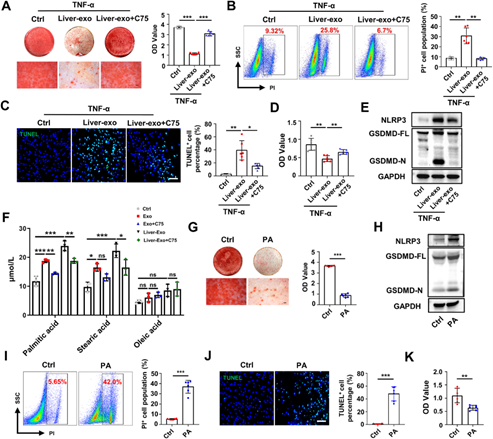
图4 Fasn引起脂肪酸合成过度导致PDLCs的焦亡和功能障碍
综上,研究团体通过一系列研究发现,糖尿病环境下,受损的肝脏会分泌过多含有Fasn的外泌体到牙周,导致PDLC摄入过多的Fasn,进而脂质生成异常,尤其是棕榈酸的水平上调,上调的棕榈树导致炎症小体的激活和细胞的焦亡,最终造成牙周成骨能力恶化和牙槽骨流失。这些发现揭示了外泌体在骨稳态调节中的作用,并对糖尿病骨疾病中脂肪酸代谢的新治疗策略具有重要意义(图5)。
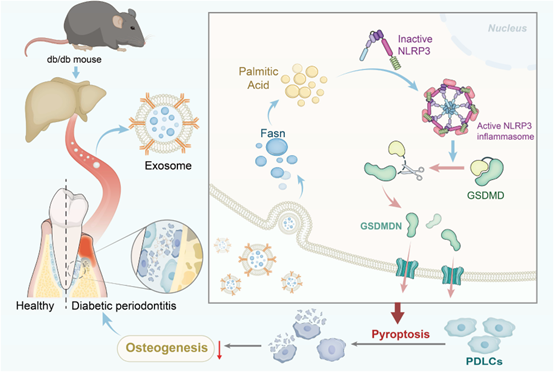
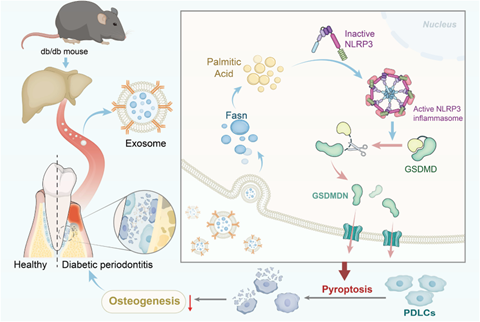
图5 T2DM诱导含有fasn的外泌体引起的牙槽骨丢失加重的示意图

查看更多

查看更多
查看更多

联系我们

返回顶部