查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
随着全球人口老龄化,肌肉减少症已成为最常见的老年病之一。许多研究表明,肌肉减少症患者同时也具有较高的骨质疏松症患病风险。作为运动系统的一个功能单元,骨骼肌和骨骼在发育和生长过程中相互协调;而在废用、疾病和衰老等病理情况下骨骼肌萎缩又会导致骨质流失,加剧骨质疏松风险。因此,了解骨骼肌与骨骼之间的分子交流有助于制定更有效的策略来预防废用性骨质疏松症。

2023年11月7日,四川大学华西口腔医院/口腔再生医学国家地方联合工程实验室廖立副研究员和田卫东教授团队在Cell Metabolism(IF=29)发表了题为《Skeletal muscle-derived extracellular vesicles transport glycolytic enzymes to mediate muscle-to bone crosstalk》的重要论文。该成果证明了骨骼肌会分泌丰富的细胞外囊泡(Mu-EV),这些Mu-EVs可以进入邻近的骨组织,并被骨髓间充质干/基质细胞(BMSCs)吸收,从而刺激骨形成。
作者分别对来自萎缩骨骼肌和运动骨骼肌以及普通对照骨骼肌小鼠的Mu-EVs中不同表达蛋白的分析发现,Mu-EVs通过运输糖酵解原促进糖酵解。这些研究结果表明,Mu-EVs可作为非传统的生物活性因子发挥作用,促进BMSCs中的糖酵解,从而增强骨形成。总之,该研究发现了骨骼肌影响骨代谢的新机制,揭示了Mu-EVs在BMSC新陈代谢调节和骨形成刺激中的重要作用,为治疗废用性骨质疏松症提供了一种潜在疗法。
值得一提的是,汉恒生物也为该项研究提供了重要的基因表达调控载体工具:为了标记肌肉细胞来源的囊泡(EV),作者使用了来自汉恒生物的MHCK7-CD63-EGFP-AAV病毒载体;为了特异性敲低肌肉细胞中的LDHA的表达,作者使用了汉恒生物提供的MHCK7-shRNA-LDHA-AAV病毒载体;另外,为了确定Mu-EV中激活BMSCs糖酵解的候选蛋白,作者也通过汉恒生物提供的siRNA对C2C12细胞中的LDHA和PKM进行了敲低,最终确定了Mu-EV运输的LDHA在激活BMSCs糖酵解中的作用。
先前的研究表明,骨骼肌细胞可在体外和体内产生EV;然而,这些EV在调节其它组织代谢中的潜在作用仍未可知。
首先,为了确定骨骼肌是否在体内分泌囊泡(EV),作者使用了汉恒生物构建的AAV载体(AAV-MHCK7-CD63-EGFP)。该载体通过肌肉特异性启动子MHCK7驱动表达编码EV标记蛋白mCD63和绿色荧光蛋白(EGFP)的融合报告基因,以确保该报告系统只在肌肉细胞中特异性表达(图1A)。将MHCK7-CD63-EGFP-AAV载体局部注射到小鼠后肢的双侧骨骼肌中,4 周后在注射了AAV的后肢肌肉中检测到了高EGFP表达。并且,从这些肌肉中分离出的Mu-EV中有58.0% 被CD63-EGFP标记,这表明这种标记EV报告模型在体内有效。BMSCs在成骨过程中起着至关重要的作用,因为它们的成骨分化潜力决定了前成骨细胞的数量和骨形成的速度。为了证实Mu-EV是否被BMSCs摄取,作者使用 PKH67 标记的Mu-EV进行了体外实验并进行了荧光分析发现,Mu-EV 被内化到了BMSCs的细胞质中(PKH67荧光染料可以稳定的与膜脂质区结合并发出绿色荧光,PKH67荧光染料标记Mu-EV后,与受体细胞共培养,可以示踪受体细胞摄取Mu-EV。)(图1F)。
此外,BMSCs和骨骼肌在体外共培养24小时后,在BMSCs中观察到大量 EGFP阳性颗粒(图1H)。这些结果表明,骨骼肌分泌的Mu-EV可以运输到骨骼并被BMSCs吸收。
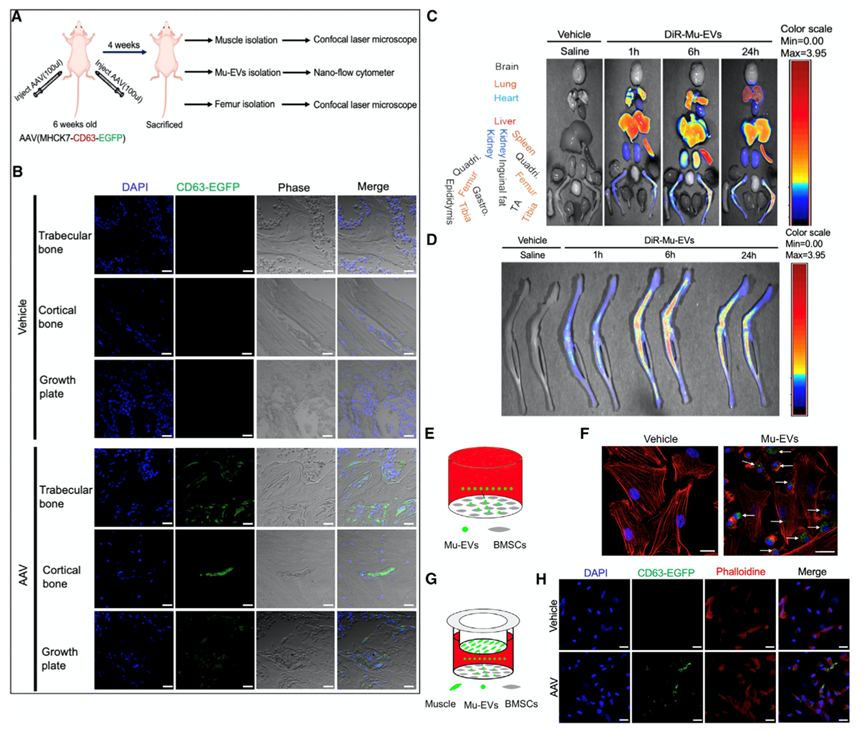
图1. Mu-EV进入骨骼和骨髓间充质干细胞/基质细胞(BMSCs)
作者继续研究Mu-EV是否在调节骨形成中发挥作用。为了验证Mu-EV促进成骨的有效性,作者用Mu-EV处理BMSCs进行ARS染色(图2A)、碱性磷酸酶活性测定(图2B)和并对成骨相关基因进行qRT-PCR分析(图2C),结果证实了Mu-EV对BMSCs成骨分化的影响。值得注意的是,等量肌肉分泌的Mu-EV颗粒数量在运动后增加,在肌肉萎缩后减少(图2F),这表明肌肉功能与Mu-EV分泌呈正相关。
作者还发现肌肉萎缩症小鼠的Mu-EV在促进BMSC成骨方面的效果较差(图2G)。通过尾静脉向肌萎缩小鼠模型中静脉注射正常Mu-EV则能增强其成骨能力(图2H-K)。这些结果证明了Mu-EV对废用性骨质疏松症骨形成的改善作用。
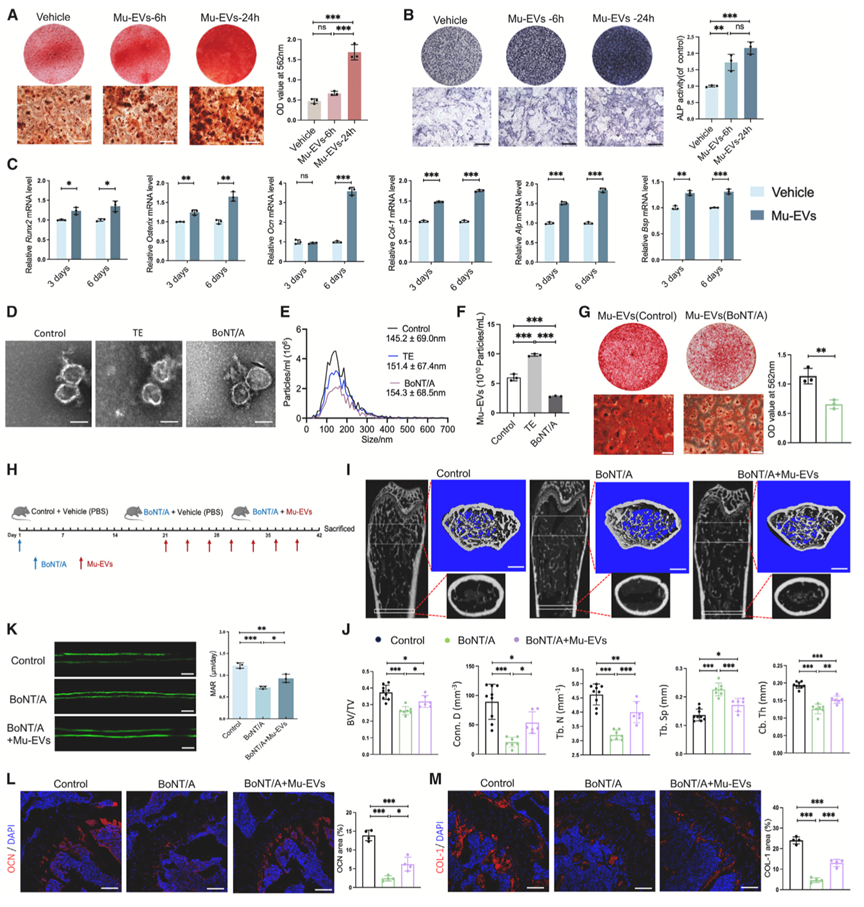
图2. Mu-EVs可增强BMSCs的成骨分化并刺激骨形成
为了确定Mu-EV中的生物活性蛋白,作者重点研究了对照组小鼠Mu-EV和诱导肌肉萎缩小鼠Mu-EV之间差异表达的蛋白。蛋白质组数据显示富集最显著的生物学过程包括肌肉系统过程、肌肉收缩以及前体代谢和能量的产生(图3C)。
生物信息学分析发现,乳酸脱氢酶A(LDHA)、丙酮酸激酶M(PKM)、UTP-葡萄糖-1-磷酸尿苷基转移酶(UGP2)和β-烯醇化酶(ENO3)在诱导肌肉萎缩小鼠Mu-EV中显著下降。这些酶均与葡萄糖代谢有关,结合进一步数据表明,骨骼肌分泌糖酵解酶到Mu-EV中,以调节受体组织/细胞中的糖酵解相关反应。
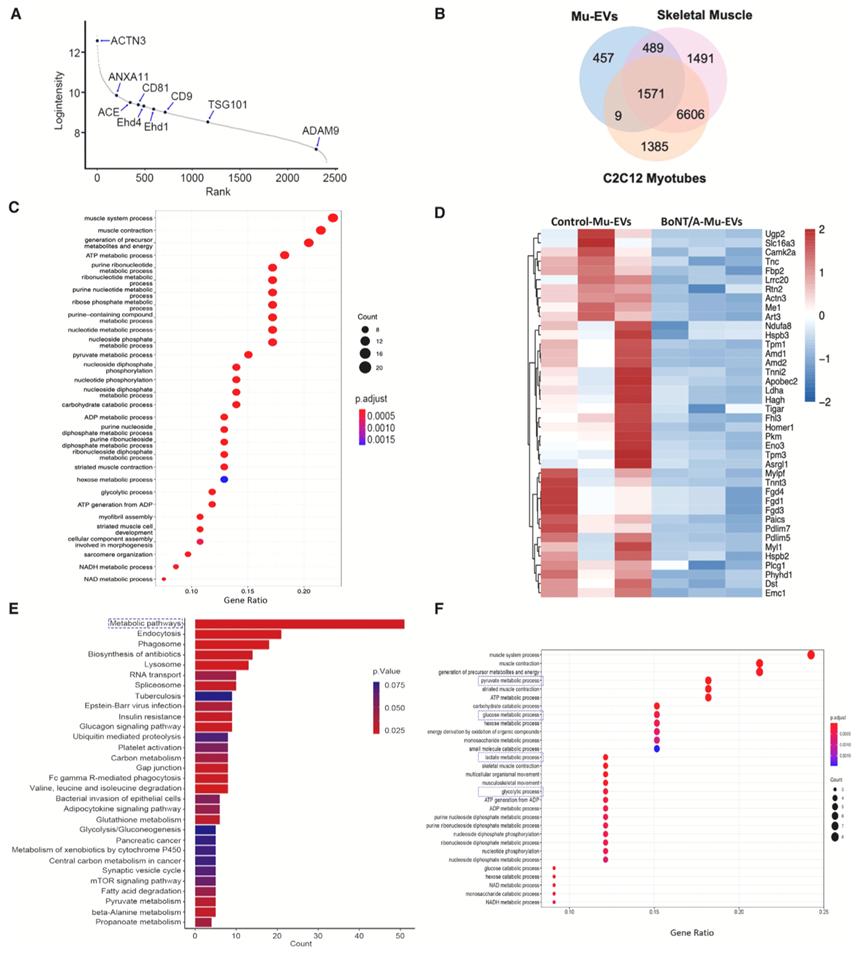
图3. Mu-EV的深度蛋白质组学分析
作者接下来的目标是评估Mu-EV在BMSCs有氧糖酵解中的作用。通过对照组Mu-EV处理BMSCs后,作者发现这些细胞中的葡萄糖消耗和细胞内乳酸水平显著增加(图4A和4B)。但是WB分析显示,只有乳酸脱氢酶LDHA蛋白水平升高(图4D和4E)。为了研究Mu-EV是否通过促进糖酵解促进BMSCs成骨,作者通过药物来激活或抑制BMSCs的糖酵解,证实了Mu-EV主要通过促进有氧糖酵解来促进BMSC成骨(图4H-S)。
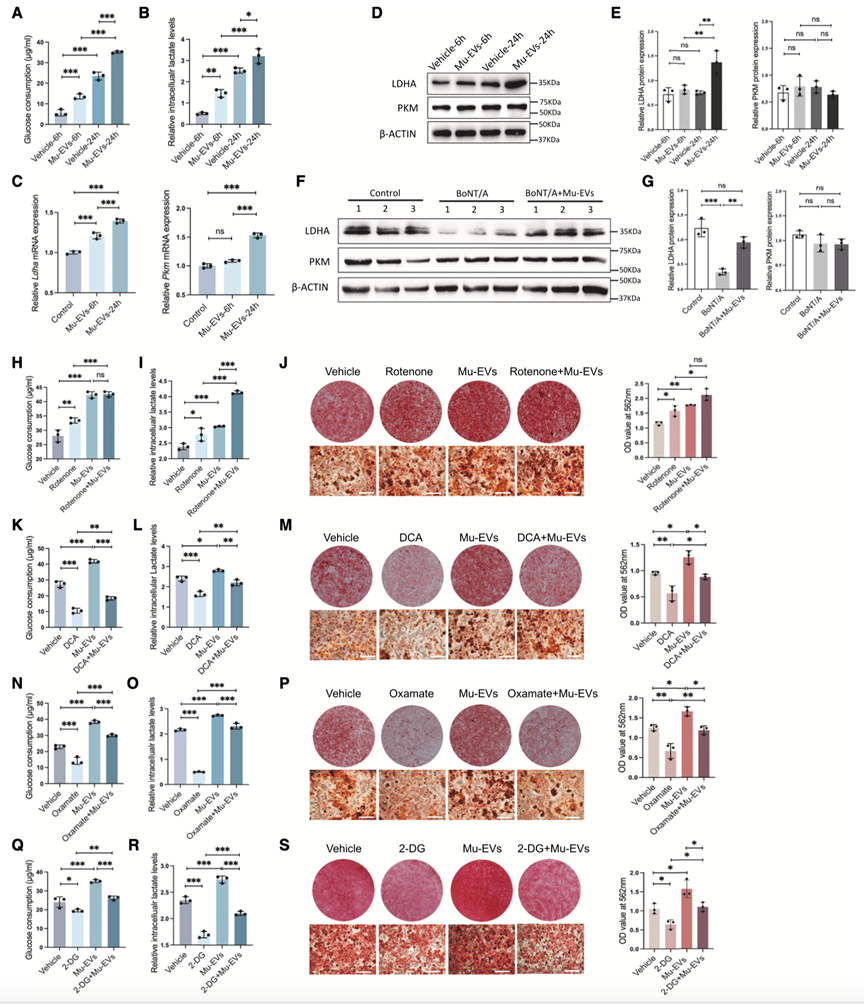
图4.Mu-EV通过诱导糖酵解调节BMSCs的成骨分化
为了研究体育锻炼是否通过激活体内BMSC糖酵解来促进骨形成,作者首先对小鼠进行强制锻炼,然后用2-DG来阻断糖酵解(图5A)。结果显示,2-DG处理完全阻断了锻炼对骨量的积极作用,降低了小鼠股骨中成骨标志物OCN和COL-1的表达(图5B-E)。同时经过锻炼的小鼠体内Mu-EV含有更高水平的LDHA,并表现出更高的促骨活性。相比之下,2-DG处理的小鼠的Mu-EV含有较低水平的LDHA,并且诱导BMSC成骨分化的活性较低(图5H-5K),表明抑制糖酵解降低了Mu-EV在骨形成中的生物活性。
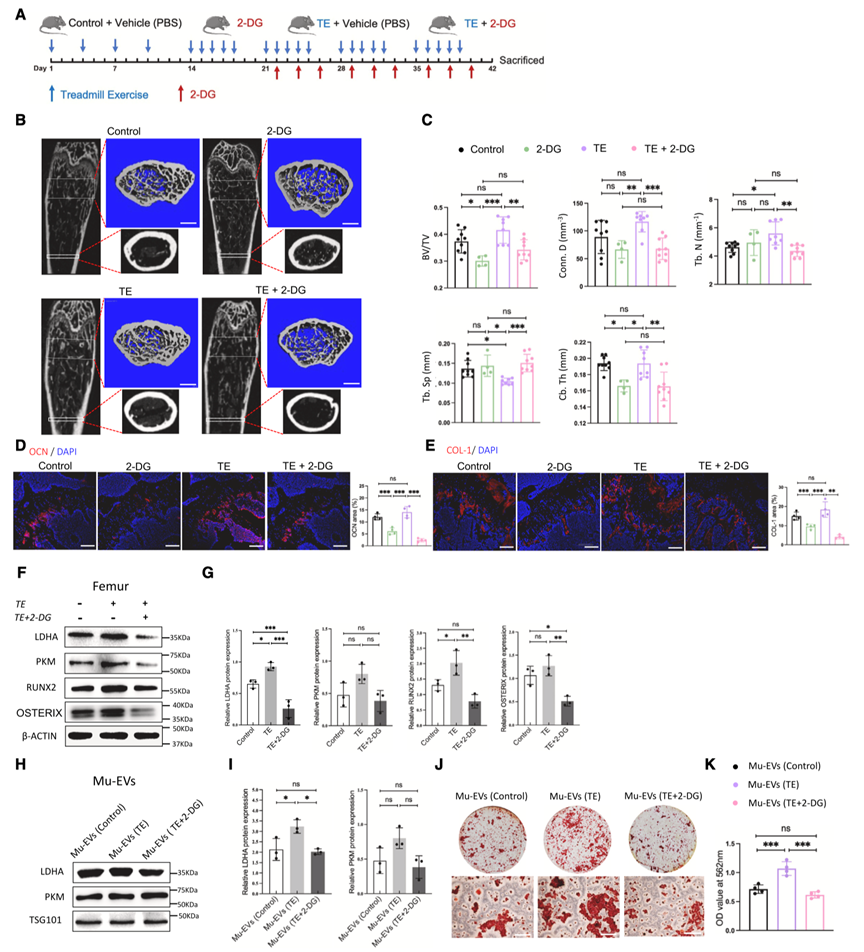
图5. 糖酵解调节骨骼重塑
接下来,为了研究Mu-EV是否通过上调糖酵解促进骨形成,诱导肌肉萎缩模型小鼠同时注射Mu-EV和2-DG(图6A)。结果表明,2-DG组的成骨相关指标均较低(图6B和6C)。IF(图6D和6E)和WB分析(图6F-6I)显示,2-DG组股骨中主要成骨基因OCN、COL-1、RUNX2和OSTERIX和LDHA水平显著降低。这表明骨组织中成骨蛋白水平的降低与2-DG对LDHA的抑制作用密切相关。这些发现共同表明,Mu-EV主要通过增强体内糖酵解来促进骨形成。
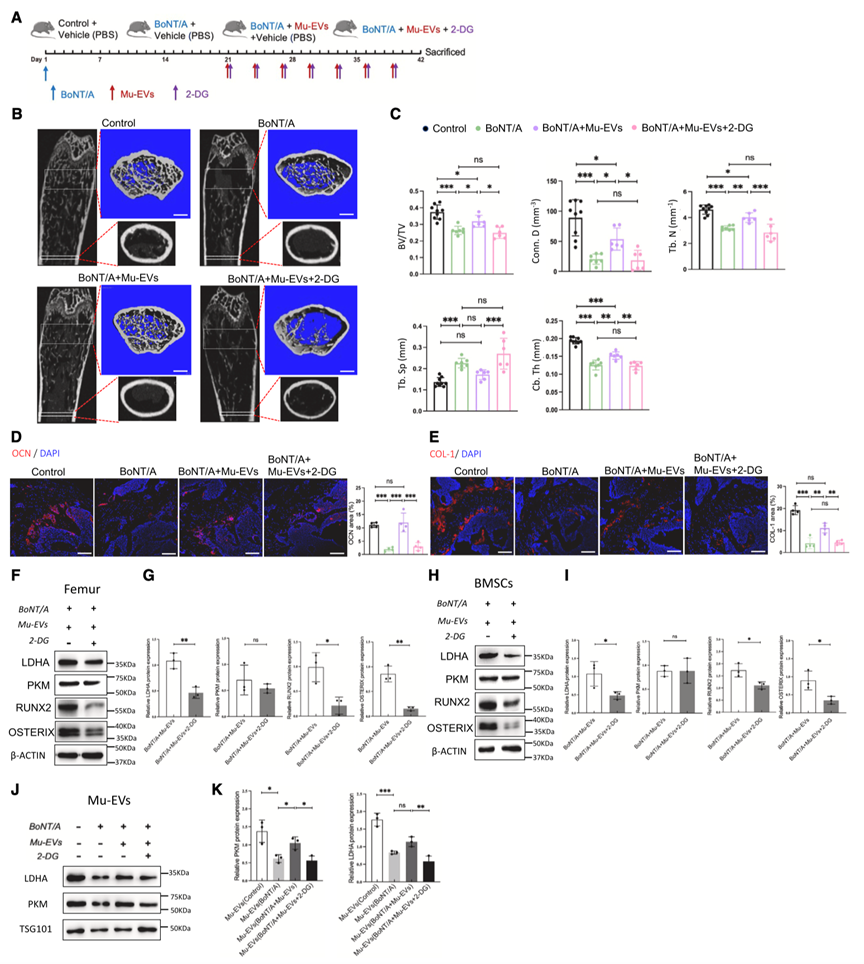
图6. Mu-EV通过糖酵解参与骨形成调节
接下来,作者研究了Mu-EV激活BMSCs糖酵解的机制。质谱分析结果表明,PKM和LDHA是高表达的候选糖酵解酶,于是作者在小鼠骨骼肌细胞系C2C12中使用汉恒生物提供的siRNA敲低LDHA和PKM。与对照组相比,LDHA敲低组分泌的EV在促进BMSCs中RUNX2和OSTERIX的表达以及糖酵解反应方面的效果较差;而PKM敲低组分泌的EV并不影响BMSCs促进成骨及糖酵解的能力。因此,作者确定LDHA是Mu-EV中激活BMSCs糖酵解的候选蛋白。于是作者通过汉恒生物构建了肌肉特异性启动子MHCK7启动的LDHA-shrna AAV载体(AAV-shRNA-LDHA),以在体内敲低肌肉中的LDHA表达。结果显示,接受 AAV-shRNA-LDHA注射的小鼠的股骨中LDHA和成骨基因表达减少(图7A-H),其中Mu-EV在促进葡萄糖消耗(图7I)、乳酸生成(图7J)以及BMSCs中LDHA和成骨基因的表达(图7K和7L)等方面的效率较低。这些发现支持了Mu-EV主要通过运输糖酵解酶LDHA影响骨形成的结论。
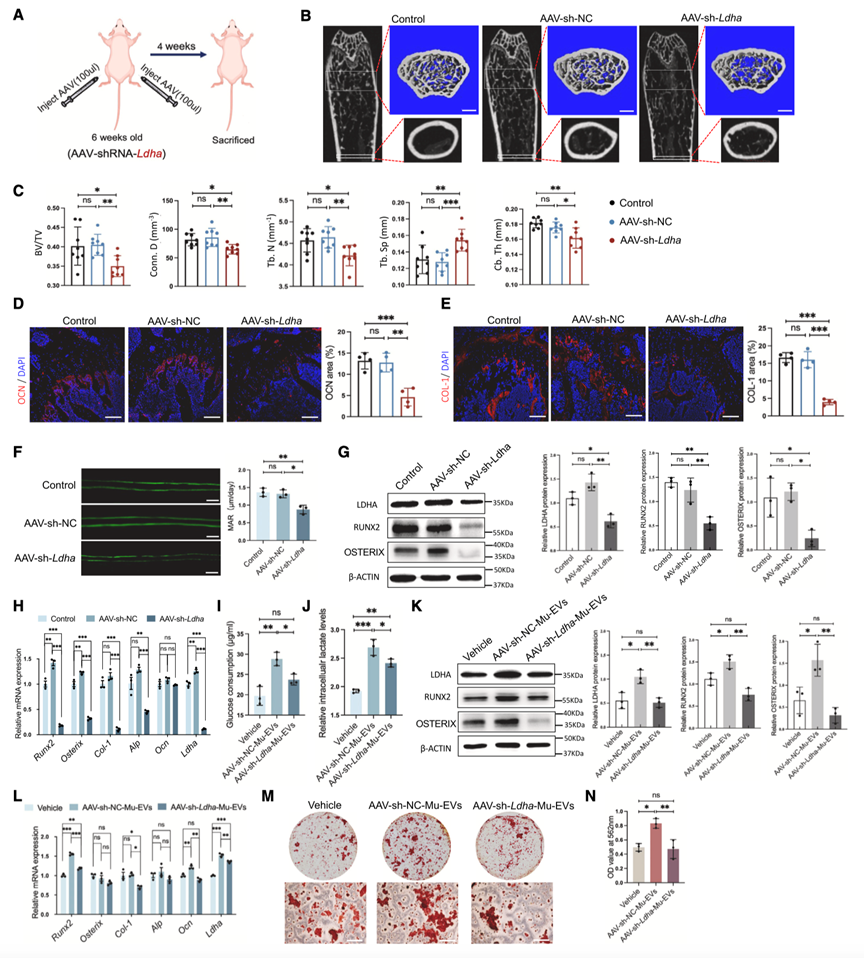
图7. Mu-EV通过运输糖酵解酶LDHA诱导糖酵解
综上所述,本研究表明,Mu-EV作为一种有效的介质,通过转运糖酵解原以旁分泌方式调节骨形成。Mu-EV的分泌和生物活性随着骨骼肌功能的动态变化而变化,是决定BMSCs介导骨形成的关键因素。总之,这项研究揭示了骨骼肌和骨重塑之间的一种新的联系,而运动刺激的Mu-EV有助于改善废用性骨质疏松症,这为预防和治疗骨质疏松症提供了一种潜在策略。

查看更多

查看更多
查看更多

联系我们

返回顶部