查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
脊髓损伤(SCI)可由交通事故、高空坠落伤、暴力伤等高强度机械损伤导致,或可由感染性病变、肿瘤、椎体退行性病变、缺血再灌注损伤、血管性病变等生物学病变引起。SCI主要表现在导致轴突严重受损,致使神经网络中断和神经功能丧失,严重时或可导致永久性截瘫。目前,针对SCI比较有前景的治疗方式主要是神经干细胞移植,但介于临床应用难点及伦理问题仍被认为具有较大应用争议。而最近的研究表明,神经干细胞(NSCs)来源的外泌体可能是治疗SCI有效的候选方案。
2023年11月28日,中南大学湘雅医院吕红斌教授团队在《Bioactive Materials》期刊在线发表题为“Local delivery of EGFR+NSCs-derived exosomes promotes neural regeneration post spinal cord injury via miR-34a-5p/HDAC6 pathway”的研究论文,该研究发现表皮生长因子受体阳性神经干细胞源性外泌体(EGFR+ NSCs-Exos)的局部递送可以促进SCI修复,并探索了该过程的分子机制。EGFR+ NSCs属于内源性NSCs的一个亚群,EGFR+ NSCs被证实在中枢神经系统疾病中表现出较强的再生能力。在本文中,作者先是鉴定了EGFR+ NSCs这一神经干细胞(NSCs)的特定亚型,并分离了它们的外泌体。而后通过转录组学和microRNA测序分析,对EGFR+NSCs及其外泌体进行了表征。并通过体外细胞模型,探索了EGFR+ NSCs-Exos促进轴突生长的机制,以及结合3D打印技术和水凝胶支架,设计并实现了用于治疗SCI处理的水凝胶包被外泌体贴片,显示出增强神经再生的卓越功效。这些结果表明,EGFR+ NSCs-Exos可以向神经元传递miR-34a-5p,导致HDAC6下调,进而激活神经元自噬过程并增强微管的稳定性。总之,本研究引入了一类来自EGFR+NSCs的新型外泌体,它们具有增强SCI处理后功能恢复的潜力,为SCI治疗提供了一种颇具前景的无细胞治疗方法。值得注意的是,本研究使用的miR-34a-5p抑制剂和模拟物、HDAC6-3’UTR相关psi-Check 2双荧光素酶质粒以及用于观察自噬的mRFP-GFP-LC3腺病毒均由汉恒生物提供。
下面我们一起来看看作者是如何挖掘其中的机制:
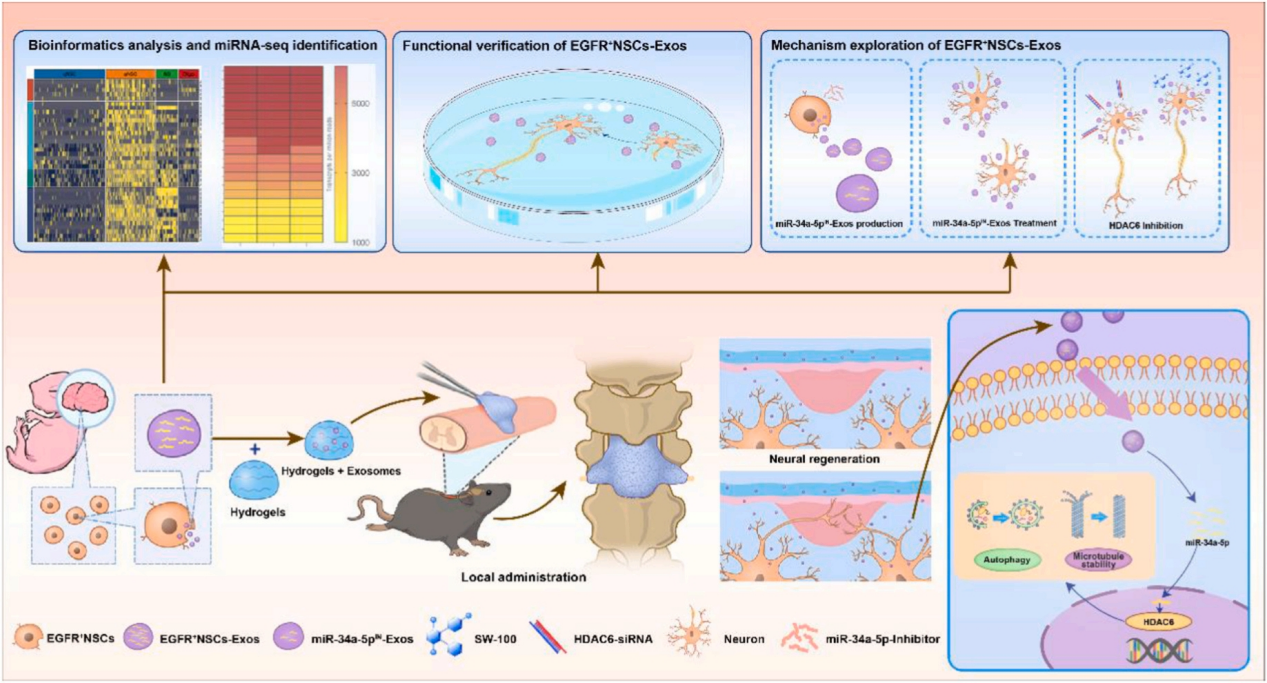
图1. 研究技术路线图
作者团队前期的研究证实了原代NSCs的外泌体可以促进血管生成,具有促进SCI修复的神经保护作用。在本研究中,作者进一步通过细胞投影和可视化聚类将原代NSCs分为两种类型:静息NSCs(qNSCs)和活化NSCs(aNSCs),EGFR作为aNSCs的标记物,在这类细胞中高水平表达。通过对不同细胞集群进行GO分析,发现aNSCs表达的基因在神经发育和修复相关的信号通路中高度富集。接着为进一步探索aNSCs在SCI治疗中的作用,作者使用流式细胞术在E14胎鼠大脑皮层脑室下区对EGFR+ NSCs进行了分选培养。并分别提取了原代NSCs和EGFR+ NSCs的外泌体,完成了相应物理结构分析及鉴定。
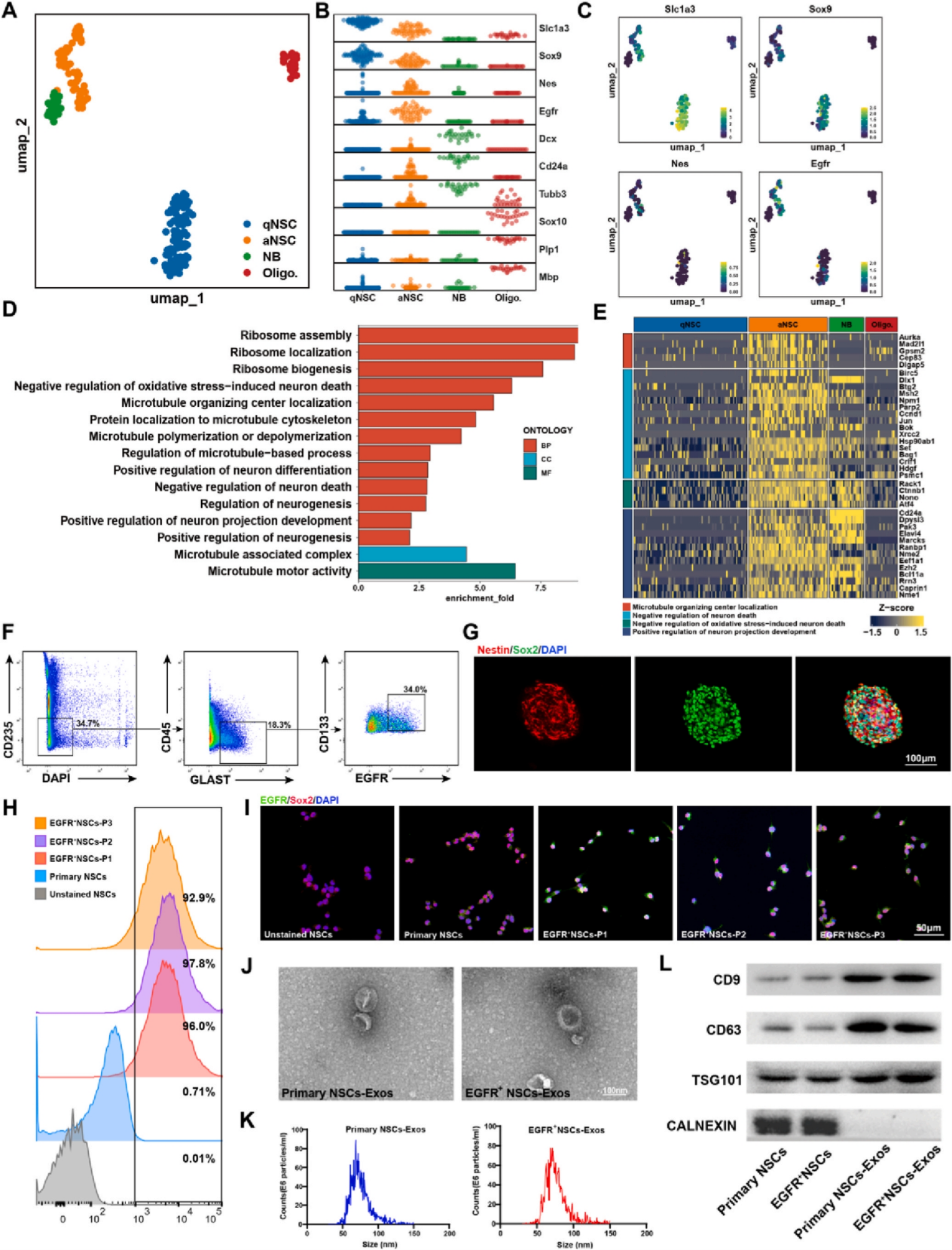
图2. 神经干细胞单细胞转录组特征及其外泌体的鉴定
接着作者探索了分离的外泌体对SCI小鼠的促恢复作用。为维持外泌体有效的局部作用浓度,实验采用了GelMA和HA-NB基光固化水凝胶包埋被亲脂性染料DIR(红色)和PKH67(绿色)标记的外泌体。通过对小鼠进行SCI处理,并在处理后将携带两种外泌体的水凝胶分别放置在SCI小鼠的损伤病灶上,并对损伤前、损伤治疗后0、1、3、7、14、21和28天的小鼠SCI严重程度进行评估(BMS评估)。结果显示,虽然SCI处理后各组小鼠的行为功能均出现恶化,但与对照组相比,原代NSCs-Exos治疗组在SCI处理后运动功能障碍方面表现出显著改善。而EGFR+ NSCs-Exos组则比原代NSCs-Exos组表现出更好的功能恢复现象。此外,通过运动诱发电位(MEPs)和组织学分析发现,与对照组相比,两种外泌体处理的小鼠都表现出较好的神经连接恢复,且EGFR+ NSCs-Exos处理的小鼠脊髓病变区域最小,表明EGFR+ NSCs-Exos处理的脊髓功能恢复优于原代NSCs-Exos。
为了进一步确定SCI处理后NSCs-Exos促进脊髓功能恢复的细胞机制,在SCI处理并给药24 h后,使用荧光显微镜检测NSCs-Exos的吸收情况,发现两种外泌体在给药后均透过血脑屏障(BBB)渗入大脑,并被病变侧周围的神经元和吞噬细胞吸收。同时,作者通过两种神经元生长相关抗体在EGFR+ NSCs-Exos组中检测到强劲的神经轴突再生。随后作者模拟了SCI处理后的轴突断裂,切断体外神经元的远端轴突,构建了体外细胞损伤模型,以证实EGFR+ NSCs-Exos在SCI处理后对神经的促再生作用。结果显示EGFR+ NSCs-Exos以剂量依赖性的方式促进轴突再生。在利用硫酸软骨素(CSPG)抑制神经元生长的环境中,通过两种外泌体处理的皮质神经元突触延长,其中EGFR+ NSCs-Exos表现出了更好的效果。这在脊髓来源的神经元上得到了一致的验证结果:EGFR+ NSCs-Exos表现出更强的促进轴突再生的能力。
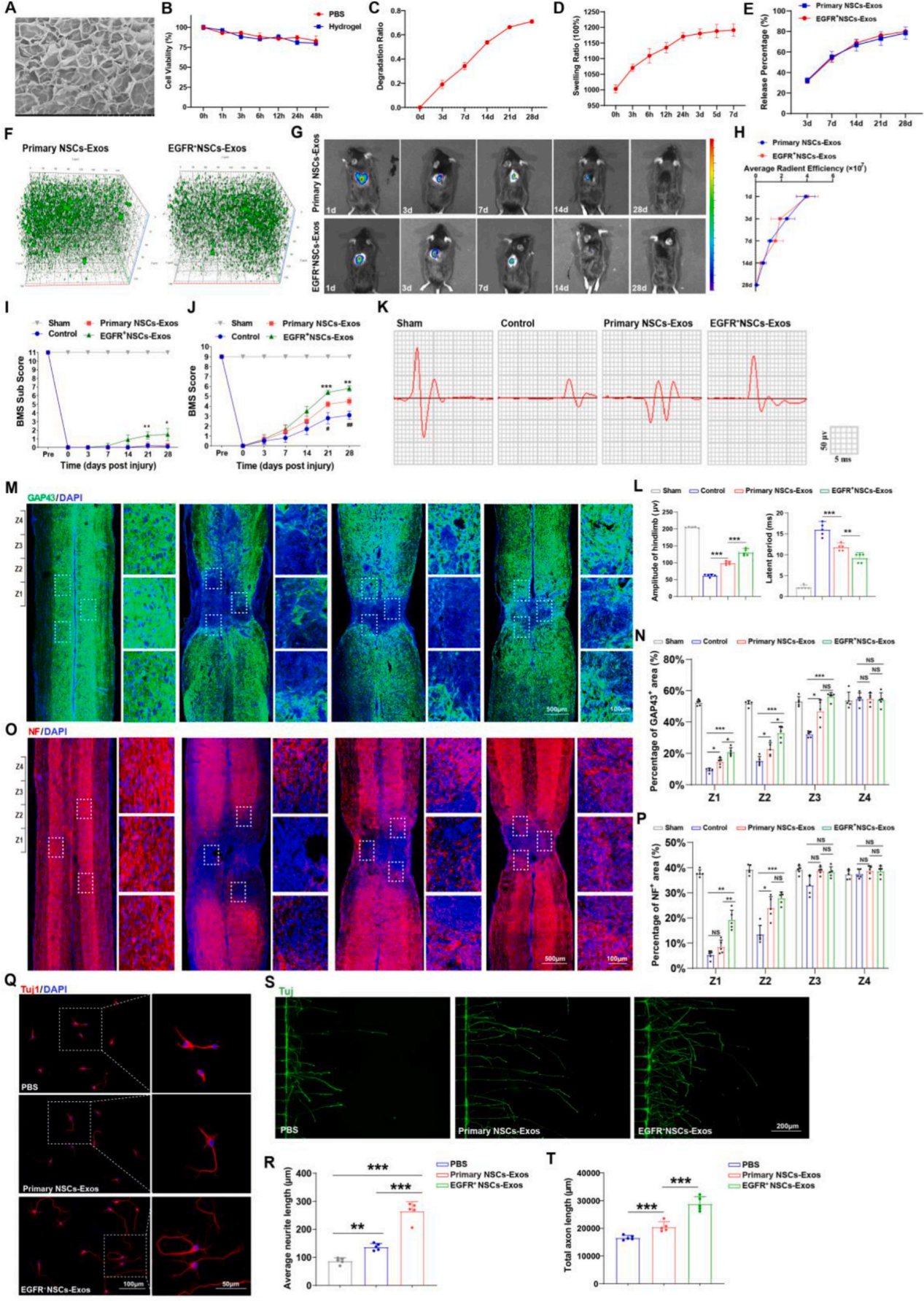
图3. EGFR+ NSCs-Exos促进了体内和体外的脊髓功能恢复和神经重塑
由于外泌体的功能主要取决于其内容物,以往研究表明miRNA是介导外泌体生物学功能的关键因子之一。为确定了EGFR+ NSCs-Exos促进脊髓损伤修复的分子机制,作者对EGFR+ NSCs-Exos进行了miRNA测序,筛选出了最高表达的10个miRNA,并比较了这10个miRNA在原代NSCs-Exos中的表达情况。最终发现,miR-34a-5p在EGFR+ NSCs-Exos中表达丰度高于其在原代NSCs-Exos中的表达。接着为了确定miR-34a-5p在介导神经再生中的作用,将miR-34a-5p模拟物和miR-34a-5p抑制剂给予至皮质神经元。结果表明,miR-34a-5p的模拟物减轻了CSPG对神经轴突生长的抑制作用,miR-34a-5p抑制剂则抵消了EGFR+NSCs-Exos促进神经轴突生长的能力。同时,作者检测到EGFR+NSCs-Exos可显著提高SCI处理后组织中以及离体培养神经元中的miR-34a-5p表达水平,而不影响pri-miR-34a-5p的表达,表明升高的miR-34a-5p水平是由EGFR+NSCs-Exos传递的。以上结果表明,EGFR+NSCs-Exos可以将其内容物miR-34a-5p转移到目标神经元细胞并影响其生物活性。
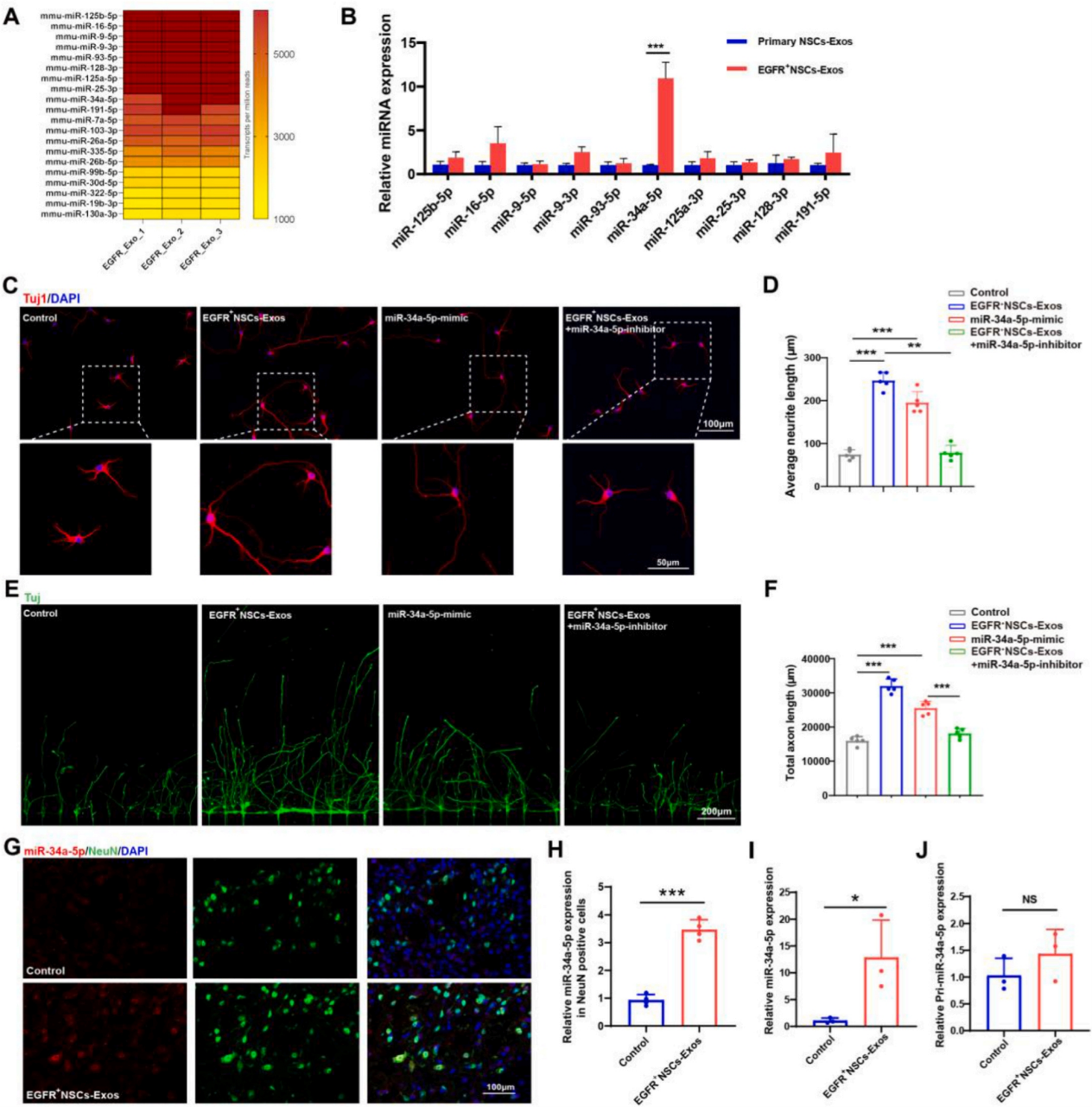
图4. miR-34a-5p在EGFR+NSCs-Exos中富集表达,并可传递到脊髓神经元
为了进一步研究外泌体miR-34a-5p在介导EGFR+ NSCs-Exos促进SCI处理后神经功能恢复和神经轴突再生的作用机制,作者使用miR-34a-5p抑制剂构建了miR-34a-5p敲低的EGFR+NSCs。随后分别从EGFR+NSCs和miR-34a-5p敲低的EGFR+NSCs中提取外泌体。miR-34a-5p敲低EGFR+NSCs来源的外泌体被命名为miR-34a-5pIN-Exos,miR-4a-5p处理EGFR+NSCs分离的外泌体被命名为NC-Exos,作为阴性对照。结果表明miR-34a-5pIN-Exos中miR-34a-5p的表达明显低于NC-Exos。MEPs和免疫染色组织学分析结果表明EGFR+NSCs中miR-34a-5p的下调抵消了NC-Exos治疗带来的功能恢复,进一步证明EGFR+NSCs-Exos是通过将miR-34-5p转移到神经元中促进其功能恢复。随后作者通过体外实验和轴突再生实验评估了来源于EGFR+NSCs-Exos的miR-34-5p的促再生功能。实验结果均表明与NC-Exos组相比,给予miR-34a-5pIN-Exos可减弱神经轴突再生。说明miR-34-5p对于EGFR+NSCs -Exos促进神经轴突再生至关重要。
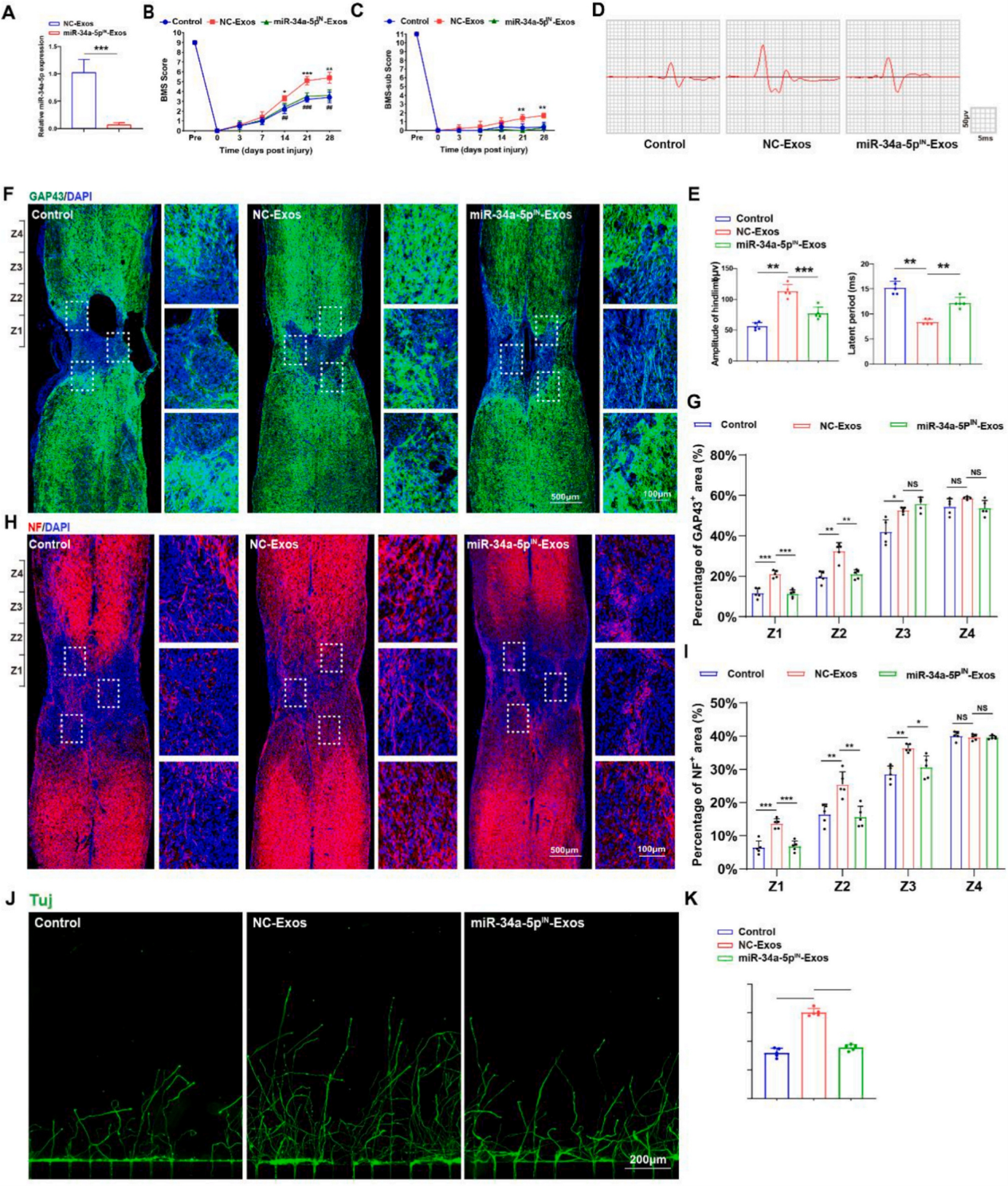
图5. miR-34a-5p介导EGFR+NSCs-Exos对神经功能恢复和神经再生的影响
根据miRNA发挥生物学功能的特性,作者结合生物信息学工具筛选确定了miR-34a-5p的4个潜在靶基因,包括Aatk、Sema4b、Ntn1和HDAC6。而其中仅有组蛋白去乙酰化酶6 (histone deacetylases 6, HDAC6)定位于胞质,且可调节自噬和微管去乙酰化酶等非组蛋白结构的去乙酰化。通过双荧光素酶报告实验确证了miR-34a-5p可以直接结合HDAC6的3'UTR并抑制其表达。免疫荧光染色和WB检测也表明EGFR + NSCs-Exos可显著降低培养神经元细胞中HDAC6的表达。为了进一步验证EGFR + NSCs-Exos对HDAC6表达的调节作用,作者检测了NC-Exos和miR-34- 5pIN-Exos处理小鼠的HDAC6表达。结果显示,与对照组相比,NC-Exos处理组小鼠神经元中HDAC6的表达水平较低,并且在抑制miR-34a-5p后,这种影响被逆转。这些结果说明EGFR+NSCs-Exos的内容物miR-34a-5p促进神经轴突再生并降低了神经元中HDAC6的表达。
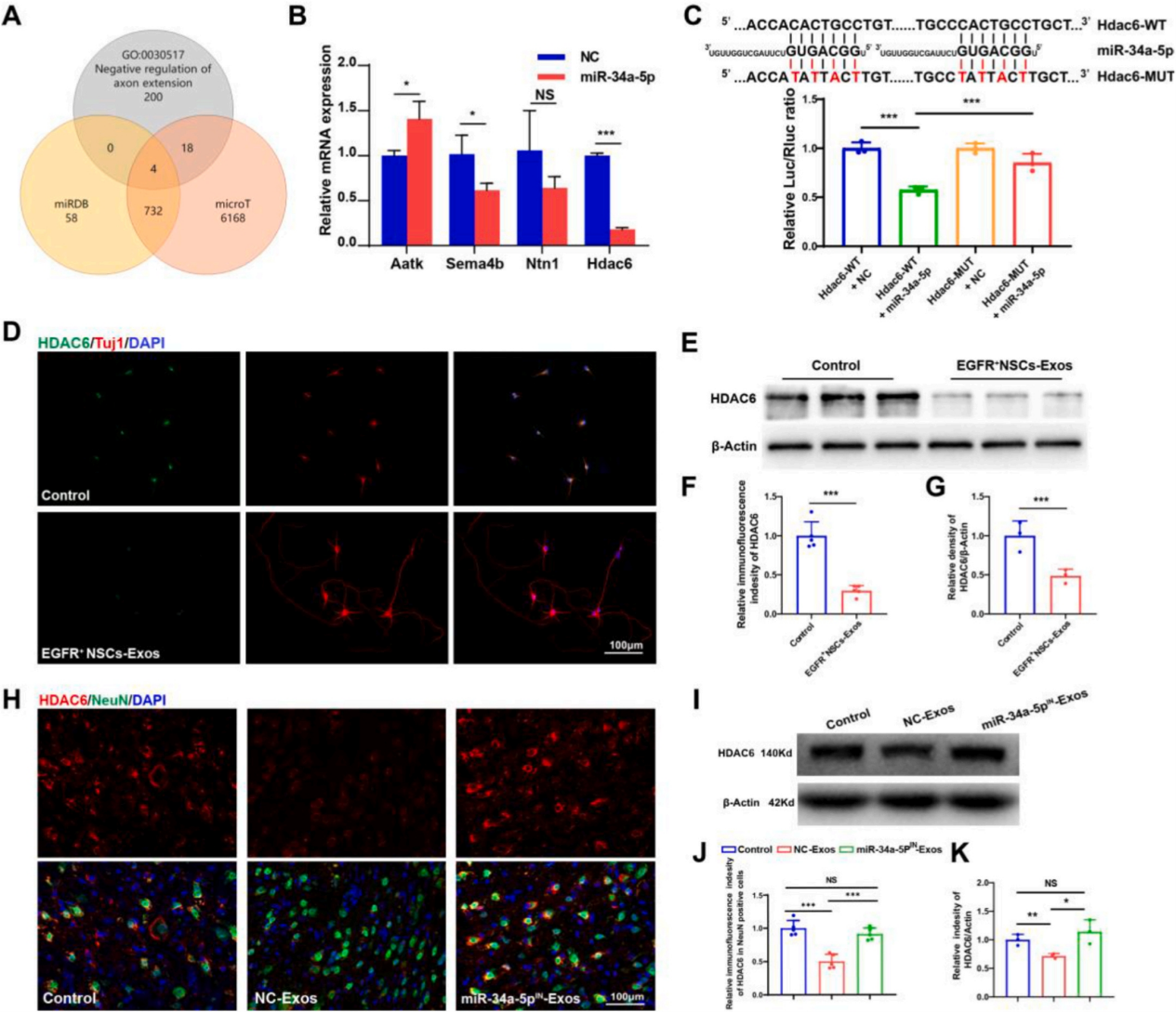
图6. EGFR+ NSCs-Exos源性miR-34a-5p直接下调作用神经元中HDAC6的表达
由于报道表明HDAC6在轴突再生中可以调节神经微管稳定性和神经自噬。因此,作者继续通过免疫荧光染色和WB分析损伤组织中乙酰化(Ace)和酪氨酸化(Tyr)α-微管蛋白以及自噬相关蛋白的表达。结果显示,NC-Exos增加了Ace/Tyr(A/T)比率,表明微管稳定性得到改善,而抑制外泌体miR-34-5p表达降低了微管刚度。同时,与对照组相比,NC-Exos具有增强神经元中自噬相关蛋白LC3和Beclin1表达的能力,同时降低了自噬负调节因子P62的表达。经miR-34-5pIN-Exos处理后,LC3A/B和Beclin1蛋白水平表达明显下降,P62蛋白水平则上调。说明在EGFR+NSCs-Exos中高表达的miR-34a-5p对于介导外泌体微管稳定和神经自噬的功能是必需的。
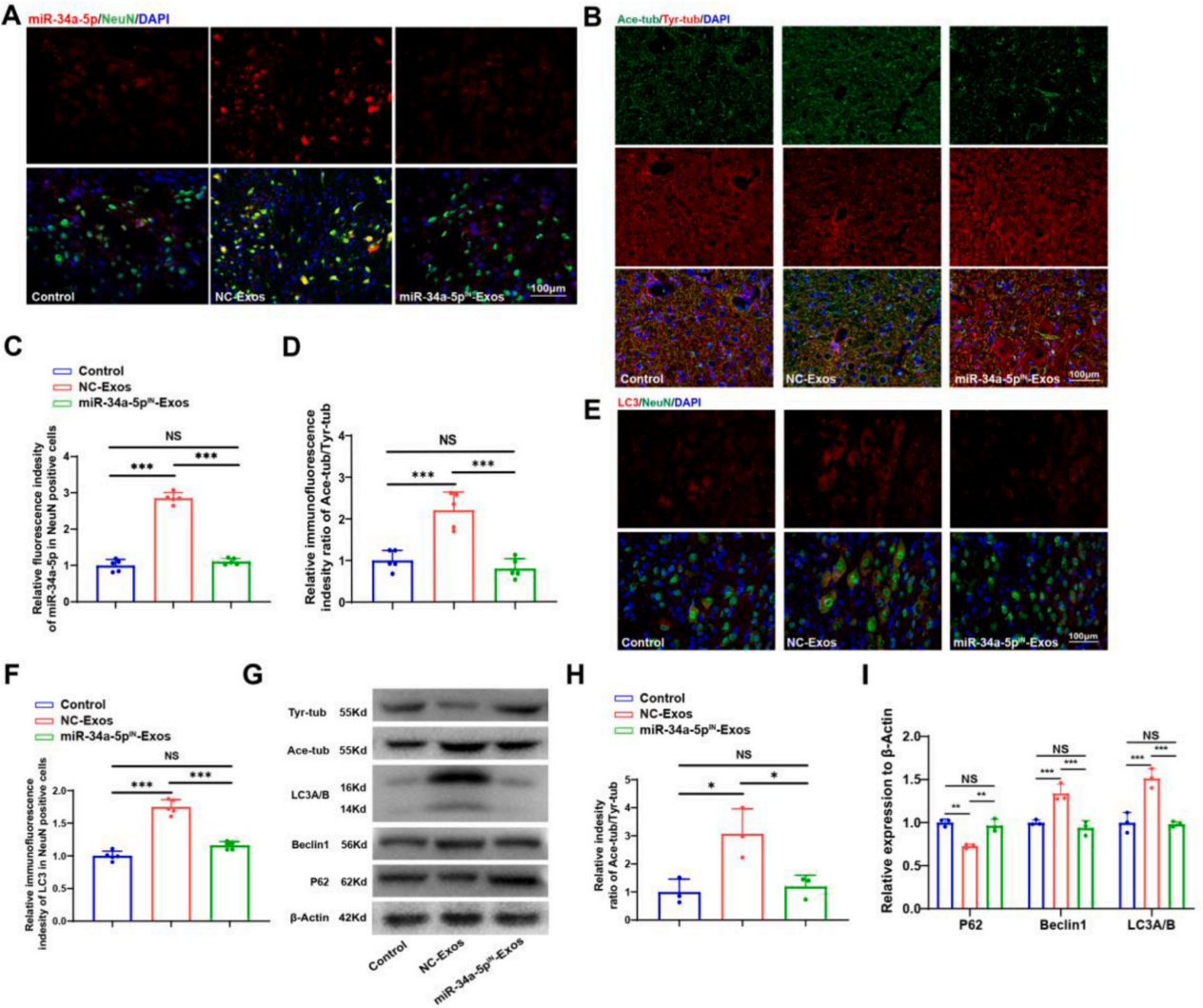
图7. EGFR+NSCs-Exos通过miR-34a-5p调控微管稳定和自噬激活
为了进一步揭示miR-34a-5p/HDAC6在调节神经再生中的作用。作者通过轴突再生实验验证结果表明miR-34a-5p的沉默抑制了EGFR+NSCs-Exos的促轴突再生作用。而抑制HDAC6可恢复这种促进作用。随后作者通过免疫荧光染色评估了微管稳定性,结果显示敲低HDAC6上调了A/T比率,逆转miR-34a-5pIN-Exos的作用。同时,通过自噬流检测和透视电镜观察发现,miR- 34a-5pIN-Exos处理后,神经元中HDAC6的敲低挽救了自噬通量。这些数据表明,EGFR+NSCs-Exos通过miR-34a-5p/HDAC6通路介导的微管稳定和自噬激活促进神经再生。
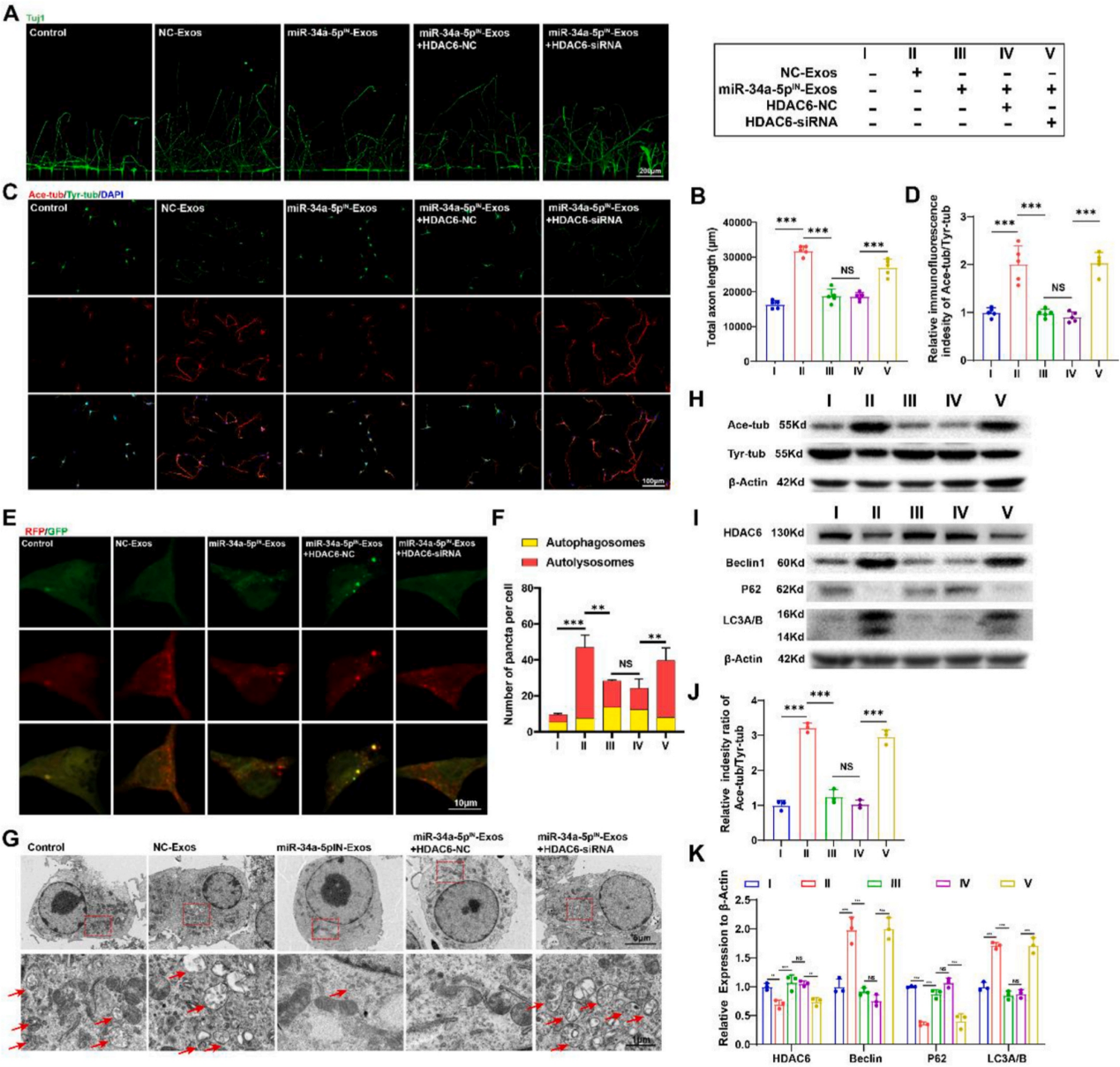
图8. EGFR+NSC-Exos通过miR-34a-5p/HDAC6途径稳定微管并激活自噬
最后为了验证miR-34a-5p/HDAC6是否参与EGFR+NSC-Exos对SCI的恢复,作者将miR-34a-5pIN-Exos与SW-100(选择性HDAC6抑制剂)联合给予SCI小鼠。免疫荧光和免疫组织化学染色结果显示,抑制miR-34a-5p减弱了病变核心周围的微管乙酰化和神经自噬激活。进一步给药SW-100则逆转了miR-34a-5p抑制的作用。BMS评估结果表明,抑制miR-34a-5p减弱了EGFR+NSCs-Exos对神经保护的积极作用。然而,与单独处理的miR-34a-5pIN-Exos相比,SW-100的存在表现出增强神经功能恢复方面的作用。MEPs检测证实了miR-34a-5p/HDAC6通路在调节EGFR+NSC-Exos处理小鼠神经连接恢复中的显著作用。H&E染色结果表明,SW-100可以通过沉默HDAC6消除miR-34a-5pIN-Exos对SCI处理后脊髓组织愈合的抑制作用。免疫荧光染色发现miR-34a-5pIN-Exos处理小鼠的脊髓中神经轴突再生作用被抑制,而给药SW-100可以恢复神经轴突再生。说明EGFR+NSC-Exos通过miR-34a-5p/HDAC6通路促进损伤脊髓的功能恢复。
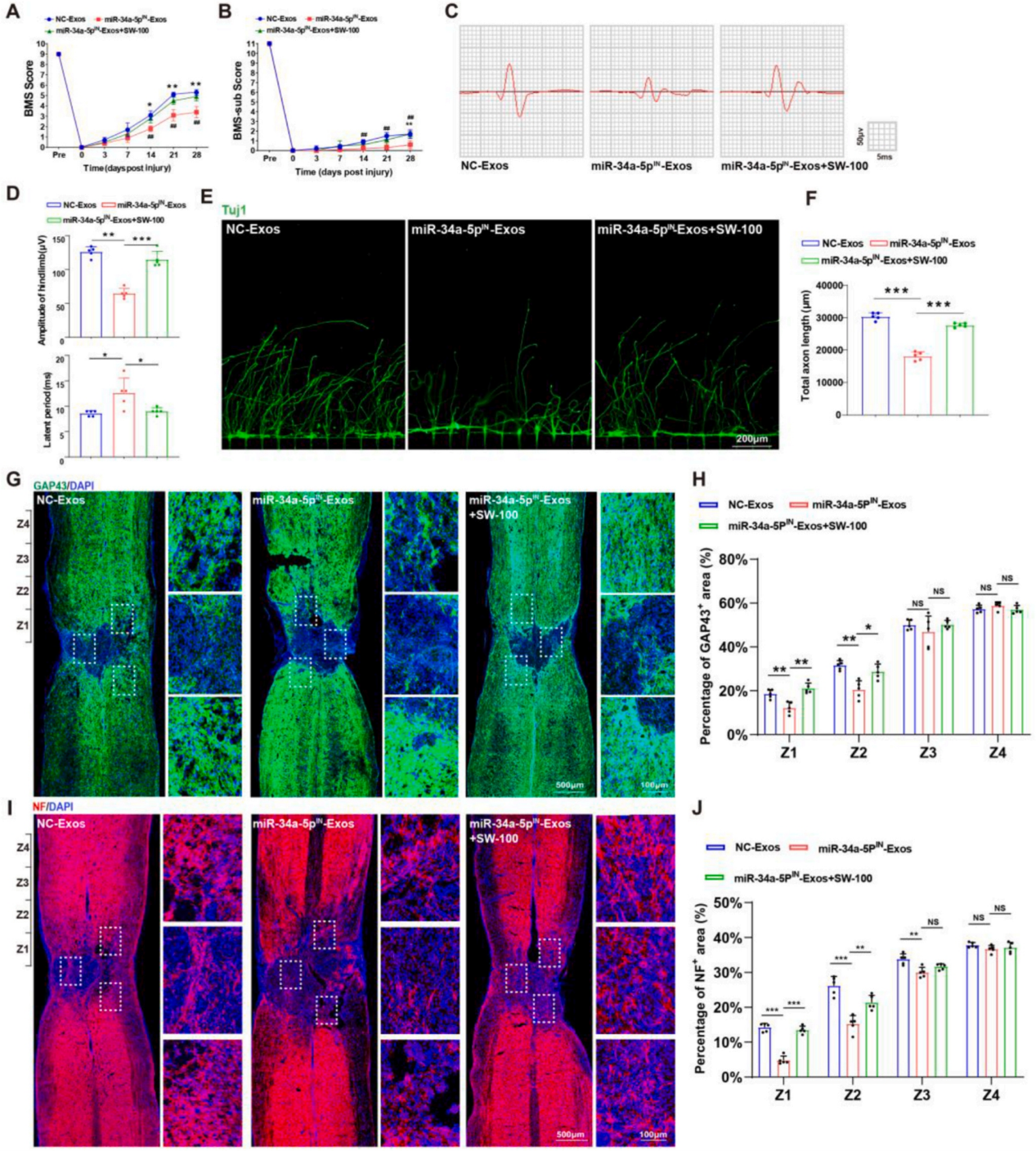
图9. EGFR+NSC-Exos通过miR-34a-5p/HDAC6通路促进SCI处理后脊髓功能恢复
迄今为止,针对SCI尚未发现比较有效且完善的靶向治疗方案。本研究中包埋EGFR+NSCs-Exos的3D打印水凝胶贴片有效促进了SCI处理后损伤部位神经轴突的再生,使神经功能得到了明显的恢复,为SCI修复提供了一种新颖且精确的无细胞治疗策略。

查看更多

查看更多
查看更多

联系我们

返回顶部